Международный эндокринологический журнал Том 18, №1, 2022
Вернуться к номеру
Динаміка ендокринних та обмінних зрушень у пацієнтів з ішемічною хворобою серця, цукровим діабетом 2-го типу і метаболічним синдромом при лікуванні телмісартаном
Авторы: Чмир Н.В.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
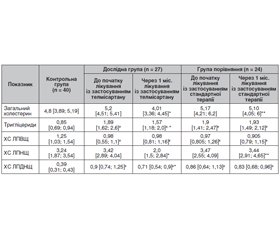
Актуальність. Взаємозв’язок ренін-ангіотензинової та гіпоталамо-гіпофізарної систем — патогенетична ланка багатьох коморбідних захворювань, зокрема цукрового діабету (ЦД) 2-го типу та ішемічної хвороби серця (ІХС). Зацікавленість гормональних структур як гіпофіза, гіпоталамуса, так і периферичних органів ендокринної системи підтверджена в багатьох роботах. Наявність спільних ланок патогенезу й регулюючих чинників змушує шукати нові методи патогенетичного лікування, які б мали комплексну дію на коморбідну патологію. Одним із таких напрямків лікування є застосування телмісартану — блокатора рецепторів ангіотензину-2. Однак зміни гормонального статусу, ліпідного спектра, що характеризують стан пацієнта в процесі лікування, залишаються вивченими недостатньо, що й зумовлює доцільність проведення цього дослідження. Мета дослідження: вивчення динаміки ендокринних та обмінних зрушень у пацієнтів з ішемічною хворобою серця та цукровим діабетом 2-го типу на тлі метаболічного синдрому (МС) при лікуванні телмісартаном. Матеріали та методи. Обстежено 51 пацієнта (26 жінок, 25 чоловіків) з ІХС та ЦД 2-го типу, який виник на тлі метаболічного синдрому. Дослідження проводилось в умовах Львівського обласного державного клінічного лікувально-діагностичного ендокринологічного центру та КНП «П’ята міська клінічна лікарня м. Львова». Пацієнтів поділено на дві групи — дослідну та групу порівняння залежно від призначеного лікування. До дослідної групи (n = 27) увійшли хворі на ІХС та ЦД 2-го типу (на тлі МС) (жінок — 14, чоловіків — 13), які отримували телмісартан 80 мг/добу та стандартну терапію. Групу порівняння становили 24 хворі на ІХС та ЦД 2-го типу (на тлі МС) (жінок — 12, чоловіків — 12), які отримували стандартну терапію. До контрольної групи ввійшли 40 практично здорових осіб (чоловіків — 17 (42,5 %), жінок — 23 (57,5 %)). Обстеження проведене при надходженні до стаціонару й через один місяць після початку лікування. У пацієнтів визначали рівень пролактину, кортизолу, вільного тироксину та тиреотропного гормона, а також показники ліпідного спектра. Результати. У роботі досліджено динаміку рівнів пролактину, кортизолу, вільного тироксину й тиреотропного гормона у хворих на ІХС та ЦД 2-го типу, який виник на тлі МС, до лікування та через один місяць після початку прийому телмісартану. Згідно з результатами досліджень, виявлені такі зміни гормонального спектра та ліпідного обміну. Рівень кортизолу в дослідній групі при надходженні до стаціонару вірогідно не відрізнявся від контрольних величин, і через один місяць лікування відзначалася тенденція до його зниження порівняно з вихідним показником. У групі порівняння також була відзначена тенденція до зниження рівня кортизолу впродовж стандартного лікування порівняно з початковим показником. Отже, як лікування телмісартаном, так і стандартна терапія сприяють тенденції до зниження рівня кортизолу. Рівень пролактину в жінок дослідної групи до початку стаціонарного лікування статистично значуще не відрізнявся від значень контролю і через один місяць лікування вірогідно зростав, тоді як у жінок групи порівняння впродовж лікування відзначалася лише тенденція до його зростання. Рівень пролактину в чоловіків дослідної групи на початку спостереження був вірогідно вищим від значень контролю, упродовж лікування із застосуванням телмісартану статистично значуще підвищився, тоді як у групі порівняння показник цього гормона впродовж лікування вірогідно не змінювався. Отже, спостерігалось вірогідне зростання рівня пролактину в жінок та чоловіків у процесі лікування телмісартаном. Рівень тиреотропного гормона в пацієнтів дослідної групи до лікування був вірогідно вищим щодо контролю, статистично значуще знижувався впродовж лікування на відміну від пацієнтів групи порівняння, у яких рівень тиреотропного гормона при тенденції до підвищення на початку спостереження впродовж лікування вірогідно не змінювався. Вірогідне підвищення рівня вільного тироксину було характерне для пацієнтів дослідної групи впродовж лікування, тоді як показник вільного тироксину в пацієнтів групи порівняння в процесі лікування вірогідно не змінювався. Ліпідний спектр у пацієнтів і дослідної групи, і групи порівняння характеризувався вірогідним підвищенням рівня тригліцеридів, холестерину ліпопротеїдів дуже низької щільності та вірогідним зниженням показника холестерину ліпопротеїдів високої щільності. Застосування в складі стандартної терапії телмісартану супроводжувалось статистично значущим зниженням рівня загального холестерину (у межах референтних значень), тригліцеридів, холестерину ліпопротеїдів низької щільності та холестерину ліпопротеїдів дуже низької щільності. Висновки. Застосування телмісартану в складі комплексної терапії сприяє зниженню рівня кортизолу (р > 0,05), вірогідному підвищенню значень пролактину в жінок та чоловіків (у межах референтних значень), вірогідному зростанню вТ4 та, відповідно, зменшенню рівня тиреотропного гормона, що свідчить про участь телмісартану в корекції порушень метаболізму, зокрема проявів субклінічного гіпотиреозу. Телмісартан сприятливо впливає на ліпідний спектр крові, вірогідно знижуючи значення загального холестерину, тригліцеридів, холестерину ліпопротеїдів низької щільності, а також холестерину ліпопротеїдів дуже низької щільності.
Background. The correlation between renin-angiotensin system and hypothalamic-pituitary system is a pathogenetic link leading to many comorbid diseases, particularly type 2 diabetes mellitus (DM) and coronary artery disease (CAD). Several studies have been dedicated to the hormones of the pituitary gland, hypothalamus as well as peripheral organs of the endocrine system. The presence of common links between pathogenesis and regulating factors forces us to search for new methods of treatment which should have an overall effect on comorbid diseases. The use of telmisartan, which is a blocker of angiotensin II receptors, is among various treatment options. Nevertheless, the changes in hormonal status and lipid spectrum, which are characteristic of the patient’s condition in the course of treatment, remain to be insufficiently researched. This is the reason that justifies the expediency of our research. The study is aimed at scrutinizing the dynamics of endocrine and metabolic changes in patients suffering from coronary artery disease, type 2 diabetes mellitus caused by metabolic syndrome (MS) while treating with telmisartan. Materials and methods. Fifty-one patients (26 female and 25 male patients) suffering from coronary artery disease and type 2 diabetes mellitus triggered by metabolic syndrome were examined in Lviv Regional State Clinical Medical Treatment and Diagnostic Endocrinology Center and CNE “City Clinical Hospital 5 in Lviv”. The patients were divided into two groups: experimental group and comparison group depending on the treatment prescribed. The experimental group consisted of patients (n = 27) suffering from CAD, type 2 DM and MS (women — 14, men — 13) who were prescribed with telmisartan 80 mg/day and standard therapy. The comparison group consisted of 24 patients with CAD and type 2 DM caused by MS (women — 12, men — 12) who were prescribed with standard therapy. The control group consisted of 40 healthy individuals (men — 17 (42.5 %), women — 23 (57.5 %)). The first examination was conducted on admission to an inpatient department and the second one was performed in a month after the beginning of treatment. Patients’ levels of prolactin, cortisol, free thyroxine, and thyroid-stimulating hormone as well as lipid spectrum parameters were defined. Results. The dynamics of the changes of prolactin, cortisol, free thyroxine, and thyroid-stimulating hormone levels in patients suffering from CAD, type 2 DM caused by MS was studied before and a month after the start of treatment with telmisartan. The results of the study demonstrated the changes in hormonal spectrum and lipid metabolism after the beginning of treatment with telmisartan. The cortisol level in the experimental group was not significantly different from the control values on admission to the inpatient department. Within a month of treatment, the cortisol level exhibited a tendency to decrease in comparison with its initial level. The cortisol level in the comparison group also tended to reduce in standard therapy if compared to its initial level. Therefore, both treatment with Telmisartan and standard therapy contributed to the reduction of the cortisol level. Before the start of treatment in the inpatient department, the prolactin level in women of the experimental group was not significantly different from the control values and kept increasing substantially within a month of treatment, whereas the prolactin level in females of the comparison group exhibited only a growing tendency within the course of treatment. At the beginning of observation, the prolactin level in men of the experimental group was significantly higher than the control values. While treating with telmisartan, the level of prolactin in males of the experimental group increased significantly, whereas in the comparison group, it did not change dramatically. Therefore, a considerable increase of prolactin levels in males and females was observed in telmisartan treatment. The level of thyroid-stimulating hormone in patients of the experimental group was significantly higher if compared with the control values before the beginning of treatment. The level of the above-mentioned hormone kept decreasing considerably within the course of treatment unlike the thyroid-stimulating hormone level in patients of the comparison group which tended to increase at the beginning of observation and did not change dramatically in the course of treatment. The major increase in free thyroxine level was typical for the patients in the experimental group within the course of treatment, while the level of free thyroxine in the patients of the comparison group did not change significantly in the course of treatment. A dramatic increase in levels of triglycerides as well as very-low density lipoprotein cholesterol and a significant decrease in high-density lipoprotein cholesterol were typical for the lipid spectrum in patients of both experimental and comparison groups. The use of telmisartan as a part of standard therapy was accompanied by a significant decrease in total cholesterol (within the reference values), triglycerides, low density lipoprotein cholesterol and very-low density lipoprotein cholesterol. Conclusions. The use of telmisartan as a part of combined therapy facilitates the reduction of the cortisol level (p > 0.05) and leads to a significant rise in male and female prolactin levels (within the range of reference values). It triggers an apparent increase in free thyroxine and decrease in thyroid-stimulating hormone. These findings reveal the impact of telmisartan on the correction of metabolic disorders, particularly the effect on the manifestations of subclinical hypothyroidism. Telmisartan has a beneficial effect on the lipid spectrum of blood. It greatly reduces the levels of total cholesterol, triglycerides, low density lipoprotein cholesterol as well as very-low density lipoprotein cholesterol.
телмісартан; кортизол; пролактин; тиреотропний гормон; ішемічна хвороба серця; цукровий діабет 2-го типу
telmisartan; cortisol; prolactin; thyroid-stimulating hormone; coronary artery disease; type 2 diabetes mellitus
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Ocaranza M.P., Riquelme J.A., García L., Jalil J.E. Counter-regulatory renin-angiotensin system in cardiovascular disease. Nat. Rev. Cardiol. 2020. 17(February). doi: 10.1038/s41569-019-0244-8.
- Takimoto-Ohnishi E., Murakami K. Renin-angiotensin system research: from molecules to the whole body. J. Physiol Sci. 2019. 69. 581-7. doi: 10.1007/s12576-019-00679-4.
- Dikha Ayu Kurnia, Yulia Yu. Understanding food selectionand dieting patterns: type 2 diabetes mellitus patients and their families. International Journal of Endocrinology (Ukraine). 2021. 17(6). 456-458. doi: 10.22141/2224-0721.17.6.2021.243204.
- Falalyeyeva T., Mamula Y., Scarpellini E., Leshchenko I., Humeniuk A., Pankiv I., Kobyliak N. Probiotics and obesity associated disease: an extended view beyond traditional strains. Minerva Gastroenterology. 2021. 67(4). 348-356. doi: 10.23736/S2724-5985.21.02909-0.
- Villapol S., Saavedra J.M. Neuroprotective effects of angiotensin receptor blockers. Am. J. Hypertens. 2015 Mar. 28(3). 289-99. doi: 10.1093/ajh/hpu197.
- Bochar O.M., Sklyarova H.Y., Abrahamovych K.Y., Hromnats’ka N.M., Bochar V.T., Sklyarov E.Y. Metabolic syndrome, overweight, hyperleptinemia in children and adults. Wiad Lek. 2021. 74(2). 313-6. doi: 10.36740/WLek202102126.
- Chen T., Xing J., Liu Y. Effects of telmisartan on vascular endothelial function, inflammation and insulin resistance in patients with coronary heart disease and diabetes mellitus. Exp. Ther. Med. 2018 Jan. 15(1). 909-913. doi: 10.3892/etm.2017.5451.
- Huang Y., Li Y., Liu Q., Zhang J., Zhang Z., Wu T. et al. Telmisartan attenuates obesity-induced insulin resistance via suppression of AMPK mediated ER stress. Biochem. Biophys. Res. Commun. 2020. 523(3). 787-94. doi: 10.1016/j.bbrc.2019.12.111.
- Macotela Y., Triebel J., Clapp C. Time for a New Perspective on Prolactin in Metabolism. Trends Endocrinol. Metab. 2020. 31(4). 276-86. doi: 10.1016/j.tem.2020.01.004.
- Therkelsen K.E., Abraham T.M., Pedley A., Massaro J.M., Sutherland P., Hoffmann U., Fox C.S. Association between Prolactin and Incidence of Cardiovascular Risk Factors in the Framingham Heart Study. J. Am. Heart Assoc. 2016 Feb 23. 5(2). e002640. doi: 10.1161/JAHA.115.002640.
- Li J., Rice M.S., Huang T., Hankinson S.E., Clevenger C.V., Hu F.B., Tworoger S.S. Circulating prolactin concentrations and risk of type 2 diabetes in US women. Diabetologia. 2018 Dec. 61(12). 2549-2560. doi: 10.1007/s00125-018-4733-9.
- Ponce A.J., Galván-Salas T., Lerma-Alvarado R.M., Ruiz-Herrera X., Hernández-Cortés T., Valencia-Jiménez R., Cárdenas-Rodríguez L.E. et al. Low prolactin levels are associated with visceral adipocyte hypertrophy and insulin resistance in humans. Endocrine. 2020 Feb. 67(2). 331-343. doi: 10.1007/s12020-019-02170-x.
- Popović D., Damjanović S., Djordjević T., Martic D., Ignjatović S., Milinković N., Banović M. et al. Stress hormones at rest and following exercise testing predict coronary artery disease severity and outcome. Stress. 2017 Sep. 20(5). 523-531. doi: 10.1080/10253890.2017.1368488.
- Rawish E., Nickel L., Schuster F., Stölting I., Frydrychowicz A., Saar K. et al. Telmisartan prevents development of obesity and normalizes hypothalamic lipid droplets. J. Endocrinol. [Internet]. 2020. 244. 95-110. doi: 10.1530/JOE-19-0319. Available from: https://joe.bioscientifica.com
- Abo-Youssef A.M., Khallaf W.A., Khattab M.M., Messiha B.A.S. The anti-Alzheimer effect of telmisartan in a hyperglycemic ovariectomized rat model; role of central angiotensin and estrogen receptors. Food Chem. Toxicol. 2020 Aug. 142. 111441. doi: 10.1016/j.fct.2020.111441.
- Liu J., Zhang L., Fu J., Wang Q., Wang G. Circulating Prolactin Level Is Increased in Metabolically Healthy Obesity. Endocr. Connect. [Internet]. 2021. 10(4). 484-91. doi: 10.1530/EC-21-0040.
- Calissendorff J., Falhammar H. To Treat or Not to Treat Subclinical Hypothyroidism, What Is the Evidence? Medicina (Kaunas). 2020 Jan 19. 56(1). 40. doi: 10.3390/medicina56010040.
- Pankiv V.I., Yuzvenko T.Yu., Pankiv I. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of Endocrine Pathology. 2019. 2. 46-51. doi: 10.21856/j-PEP.2019.2.07.
- Chen H., Li M., Liu L., Zhu D., Tian G. Telmisartan improves myocardial remodeling by inhibiting leptin autocrine activity and activating PPARγ. Exp. Biol. Med. (Maywood). 2020 Apr. 245(7). 654-666. doi: 10.1177/1535370220908215.
- Wang Y., Xue J., Li Y., Zhou X., Qiao S., Han D. Telmisartan protects against high glucose/high lipid-induced apoptosis and insulin secretion by reducing the oxidative and ER stress. Cell. Biochem. Funct. 2019 Apr. 37(3). 161-168. doi: 10.1002/cbf.3383.

/30.jpg)
/31.jpg)