Международный эндокринологический журнал Том 18, №2, 2022
Вернуться к номеру
Скринінг метаболічного синдрому у дітей і підлітків
Авторы: Громнацька Н.М. (1), Лемішко Б.Б. (1), Куля О.О. (1), Пасічна І.О. (1), Белюсова В.М. (2)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — КНП-1 «Територіальне медичне об’єднання м. Львова», Лікарня св. Пантелеймона, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
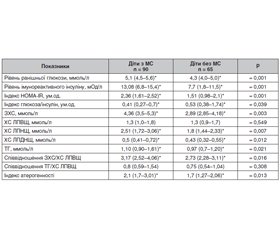
Актуальність. Метаболічний синдром (МС) трактують як кластер факторів ризику кардіоваскулярних захворювань та цукрового діабету (ЦД) 2-го типу. Поширеність МС у дітей і підлітків сягає 6–39 % залежно від критеріїв ідентифікації. Незважаючи на значну увагу, яку приділяють МС у дітей, відсутній єдиний узгоджений консенсус для його раннього скринінгу. Мета дослідження: вивчити поряд із загальновизнаними додаткові маркери для скринінгу МС у дітей і підлітків. Матеріали та методи. Дослідження є проспективним популяційним динамічним з метою перевірки гіпотези. Вивчені клінічні та лабораторно-інструментальні показники для скринінгу МС у 155 дітей віком 9–18 років, які сформували дві групи: група дітей з МС — 90 дітей з МС на тлі абдомінального ожиріння та група дітей без МС — 65 дітей з нормальною масою тіла. Верифікацію МС проводили згідно з рекомендаціями IDF Consensus (2007). Результати. Для скринінгу МС поряд із загальновизнаними критеріями згідно з IDF Consensus (2007) — абдомінальне ожиріння за обводом талії > 90-го перцентиля, рівень ранішньої глюкози > 5,6 ммоль/л, тригліцеридемія > 1,7 ммоль/л, артеріальний тиск > 130/85 мм рт.ст., встановлені найбільш вірогідні додаткові маркери: антропометричні (обвід шиї, обвід стегон, співвідношення обвід талії/обвід стегон, площа поверхні тіла > 90-го перцентиля розподілу згідно з віком і статтю), лабораторні (ранішній інсулін > 15,0 мОд/л, індекс НОМА-IR > 2,8, загальний холестерин > 5,2 ммоль/л, ХС ЛПНЩ > 3,25 ммоль/л, ХС ЛПДНЩ > 0,78 ммоль/л), гемодинамічні (артеріальний тиск за показниками розподілу > 95-го перцентиля згідно з віком і статтю), що сприяє ранньому його виявленню. Висновки. Розширення переліку маркерів для раннього скринінгу МС у дитячій і підлітковій популяції є актуальним і створює основу для його вчасної корекції та профілактики.
Background. Metabolic syndrome (MS) is perceived as a cluster of risk factors for cardiovascular disease and type 2 diabetes. The prevalence of MS in children and adolescents reaches 6–39 % depending on the identification criteria. Despite the considerable attention paid to MS in children and adolescents, there is no unified agreed consensus on its early screening. Consequently, the purpose of the study was along with the generally accepted criteria evaluate additional markers for MS early screening in children and adolescents. Materials and methods. A cross sectional study was conducted with 155 children aged 9–18 years, which formed 2 groups: a group of children with MS — 90 children with MS on the background of abdominal obesity and a group of children without MS — 65 children with normal body weight. Clinical (antrometric data, blood pressure) and laboratory (fasting glucose, fasting insulin, lipids) parameters were assessed. MS verification was performed according to the recommendations of the IDF Сonsensus (2007). Results. For MS screening in addition to the generally accepted criteria according to IDF Consensus (2007): abdominal obesity (waist circumference > 90th percentile according to age and gender), fasting glucose > 5.6 mmol/l, triglycerides > 1.7 mmol/l, blood pressure > 130/85 mm Hg, the most probable additional markers were established: neck and hip circumference, waist/hip ratio, body surface area > 90th percentile of distribution according to age and sex, fasting insulin > 15.0 mU/l, homeostasis model assessment for insulin ratio (HOMA-IR) > 2.8, total cholesterol > 5.2 mmol/l, LDL-C > 3.25 mmol/l, VLDL-C > 0.78 mmol/l, blood pressure in terms of distribution > 95th percentile, which contributes to its early detection and correction. Conclusions. Expanding the list of MS additional markers for its early screening in the pediatric and adolescent population is relevant and provides a basis for its timely correction and prevention.
метаболічний синдром; скринінг; додаткові маркери; діти; підлітки
metabolic syndrome; screening; additional markers; children; adolescents
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Grootendorst D.C., Jager K.J., Zoccali C., Dekker F.W. Screening: why, when, and how. Kidney Int. 2009. 76(7). 694-9. doi: 10.1038/ki.2009.232.
- Smith R.A. Can we improve on Wilson and Jungner’s principles of screening for disease? CMAJ. 2018. 190(14). E414-E415; DOI: https://doi.org/10.1503/cmaj.180330.
- Costa R.F., Santos N.S., Goldraich N.P., Barski T.F., Andrade K.S., Kruel L.F. Metabolic syndrome in obese adolescents: a comparison of three different diagnostic criteria. J. Pediatr. (Rio J). 2012. 88(4). 303-9. doi: 10.2223/JPED.2200.
- Silveira L.S., Buonani C., Monteiro P.A., Antunes B.M.M., Freitas Júnior I.F. Metabolic syndrome: criteria for diagnosing in children and adolescents. Endocrinol. Metab. Synd. 2013. 2. 118. doi. 10.4172/2161-1017.1000118.
- Thomas N.E., Rowe D.A., Murtagh E.M., Stephens J.W., Williams R. Associations between metabolic syndrome components and markers of inflammation in Welsh school children. Eur. J. Pediatr. 2018. 177(3). 409-417. doi: 10.1007/s00431-017-3065-y.
- Bussler S., Penke M., Flemming G., et al. Novel insights in the metabolic syndrome in childhood and adolescence. Horm. Res. Paediatr. 2017. 88. 181-93. https://doi.org/10.1159/000479510.
- Peña-Espinoza B.I., Granados-Silvestre M.L.Á., Sánchez-Pozos K., Ortiz-López M.G., Menjivar M. Metabolic syndrome in Mexican children: Low effectiveness of diagnostic definitions. Endocrinol Diabetes Nutr. 2017. 64(7). 369-376. (in English, Spanish). doi: 10.1016/j.endinu.2017.04.004.
- Freedman D.S., Dietz W.H., Srinivasan S.R., Berenson G.S. The relation of overweight to cardiovascular risk factors among children and adolescents: the Bogalusa Heart Study. Pediatrics. 1999. 103(6 Pt 1). 1175-82. doi: 10.1542/peds.103.6.1175. PMID: 10353925.
- Andrabi S.M., Bhat M.H., Andrabi S.R., Kamili M.M., Imran A., Nisar I., Nisar U. Prevalence of metabolic syndrome in 8-18-year-old school-going children of Srinagar city of Kashmir India. Indian J. Endocrinol. Metab. 2013. 17(1). 95-100. doi: 10.4103/2230-8210.107812.
- Dutka R., Chmyr H., Svitlyk H., Leontieva Z. Prolactin, cortisol, free thyroxine and thyroid-stimulating hormone-markers of staging of metabolic syndrome as a risk factor for coronary artery disease and type 2 diabetes mellitus. GMN. 2019. 297. 80-3. PMID: 32011300.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA. 2001. 285(19). 2486-97. doi: 10.1001/jama.285.19.2486.
- AACE. American Association of Clinical Endocrinologists Medical Guidelines for clinical practice for developing diabetes mellitus. Comprehensive care plan. Endocr. Pract. 2011. 17(1). http://www.aace.com/tibs/dm-guidlines ccp p2t.
- Zimmet P., Alberti K.G., Kaufman F., et al. IDF Consensus Group. The metabolic syndrome in children and adolescents — an IDF Consensus report. Pediatr. Diabetes. 2007. 8(5). 299-306. doi: 10.1111/j.1399-5448.2007.00271.x. PMID: 17850473.
- Dündar I., Akıncı A. Prevalence of type 2 diabetes mellitus, metabolic syndrome, and related morbidities in overweight and obese children. J. Pediat. Endocr. Metab. 2022. https://doi.org/10.1515/jpem-2021-0271.
- De Lorenzo A., Gratteri S., Gualtieri P., Cammarano A., Bertucci P., Di Renzo L. Why primary obesity is a disease? J. Transl. Med. 2019. 17(1). 169. doi: 10.1186/s12967-019-1919-y.
- Jastreboff A.M., Kotz C.M., Kahan S., Kelly A.S., Heymsfield S.B. Obesity as a Disease: The Obesity Society 2018 Position Statement. Obesity (Silver Spring). 2019. 27(1). 7-9. doi: 10.1002/oby.22378. PMID: 30569641.
- Christian A.H., Mochari H., Mosca L.J. Waist circumference, body mass index, and their association with cardiometabolic and global risk. J. Cardiometab. Syndr. 2009. 4(1). 12-9. doi: 10.1111/j.1559-4572.2008.00029.x.
- Falalyeyeva T., Mamula Y., Scarpellini E., Leshchenko I., Humeniuk A., Pankiv I., Kobyliak N. Probiotics and obesity associated disease: an extended view beyond traditional strains. Minerva Gastroenterol. (Torino). 2021. 67(4). 348-356. doi: 10.23736/S2724-5985.21.02909-0. PMID: 35040301.
- Magalhães E.I.S., Sant'Ana L.F.R., Priore S.E., Franceschini S.C.C. Waist circumference, waist/height ratio, and neck circumference as parameters of central obesity assessment in children. Rev. Paul Pediatr. 2014. 32(3). 273-81. doi: 10.1590/0103-0582201432320.
- Alberti K.G., Zimmet P.Z. Definition, diagnosis and classification of diabetes mellitus and its complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabet. Med. 1998 Jul. 15(7). 539-53. doi: 10.1002/(SICI)1096-9136(199807)15:7<539::AID-DIA668>3.0.CO;2-S. PMID: 9686693.
- Bochar O.M., Sklyarova H.Y., Abrahamovych K.Y., Hromnats'ka N.M., Bochar V.T., Sklyarov E.Y. Metabolic syndrome, overweight, hyperleptinemia in children and adults. Wiadomosci Lekarskie. 2021. 74 (2). 313-6. PMID: 33813493.
- National High Blood Pressure Education Program Working Group on High Blood Pressure in Children and Adolescents. The Fourth report on the diagnosis, evaluation, and treatment of high blood pressure in children and adolescents. Pediatrics. 2004. 114(2 Suppl. 4th Report). 555-76. PMID: 15286277.
- Botsiurko V., Didushko O., Kostitska I. Do we need a diagnosis of metabolic syndrome? International Journal of Endocrinology (Ukraine). 2018. 14(6). 590-592. https://doi.org/10.22141/2224-0721.14.6.2018.146070 (in Ukrainian).
- Alberti K.G., Zimmet P., Shaw J. Metabolic syndrome — a new world-wide definition. A Consensus Statement from the International Diabetes Federation. Diabet. Med. 2006. 23(5). 469-80. doi: 10.1111/j.1464-5491.2006.01858.x. PMID: 16681555.
- Flemming G.M.C., Bussler S., Körner K., Kiess W. Definition and early diagnosis of metabolic syndrome in children. J. Pediat. Endocrin. Metab. 2020. https://doi.org/10.1515/jpem-2019-0552.
- Zhao Y., Yingjie Yu.Y., Hong Li, Li M., et al. The association between metabolic syndrome and biochemical markers in Beijing adolescents. Int. J. Environ. Res. Public Health. 2019. 16(22). 4557. doi: 10.3390/ijerph16224557.

/17.jpg)