Международный эндокринологический журнал Том 18, №2, 2022
Вернуться к номеру
Показники мелатоніну в слині дівчат-підлітків із синдромом полікістозних яєчників
Авторы: Сорокман Т.В., Макарова О.В., Остапчук В.Г.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
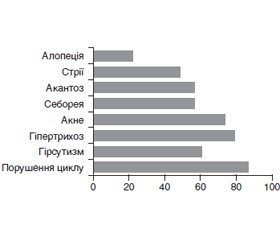
Актуальність. Формування синдрому полікістозних яєчників (СПКЯ) та маніфестація його клінічних проявів часто розпочинаються саме у підлітковому віці. Останніми роками одним із нових та сучасних напрямів у вивченні порушень репродуктивної функції є проблема впливу мелатоніну на гонадотропну функцію гіпофіза (оваріогенез). Мета дослідження: визначити рівень мелатоніну в слині дівчат-підлітків із СПКЯ. Матеріали та методи. Проведено одноцентрове проспективне просте рандомізоване дослідження з обстеженням 23 пацієнток віком 14–18 років включно із СПКЯ. Групу контролю становили 25 дівчаток аналогічного віку без порушень гінекологічного статусу. Визначення рівня мелатоніну в слині проводилося методом високоефективної рідинної хроматографії з тандемною мас-спектрометрією. Пацієнтки перед забором слини за добу та протягом усього періоду забору слини виключали вживання кофеїну, алкоголю, фізичні навантаження, а також не курили впродовж години перед забором, не чистили зубів, не використовували зубної нитки, ополіскувачів порожнини рота та жувальної гумки. Результати. Вірогідних відмінностей за віком дівчата основної групи та групи порівняння не мали (16,70 ± 0,11 року в основній групі та 16,90 ± 0,14 року у групі порівняння, р > 0,05). Найчастішими симптомами СПКЯ у дівчат були: гіпоменструальний синдром (86,9 %), дермопатія (82,6 %) та гірсутизм (60,8 %). У дівчат із СПКЯ були вірогідно вищі показники мелатоніну в слині (03:00) (28,89 [18,17; 46,53] пг/мл), ніж у дівчат групи порівняння (12,07 [11,56; 16,27] пг/мл, p < 0,01). Вірогідної різниці в рівнях мелатоніну в слині залежно від віку не встановлено. Висновки. Результати дослідження вказують на порушення гормонального балансу при синдромі полікістозних яєчників, зокрема підвищення рівня мелатоніну, що вказує на необхідність його визначення в процесі діагностики та лікування.
Background. The formation of polycystic ovary syndrome (PCOS) and the manifestation of its clinical manifestations often begin in adolescence. In recent years, one of the new and modern areas in the study of reproductive dysfunction is the problem of melatonin on the gonadotropic function of the pituitary gland (ovariogenesis). The purpose of the study was to determine the level of melatonin in the saliva of adolescent girls with PCOS. Materials and methods. A single-center prospective simple randomized study was conducted with 23 patients aged 14–18 years (inclusive) with PCOS. The control group consisted of 25 girls of the same age without gynecological status violations. Determination of melatonin levels in saliva was performed by high performance liquid chromatography with tandem mass spectrometry (HPLC-MS). Before salivation during the day and throughout the saliva collection period, patients excluded caffeine, alcohol, and exercise, did not smoke for one hour before collection, did not brush their teeth, did not floss, rinsed their mouths, and did not chew gum. Results. There were no significant differences in the age of the girls in the main group and the comparison group (16.70 ± 0.11 years in the main group and 16.90 ± 0.14 years in the comparison group, p > 0.05). The most common symptoms of PCOS in girls were: hypomenstrual syndrome (86.9 %), dermopathy (82.6 %) and hirsutism (60.8 %). Girls with PCOS had significantly higher melatonin levels in saliva (03:00) (28.89 [18.17; 46.53] pg/ml) compared to girls in the comparison group (12.07 [11.56; 16.27] pg/ml, p < 0.01). A probable difference in melatonin levels in saliva depending on age has not been established. Conclusions. The results of the study indicate a violation of hormonal balance in polycystic ovary syndrome, in particular an increase in melatonin levels, which indicates the need to determine it in the process of diagnosis and treatment.
дівчата-підлітки; синдром полікістозних яєчників; мелатонін
adolescent girls; polycystic ovary syndrome; melatonin
Вступ
Матеріали та методи
Результати
/22.jpg)
/23_2.jpg)
Обговорення
Висновки
- Semenyna H.B., Pankiv V.І., Pashkovska N.V., Korytko O.O., Pankiv I.V. Ovarial factors in the pathogenesis of chronic anovulation in polycystic ovary syndrome. Problems of Endocrine Pathology. 2021. 71(1). 65-71. https://doi.org/10.21856/j-PEP.2020.1.09.
- Sadeeqa S., Mustafa T., Latif S. Polycystic ovarian syndrome-related depression in adolescent girls: A Review. J. Pharm. Bioall Sci. 2018. 10. 55-9. doi: 10.4103/JPBS.JPBS_1_18.
- Semeniuk L.M., Yuzvenko T.Yu., Larina O.V. Features of carbohydrate metabolism in women of early reproductive age with polycystic ovary syndrome. International Journal of Endocrinology (Ukraine). 2018. 14(3). 229-234. https://doi.org/10.22141/2224-0721.14.3.2018.136417 [in Ukrainian].
- Uk A., Decanter C., Grysole C. Polycystic ovary syndrome phenotype does not have impact on oocyte morphology. Reprod. Biol. Endocrinol. 2022. 20(7). https://doi.org/10.1186/s12958-021-00874-2.
- Shi B., Feng D., Sagnelli M., Jiao J., Sun X., Wang X., Li D. Fructose levels are elevated in women with polycystic ovary syndrome with obesity and hyperinsulinemia. Hum. Reprod. 2020. 35 (1). 181-194. DOI: 10.1093/humrep/dez239.
- Wawrzkiewicz-Jałowiecka A., Kowalczyk K., Trybek P. In Search of New Therapeutics-Molecular Aspects of the PCOS Pathophysiology: Genetics, Hormones, Metabolism and Beyond. Int. J. Mol. Sci. 2020. 21(19). 7054. doi: 10.3390/ijms21197054.
- Yu K., Wang R.X., Li M.H. Melatonin Reduces Androgen Production and Upregulates Heme Oxygenase-1 Expression in Granulosa Cells from PCOS Patients with Hypoestrogenia and Hyperandrogenia. Oxid Med. Cell Longev. 2019. 2019. 8218650. doi: 10.1155/2019/8218650.
- Danilova M.V., Usoltseva E.N. Significance of the pineal gland hormone melatonin in maintaining the health of women of reproductive age (a review). Obstetrics, gynecology and reproduction. 2019. 4. 337-334 (in Russian). doi: https://doi.org/10.17749/2313-7347.2019.13.4.337-344.
- Amaral F.G.D., Cipolla-Neto J. A brief review about melatonin, a pineal hormone. Arch. Endocrinol. Metab. 2018. 62(4). 472-479. doi: 10.20945/2359-3997000000066.
- Al-Omary F.A. Melatonin: comprehensive profile. Profiles Drug Subst. Excip. Relat. Methodol. 2013. 38. 159-226. doi: 10.1016/B978-0-12-407691-4.00005-8.
- Mojaverrostami S., Asghari N., Khamisabadi M., Heidari Khoei H. The role of melatonin in polycystic ovary syndrome: A review. Int. J. Reprod. Biomed. 2019. 17(12). 865-882. doi: 10.18502/ijrm.v17i12.5789.
- Andreeva E.N., Absatarova Yu.S., Sheremetyeva E.V. Analysis of the informativeness of melatonin evaluation in polycystic ovary syndrome. Obesity and Metabolism. 2016. 13(4). 15-20. doi: 10.14341/OMET2016415-20.
- Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum. Reprod. 2004 Jan. 19(1). 41-7. doi: 10.1093/humrep/deh098. PMID: 14688154.
- The Rotterdam ESHRE/ASRM-Sponsored Consensus Workshop Group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil. Steril. 2004. 81(1). 19-25. https://doi.org/10.1016/j.fertnstert.2003.10.004.
- Sultan C., Paris F. Clinical expression of polycystic ovary syndrome in adolescent girls. Fertil Steril. 2006 Jul. 86 Suppl. 1. S6. doi: 10.1016/j.fertnstert.2006.04.015. PMID: 16798287.
- Yi S., Xu J., Shi H., Li W., Li Q., Sun Y.P. Association between melatonin receptor gene polymorphisms and polycystic ovarian syndrome: a systematic review and meta-analysis. Biosci. Rep. 2020. 40(6). BSR20200824. doi: 10.1042/BSR20200824.
- Kandemir Y.B., Konuk E., Katırcı E., Xxx F., Behram M. Is the effect of melatonin on vascular endothelial growth factor receptor-2 associated with angiogenesis in the rat ovary? Clinics (Sao Paulo). 2019. 74. e658. doi: 10.6061/clinics/2019/e658.
- Xu X.L., Deng S.L., Lian Z.X., Yu K. Estrogen Receptors in Polycystic Ovary Syndrome. Cells. 2021. 10(2). 459. doi: 10.3390/cells10020459.
- Liu Y., Yu Z., Zhao S. Oxidative stress markers in the follicular fluid of patients with polycystic ovary syndrome correlate with a decrease in embryo quality. J. Assist. Reprod. Genet. 2021. 38(2). 471-477. doi: 10.1007/s10815-020-02014-y.
- Shen M., Cao Y., Jiang Y., Wei Y., Liu H. Melatonin protects mouse granulosa cells against oxidative damage by inhibiting FOXO1-mediated autophagy: Implication of an antioxidation-independent mechanism. Redox Biol. 2018. 18. 138-157. doi: 10.1016/j.redox.2018.07.004.
- Ryu Y., Kim S.W., Kim Y.Y., Ku S.Y. Animal Models for Human Polycystic Ovary Syndrome (PCOS) Focused on the Use of Indirect Hormonal Perturbations: A Review of the Literature. Int. J. Mol. Sci. 2019. 20(11). 2720. doi: 10.3390/ijms20112720.
- Hatırnaz Ş., Ata B., Hatırnaz E.S., et al. Oocyte in vitro maturation: A sytematic review. Turk. J. Obstet Gynecol. 2018. 15(2). 112-125. doi: 10.4274/tjod.23911.

/22_2.jpg)
/23.jpg)