Резюме
Актуальність. Ішемічна хвороба серця — це накопичення атеросклеротичних бляшок у кровоносних судинах, які забезпечують серце киснем та поживними речовинами. Аортокоронарне шунтування (АКШ) — це стратегія реваскуляризації міокарда, яка показана пацієнтам з ураженням трьох і більше коронарних артерій, високими показниками SYNTAX, цукровим діабетом та систолічною дисфункцією лівого шлуночка. У переважній більшості випадків сьогодні АКШ виконується зі штучним кровообігом. Під час штучного кровообігу під впливом низки чинників відбувається зниження рівня деяких електролітів. Одним з них є фосфор — важливий елемент для всіх живих клітин, який виконує різні функції. Мета дослідження: дослідити ефективність застосування фруктозо-1,6-дифосфату з метою профілактики виникнення та зниження ступеня тяжкості гострої лівошлуночкової недостатності у пацієнтів, які перенесли оперативне втручання — аортокоронарне шунтування зі штучним кровообігом, у яких до операції була виявлена гіпофосфатемія. Матеріали та методи. У Державній науковій установі «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами було прооперовано 500 пацієнтів. Усім виконувалася операція АКШ зі штучним кровообігом. Відібрано 60 пацієнтів, у яких на доопераційному етапі було діагностовано гіпофосфатемію. Під гіпофосфатемією розумілося зменшення рівня фосфатів нижче за норму або рівень, що наближається до нижньої межі норми. До основної групи увійшли 30 пацієнтів, для корекції рівня фосфатів використовувався фруктозо-1,6-дифосфат (препарат Езафосфіна). До контрольної групи також увійшли 30 пацієнтів, корекція рівня фосфатів не проводилася. Статистично значимих відмінностей у групах (за статтю, віком, кількістю шунтів, що накладалися) не виявлено, р > 0,05. Дослідження рівня фосфатів проводилося до операції, одразу після закінчення штучного кровообігу та у ранньому післяопераційному періоді в динаміці. Результати. Уведення фруктозо-1,6-дифосфату проводилося (відповідно до інструкції виробника) у кількості 10 г у вигляді внутрішньовенної інфузії в період штучного кровообігу. Було верифіковане підвищення рівня фосфатів після введення препарату в основній групі, p < 0,05. Гемодинамічні розлади після операції у разі призначення фруктозо-1,6-дифосфату виникали в 1,76 раза рідше (р < 0,05), ніж у групі, де корекція гіпофосфатемії не проводилася. У разі виникнення гострої лівошлуночкової недостатності після АКШ зі штучним кровообігом час відновлення гемодинаміки від закінчення операції до стабілізації виявився вдвічі коротшим (р < 0,05) в основній групі порівняно з контрольною. А кількість спожитого інотропного препарату (добутаміну) в основній групі — в 2,6 раза (р < 0,05) менше, ніж у контрольній. Висновки. Застосування препарату фруктозо-1,6-дифосфату в комплексному лікуванні кардіохірургічних хворих, які перенесли аортокоронарне шунтування із штучним кровообігом, вірогідно коригує гіпофосфатемію (підвищує рівень фосфатів). Призначення фруктозо-1,6-дифосфату дозволяє знизити частоту розвитку гострої лівошлуночкової недостатності після АКШ зі штучним кровообігом у групі пацієнтів, у яких до операції було виявлено гіпофосфатемію. У разі її розвитку призначення фруктозо-1,6-дифосфату призводить до скорочення термінів відновлення гемодинаміки та зниження загальної дози інотропного препарату (добутаміну), необхідного для досягнення стабілізації.
Background. Coronary heart disease is the accumulation of atherosclerotic plaques in the blood vessels that supply the heart with oxygen and nutrients. Coronary artery bypass grafting is a strategy for myocardial revascularization that is indicated for patients with three or more coronary artery damage, high SYNTAX, diabetes, and left ventricular systolic dysfunction. In the vast majority of cases, CABG is currently performed with cardiopulmonary bypass. During the cardiopulmonary bypass, under the influence of a number of factors, there is a decrease in the level of some electrolytes. One of them is phosphorus — an important element for all living cells, which performs various functions. The purpose of the study was to study the effectiveness of fructose-1,6-diphosphate in order to prevent and reduce the severity of acute left ventricular failure in patients who underwent surgery — coronary artery bypass grafting with cardiopulmonary bypass, in which hypophosphatemia was detected before surgery. Materials and methods. 500 patients were operated on at the State Scientific Institution “Scientific and Practical Center of Preventive and Clinical Medicine” of the Agency of State Affairs. All underwent coronary artery bypass graft surgery with cardiopulmonary bypass. 60 patients were selected who were diagnosed with hypophosphatemia at the preoperative stage. Hypophosphatemia refers to a decrease in phosphate levels below normal, or levels approaching the lower limit of normal. The main group included 30 patients, for the correction of phosphate levels used fructose-1,6-diphosphate (drug Esafosfina). The control group also included 30 patients, no correction of phosphate levels was performed. No statistically significant differences in groups (by sex, age, number of bypasses imposed) were found, p > 0.05. The study of phosphate levels was performed before surgery, immediately after the end of cardiopulmonary bypass and in the early postoperative period in the dynamics. Results. The introduction of fructose-1,6-diphosphate was carried out (according to the manufacturer’s instructions) in an amount of 10 g as an intravenous infusion during cardiopulmonary bypass. An increase in the level of phosphates with fructose-1,6-diphosphate after administration of the drug in the main group, p < 0.05. Hemodynamic disorders after surgery, in the case of fructose-1,6-diphosphate, occurred 1.76 times less often (p < 0.05) than in the group where the correction of hypophosphatemia was not performed. In the case of acute left ventricular failure after CABG with artificial circulation, the recovery time of hemodynamics from surgery to stabilization was twice (p < 0.05) shorter in the main group compared with the control. And the amount of inotropic drug (dobutamine) consumed in the main group was 2.6 times (p < 0.05) less than in the control group. Conclusions. The use of the fructose-1,6-diphosphate in the complex treatment of cardiac surgery patients who underwent coronary artery bypass grafting with cardiopulmonary bypass, significantly corrects hypophosphatemia (increases phosphate levels). Administration of fructose-1,6-diphosphate reduces the incidence of acute left ventricular failure after CABG with cardiopulmonary bypass, in a group of patients who were diagnosed with hypophosphatemia before surgery. In case of its development, the appointment of fructose-1,6-diphosphate leads to a reduction in the recovery time of hemodynamics and a reduction in the total dose of inotropic drug (dobutamine), necessary to achieve stabilization.
Вступ
Атеросклероз є основною причиною серцево-судинних захворювань, таких як інфаркт міокарда, серцева недостатність, інсульт. Атеросклеротичні бляшки здебільшого локалізуються в інтимі середніх та великих артерій, особливо в їх біфуркаціях [1].
Ішемічна хвороба серця (ІХС) — це накопичення атеросклеротичних бляшок у кровоносних судинах, які забезпечують серце киснем та поживними речовинами. Складний процес атеросклерозу ініціюється дисфункцією ендотеліальних клітин, що вистилають коронарні артерії. Ці клітини не можуть належним чином регулювати тонус судин під впливом оксиду азоту. Прогресуюча інфільтрація стінки судини ліпопротеїновими частинками, що несуть холестерин, спричиняє запальну реакцію через навантажені холестерином макрофаги. Гладком’язові клітини стінки судини розростаються, що призводить до ремоделювання самої судини. Зрештою просвіт звужується та кровопостачання кардіоміоцитів погіршується [2].
Аортокоронарне шунтування (АКШ) — це стратегія реваскуляризації міокарда, яка показана пацієнтам з ураженням трьох і більше коронарних артерій, високими показниками SYNTAX, цукровим діабетом та систолічною дисфункцією лівого шлуночка [3]. АКШ — одна з найпоширеніших операцій, виконуваних у світі. З моменту її впровадження було запропоновано безліч змін для покращення результатів та зниження ризиків: АКШ на працюючому серці без штучного кровообігу, повна реваскуляризація з використанням променевої артерії, складні Y- або T-шунти з лівою внутрішньою грудною артерією, невелика передньобокова торакотомія. Проте результати, отримані від впровадження цих методів, не завжди задовільні. Тому в переважній більшості випадків сьогодні АКШ виконується зі штучним кровообігом (ШК). Крім того, операція, як і раніше, виконується з серединної стернотомії, застосовується кардіоплегія, для шунтування використовуються трансплантати підшкірної вени [4].
Під час ШК під впливом низки чинників відбувається зниження рівня деяких електролітів. Одним з них є фосфор — важливий елемент для всіх живих клітин, який виконує різні функції. Гідроксиапатит входить у структуру кістки, фосфоліпіди — у структуру клітинних мембран. Аденозинтрифосфат (АТФ) та креатинфосфат регулюють накопичення енергії та метаболізм. Нуклеїнові кислоти та нуклеопротеїни забезпечують трансляцію генів. Фосфорилювання білків — ключовий регуляторний механізм активації ферментів, сигнального клітинного каскаду. 2,3-дифосфогліцерат модулює вивільнення кисню гемоглобіном. Неорганічний фосфат входить до складу кислотно-основного буфера [5].
Гіпофосфатемія може бути спричинена трьома різними механізмами: зниженням кишкової абсорбції, підвищеною нирковою екскрецією або внутрішнім перерозподілом неорганічного фосфату. У більшості пацієнтів з тяжкою гіпофосфатемією виявляється як виснаження загальних запасів фосфору в організмі, так і перерозподіл фосфату у внутрішньоклітинний простір. Зниження кишкової абсорбції фосфату рідко спричиняє гіпофосфатемію, оскільки дієта з низьким умістом фосфатів збільшує ниркову реабсорбцію та збільшує кишкове поглинання фосфату. Перерозподіл через клітинну мембрану є найчастішою причиною гіпофосфатемії і може бути викликаний безліччю клінічних станів: викликане респіраторним алкалозом підвищення внутрішньоклітинного pH змушує фосфат проникати в клітину, стимулюючи гліколіз; уведення глюкози та інсуліну також стимулює вуглеводний обмін, під час якого фосфат транспортується у клітини разом із глюкозою; високі рівні у сироватці катехоламінів, таких як адреналін та норадреналін, ендогенні або екзогенні, спричиняють зниження сироваткового фосфату; ниркова екскреція фосфату збільшується при метаболічному ацидозі і при прийомі багатьох ліків, включаючи діуретики, глюкокортикоїди, аміноглікозиди, антиретровірусні та протипухлинні препарати [5].
Симптоми гіпофосфатемії виявляються при суттєвому зниженні рівня іонів фосфору в крові та знаходять відображення у вигляді: м’язової слабкості; серцевої та/або дихальної недостатності; розвитку судомного синдрому; парестезій; порушення функцій діафрагми; паралічу дихальної мускулатури; розвитку кардіоміопатії, рабдоміолізу; сплутаності свідомості, можливої коми [6].
Найбільш поширеним препаратом, який призначається для корекції гіпофосфатемії, є фруктозо-1,6-дифосфат (ФДФ). ФДФ — продукт, що утворюється під час розпаду вуглеводів у процесі утворення енергії та її кумуляції у вигляді макроергічного фосфатного зв’язку аденозинтрифосфату. Субстанція має низку ефектів: стимулює процес насичення тканин киснем завдяки підвищенню 2,3-дифосфогліцерату в еритроцитах; поляризує мембрани, полегшуючи проникнення в клітину іонів К+, виведення іонів Na+ та блокування входу іонів Са2+; підвищує стійкість еритроцитів до гемолізу; покращує обмін глюкози інсулінонезалежним шляхом. ФДФ може запобігти шкідливим наслідкам очікуваного періоду ішемії з наступною реперфузією, тим самим покращуючи функцію міокарда у пацієнта після АКШ.
Мета: дослідити ефективність застосування ФДФ з метою профілактики виникнення та зниження ступеня тяжкості гострої лівошлуночкової недостатності (ГЛШН) у пацієнтів, які перенесли оперативне втручання — аортокоронарне шунтування зі штучним кровообігом, у яких до операції була виявлена гіпофосфатемія.
Матеріали та методи
У ДНУ «НПЦ ПКМ» ДУС було прооперовано 500 пацієнтів. Усім виконувалася операція аортокоронарного шунтування зі штучним кровообігом. Відібрано 60 пацієнтів, у яких на доопераційному етапі було діагностовано гіпофосфатемію. Під гіпофосфатемією розумілося зменшення рівня фосфатів нижче за норму або рівень, що наближається до нижньої межі норми. Пацієнтів було поділено на дві групи по 30 осіб.
До основної групи увійшли 25 чоловіків та 5 жінок віком від 40 до 81 року, середня кількість шунтів становила 3,20 ± 0,61. Для корекції рівня фосфатів використовувався ФДФ (препарат Езафосфіна). До контрольної групи також увійшли 25 чоловіків та 5 жінок віком від 47 до 74 років, середня кількість шунтів становила 3,20 ± 0,55. Корекція рівня фосфатів не проводилася. Статистично значимих відмінностей у групах (за статтю, віком, кількістю шунтів, що накладалися) не виявлено, р > 0,05.
З метою верифікації однорідності груп було проведено низку досліджень. Порівнювалися показники центральної гемодинаміки та кисневого транспорту в обох групах у різних часових проміжках: до операції, після операції. Дослідження рівня фосфатів проводилося до операції, одразу після закінчення ШК та у ранньому післяопераційному періоді в динаміці.
Для аналізу результатів використано програму MedStat. Під час аналізу використано критерії порівняння для непов’язаних вибірок. Критичний рівень значущості дорівнював 0,05.
Результати та обговорення
Уведення ФДФ проводилося (відповідно до інструкції виробника) у кількості 10 г у вигляді внутрішньовенної інфузії в період штучного кровообігу.
Верифікація підвищення рівня фосфатів проводилася за допомогою статистичної обробки цього показника в основній групі до та після введення ФДФ. До введення рівень фосфатів у пацієнтів цієї групи становив 1,18 ± 0,21 ммоль/л, а після введення ФДФ — 1,74 ± 0,28 ммоль/л (рис. 1). На рисунку показано інтервальну оцінку показників фосфатемії до та після введення ФДФ в основній групі. Наведено середнє значення (точка), середнє відхилення (прямокутник) та 95% довірчий інтервал (вуса розподілу). При розрахунку критерію Стьюдента — порівняння середніх двох незалежних вибірок — отримано відмінності на рівні значущості p < 0,05.
У контрольній групі, навпаки, спостерігалося статистично значуще зниження (p < 0,05) фосфатів після проведення ШК. Так, на початку штучного кровообігу рівень фосфатів становив 1,28 ± 0,22 ммоль/л, а після завершення ШК — 1,08 ± 0,18 ммоль/л (рис. 2). На рисунку показано інтервальну оцінку показників фосфатемії до та після ШК у контрольній групі. Наведено середнє значення (точка), середнє відхилення (прямокутник) та 95% довірчий інтервал (вуса розподілу).
/42.jpg)
Центральна гемодинаміка оцінювалася за такими показниками: середній артеріальний тиск (СрАТ), частота серцевих скорочень (ЧСС), ударний індекс (УІ), серцевий індекс (СІ), загальний периферичний судинний опір (ЗПСО). Для оцінки кисневого транспорту використовувалися такі показники: венозна сатурація (SvO2), парціальний тиск у венозній крові (PvO2), доставка кисню (DO2), споживання кисню (VO2). Для оцінки частоти розвитку гострої лівошлуночкової недостатності розраховувалося співвідношення пацієнтів, у яких розвинулися порушення гемодинаміки після АКШ з ШК, та загальної кількості пацієнтів у групі. Далі розрахований показник порівнювався в основній та контрольній групі. Для оцінки темпу стабілізації використовували час відновлення гемодинаміки (год) та загальну дозу інотропного препарату (мкг/кг).
Для оцінки відмінностей показників за окремо взятим параметром у певний часовий проміжок (до, після операції) було проведено порівняння середніх (медіан для розподілу, відмінного від нормального) двох вибірок (основна група та контрольна група) (критерій Стьюдента, W-критерій Вілкоксона для розподілу, відмінного від нормального), тобто порівнювався показник СІ до операції в основній групі з показником СІ до операції у контрольній групі. Такій процедурі був підданий кожен показник центральної гемодинаміки (табл. 1) та кисневого транспорту (табл. 2) основної та контрольної груп у кожному із часових інтервалів.
Розрахунок показав, що статистично значимих відмінностей не виявлено (р > 0,05) у жодній вибірці, крім показника ЧСС до операції в основній та контрольній групах: 75 [70; 80] і 80 [75; 80] уд/хв відповідно. Але відмінність 5 уд/хв не має клінічного значення.
Частота виникнення ГЛШН після АКШ з ШК в основній та контрольній групах співвідносилася як 0,13/0,23. Тобто гемодинамічні розлади після операції у разі призначення ФДФ виникали у 1,76 раза рідше (р < 0,05), ніж у групі, де корекція гіпофосфатемії не проводилася.
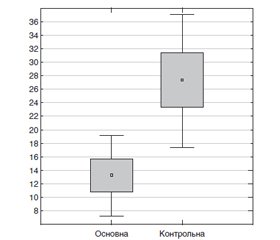
У разі виникнення ГЛШН після АКШ з ШК час відновлення в основній групі становив 13,29 ± 6,34 години, а у контрольній групі — 27,29 ± 10,55 години (рис. 3). На рисунку показано інтервальну оцінку показників часу відновлення гемодинаміки від закінчення операції до стабілізації. Наведено середнє значення (точка), середнє відхилення (прямокутник) та 95% довірчий інтервал (вуса розподілу). Таким чином, гемодинаміка відновлювалася вдвічі (р < 0,05) швидше в основній групі.
У разі виникнення ГЛШН після АКШ з ШК загальна доза спожитого ізотропного препарату в основній групі становила 20,43 ± 11,04 мкг/кг добутаміну, а у контрольній групі — 53,29 ± 23,88 мкг/кг (рис. 4). На рисунку показано інтервальну оцінку показників загальної дози інотропного препарату від закінчення операції до стабілізації. Наведені медіана (точка), похибка медіани (прямокутник) та 95% довірчий інтервал (вуса розподілу). Таким чином, для відновлення гемодинаміки в основній групі знадобилося в 2,6 раза (р < 0,05) менше добутаміну, ніж у контрольній групі.
Це клінічне дослідження ефективності застосування фруктозо-1,6-дифосфату мало на меті дослідження введення ФДФ для запобігання виникненню та зниження ступеня тяжкості гострої лівошлуночкової недостатності у пацієнтів, які перенесли оперативне втручання — аортокоронарне шунтування зі штучним кровообігом. Дослідження проводилося в популяції пацієнтів, у яких до операції була виявлена гіпофосфатемія.
Відомо, що гіпофосфатемія обтяжує перебіг основного захворювання: викликає зниження скорочувальної здатності міокарда, розвиток серцевої недостатності, аритмії, фібриляції, гіпотонії. Гіпофосфатемія порушує оксигенацію та перфузію тканин, дисоціацію оксигемоглобіну та спричиняє розвиток тканинної гіпоксії. Виникає електролітний дисбаланс з підвищенням концентрації Nа+ та Са2+ у клітинах та К+ у плазмі. Розвивається деполяризація мембран, набряк клітин, клітинний ацидоз, порушення толерантності до глюкози, інсулінорезистентність [7].
Корекція гіпофосфатемії препаратом фруктозо-1,6-дифосфат призводить до зниження кількості післяопераційних гемодинамічних розладів. А у разі виникнення таких розладів застосування ФДФ у період ШК призводить до скорочення термінів відновлення гемодинаміки та зниження загальної дози інотропного препарату. Ці переваги, з високою ймовірністю, отримані завдяки властивостям самого препарату. Основний механізм дії ФДФ — відновлення рівня фосфатів у крові та стимуляція активності ферментів гліколізу (фосфофруктокінази, піруваткінази та лактаткінази) з підвищенням внутрішньоклітинного високоенергетичного фосфатного пулу. При цьому відбувається підвищення рівня АТФ у здорових та ішемізованих тканинах міокарда, а АТФ є універсальним джерелом енергії для всіх біохімічних процесів. Біологічна роль ФДФ полягає в тому, що він впливає на спорідненість гемоглобіну до кисню, зменшуючи її для полегшення віддачі кисню із оксигемоглобіну тканинам. Таким чином, у проблемі пошуку ефективної медикаментозної терапії для захисту клітин від ішемічних змін міокарда привертає увагу застосування в лікувальних цілях ФДФ, що безпосередньо підвищує рівень АТФ [8].
Висновки
Застосування препарату фруктозо-1,6-дифосфату в комплексному лікуванні кардіохірургічних хворих, які перенесли аортокоронарне шунтування із штучним кровообігом, вірогідно коригує гіпофосфатемію (підвищує рівень фосфатів).
Призначення фруктозо-1,6-дифосфату дозволяє знизити частоту розвитку ГЛШН після АКШ з ШК у групі пацієнтів, у яких до операції було виявлено гіпофосфатемію.
У разі розвитку ГЛШН після операції АКШ з ШК у пацієнтів з доопераційною гіпофосфатемією призначення фруктозо-1,6-дифосфату призводить до скорочення термінів відновлення гемодинаміки та зниження загальної дози інотропного препарату (добутаміну), необхідного для досягнення стабілізації.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 07.12.2021
Рецензовано/Revised 15.12.2021
Прийнято до друку/Accepted 17.12.2021
/42.jpg)

/43.jpg)
/43_2.jpg)