Журнал «Медицина неотложных состояний» Том 18, №2, 2022
Вернуться к номеру
Анестезіологічне забезпечення декомпресії серединного нерва у хворих з карпальним тунельним синдромом
Авторы: Рушай А.К., Скіба В.В., Лісайчук Ю.С., Воєнний І.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
Актуальність. Карпальний тунельний синдром (КТС) є найпоширенішою компресійною нейропатією. У пацієнтів з неефективним консервативним лікуванням при тяжких формах показаний реліз зап’ястного каналу (carpal tunnel release (CTR)), що дозволяє досягти покращення більш ніж у 90 % випадків. Крім адекватної малотравматичної тактики втручання, велике значення у відновленні функції серединного нерва (корекція нейропатичних порушень) має і проведення оптимального періопераційного знеболювання. Метою роботи було поліпшення результатів лікування хворих з карпальним тунельним синдромом шляхом адекватного періопераційного анестезіологічного забезпечення декомпресії серединного нерва. Завданнями роботи було запропонувати мультимодальне періопераційне забезпечення декомпресії серединного нерва; вивчити динаміку больового синдрому; оцінити ефективність запропонованого підходу. Матеріали та методи. Під нашим спостереженням перебували 52 потерпілі з КТС. Втручання проводилося під мультимодальним знеболюванням — провідниковою анестезією. На початку операції в порожнину карпального каналу вводили розчин лідокаїну. За 20–30 хвилин до втручання вводився внутрішньом’язово декскетопрофен, внутрішньовенно — парацетамол. Внутрішньом’язове введення декскетопрофену повторювали через 12 годин. Для оцінки відновлення функції кисті та динаміки нейропатичних порушень у групах з малоінвазивним і відкритим стандартним втручанням був використаний Бостонський опитувальник BCTQ. Динаміку інтенсивності больового синдрому вимірювали за значеннями візуальної аналогової шкали (ВАШ) за 10-бальною оцінкою. Результати. Динаміка показників ВАШ свідчила про незначний біль навіть у групі з відкритим, відносно травматичним втручанням. Вірогідної різниці між показниками груп виявлено не було; больовий синдром під час проведення втручання та в перші 12 годин після нього оцінювався оперованими як слабкий біль. Додаткове знеболювання, тим більше з використанням опіоїдних анестетиків, було не потрібне. До 4 тижнів показники шкал Бостонського опитувальника BCTQ мали статистично невірогідні відмінності, а до 3 та 6 місяців практично не відрізнялися у групах. На всіх етапах спостереження значних статистичних відмінностей між групами не виявлено. Висновки. Проведене мультимодальне періопераційне знеболювання у запропонованому обсязі дозволило досягти гарного знеболювального ефекту, зблизити результати нейропатичної та функціональної реабілітації у хворих різних груп.
Background. Carpal tunnel syndrome (CTS) is the most common compression neuropathy. In patients with ineffective conservative treatment for severe forms, carpal tunnel release (CTR) is shown, which allows an improvement in more than 90 % of cases. In addition to adequate low-traumatic intervention tactics, optimal perioperative analgesia is also of great importance in restoring the function of the median nerve (correction of neuropathic disorders). The work was aimed to improve the results of treatment of patients with carpal tunnel syndrome by the adequate perioperative anesthetic provision of median nerve decompression. The objectives of the work were to propose a multimodal perioperative provision of median nerve decompression; to study the dynamics of pain syndrome; to evaluate the effectiveness of the proposed approach. Materials and methods. We examined 52 patients with CTS. The intervention was carried out under multimodal anesthesia — local anesthesia. At the beginning of the operation, a lidocaine solution was injected into the cavity of the carpal canal. Dexketoprofen was administered intramuscularly 20–30 minutes before the intervention; intravenous paracetamol. Intramuscular administration of dexketoprofen was repeated after 12 hours. The Boston BCTQ questionnaire was used to assess the recovery of hand function and the dynamics of neuropathic disorders in the groups with minimally invasive and open standard intervention. The dynamics of the pain syndrome intensity were measured by the values of the visual analogue scale (VAS) according to a 10-point assessment. Results. The dynamics of VAS indices indicated insignificant pain even in the group with an open, relatively traumatic, intervention. There was no significant difference between the indicators of the groups; pain syndrome during the intervention and the first 12 hours after it was assessed by the operated patients as mild pain. Additional anesthesia, especially opioid anesthetics, was not required. Within four weeks, the scores on the Boston BCTQ questionnaire had statistically insignificant differences, and in 3 and 6 months, they practically did not differ in the groups. At all stages of observation, no significant statistical differences were found between the groups. Conclusions. Conducted multimodal perioperative anesthesia in the proposed scope allowed achieving a good analgesic effect, approximating the results of neuropathic and functional rehabilitation in patients of different groups.
карпальний тунельний синдром; мультимодальне періопераційне знеболювання
carpal tunnel syndrome; multimodal perioperative pain relief
Вступ
Матеріали та методи
Результати та обговорення
/48.jpg)
Висновки
- Лемешов О., Чирка И. Диагностика и лечение туннельных невропатий. PMJUA. 2020. 5 (1). 44-51. DOI: https://doi.org/ 10.31636/pmjua.v5i1.5
- Feng B., Chen K., Zhu X., Ip W.Y., Andersen L.L., Page P., Wang Y. Prevalence and risk factors of self-reported wrist and hand symptoms and clinically confirmed carpal tunnel syndrome among office workers in China: a cross-sectional study. BMC Public Health. 2021. Jan 6. Vol. 21. № 1. Р. 57-63. doi: 10.1186/s12889-020-10137-1.
- Белова Н.А. Вегетативные нарушения при идиопатическом карпальном туннельном синдроме. Дис... к.м.н. М., 2018. 112 с.
- Юсупова Д.Г., Зимин А.А., Гришина Д.А. Карпальный туннельный синдром: оценка необходимости реабилитационно-восстановительного лечения после эндоскопической декомпрессии срединного нерва в позднем и отдаленном послеоперационном периодах. Нервно-мышечные болезни. 2019. № 9(4). С. 34-43. DOI: 10.17650/2222-8721-2019-9-4-34-43.
- Gilveg A., Parfenov V., Evzikov G. Median nerve decompression in carpal tunnel syndrome: Short- and long-term results. Neurology, Neuropsychiatry, Psychosomatics. 2018. Vol. 10. Р. 79-85. DOI: 10.14412/2074-2711-2018-3-79-85.
- Turgut M.C., Saglam G., Toy S. Efficacy of extracorporeal shock wave therapy for pillar pain after open carpal tunnel release: a double-blind, randomized, sham-controlled study. Korean J. Pain. 2021. 34. 315-321. https://doi.org/10.3344/kjp.2021.34.3.315
- Multanen J., Uimonen M.M., Repo J.P. et al. Use of conservative therapy before and after surgery for carpal tunnel syndrome. BMC Musculoskelet Disord. 2021. 22. 484. https://doi.org/10.1186/s12891-021-04378-3
- Samant P.D., Sane R.M. Evaluation of Functional and Symptomatic Outcomes After Vitamin D3 Administration in Carpal Tunnel Syndrome With Hypovitaminosis D. Hand (NY). 2021 Jan 20. doi: 10.1177/1558944720988130.
- Talay Çalış H., Aslaner H., Doğan Sunkak S., Sedefoğlu N., Tomruk Sütbeyaz S., Güler E. Comparison of Therapeutic Effectiveness between Kinesio Taping Technique and Static Resting Splint in Carpal Tunnel Syndrome. Eur. J. Ther. 2021. 27(1). 14-9. DOI: 10.5152/eurjther.2021.20032.
- Phan A., Hammert W. Evaluation of PROMIS Outcomes for Surgical Treatment of Cubital Tunnel Syndrome With and Without Carpal Tunnel Syndrome. Hand (NY). 2021 Jul 3. doi: 10.1177/15589447211028921.
- Braga D.M.O.S., Rocha A. de S., Amaral I.J. de L., Diniz D.S., Guimarães V. de C. Epidemiology and approach in Carpal Tunnel Syndrom: An analysis of the impact on return on labor. Interação. 2021. 21(3). 24-42. https://interacao.org/index.php/edicoes/article/view/81

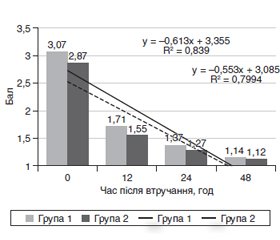
/48_2.jpg)