Вступ
Ішемічна хвороба серця належить до найпоширеніших патологій з боку серцево-судинної системи та характеризується високим рівнем летальності [1]. На сьогодні основним методом терапії даного захворювання вважається хірургічне лікування, причому в пацієнтів, які перенесли аортокоронарне шунтування (АКШ), в 1,5 раза нижча п’ятирічна летальність порівняно з пацієнтами, яким проводилась лише медикаментозна терапія [2].
Водночас, за даними G. Landoni та співавт. (2012), незважаючи на поліпшення за останні 15 років хірургічного й анестезіологічного забезпечення, що сприяло різкому зниженню частоти ускладнень і летальності під час операцій даного типу, вони все ще залишаються вищими, ніж при інших видах оперативних втручань [3]. Так, у дослідженні B. Bridgewater та співавт. (2009) встановлено, що частота летальності під час АКШ з використанням штучного кровообігу (ШК) перебуває на рівні 2–3 %, а рівень післяоперативних ускладнень досягає 20–30 % [4]. Причому механізми розвитку післяоперативних ускладнень у пацієнтів, яким проводилось АКШ на фоні штучного кровообігу, мультифакторні та на сьогодні до кінця не встановлені.
Незважаючи на значну кількість публікацій щодо впливу компонентів схем анестезіологічного забезпечення на розвиток післяопераційних ускладнень, залишаються не до кінця зрозумілими питання вибору оптимальної схеми анестезіологічного забезпечення під час аортокоронарного шунтування в пацієнтів з ішемічною хворобою серця. Так, схеми анестезіологічного забезпечення з високими дозами опіоїдних анальгетиків під час кардіохірургічних втручань протягом багатьох десятиліть були основою кардіоанестезії завдяки їх здатності зберігати гемодинамічну стабільність і послаблювати гормональну та метаболічну реакцію на хірургічний стрес [5]. Зокрема, після низки публікацій E. Lowenstein щодо безпечності знеболювання високими дозами морфіну (3 мг/кг) у 70-х роках XX століття вживання високих доз опіоїдів стало характерною особливістю кардіоанестезії [6].
Однак великі дози опіоїдів вимагали подовженої вентиляції в пацієнтів протягом 12–24 год у ранньому післяопераційному періоді. Водночас тривала штучна вентиляція легень і подовження перебування у відділенні інтенсивної терапії значно підвищували вартість лікування, що вимагало пошуку якісно нових рішень [7]. Економічна ефективність та ефективне використання медичних ресурсів після кардіохірургічних втручань стали одним із факторів, що стимулювали використання анестезіологічних схем з низькими дозами опіоїдів [8, 9].
Метою нашої роботи було порівняння впливу малоопіоїдної та високоопіоїдної схем анестезіологічного забезпечення на ранні клінічні результати в пацієнтів при аортокоронарному шунтуванні із штучним кровообігом.
Матеріали та методи
У дослідження включено 120 пацієнтів з ішемічною хворобою серця, яким на базі ДУ «Інститут серця МОЗ України» виконувалось аортокоронарне шунтування з накладанням 2–3 аортокоронарних анастомозів в умовах штучного кровообігу. Вік пацієнтів становив 59,0 (55,0; 62,0) року (від 48 до 65 років). Середня маса тіла — 90,5 ± 13,8 кг (від 73 до 125 кг). Кількість чоловіків дорівнювала 86 (71,6 %), жінок — 34 (28,9 %). Медіана операційного ризику за EuroSCORE II становила 3,85 % (2,15; 4,25 %).
Відповідно до схеми анестезіологічного забезпечення, з використанням комп’ютерного програмного забезпечення для рандомізації всі пацієнти були поділені на дві групи.
Перша група (60 пацієнтів) — індукція складалася зі введення (в/в) пропофолу в дозі 1,5 мг/кг по 40 мг з інтервалом 10–15 с. Після введення гіпнотиків усі хворі в/в отримували фентаніл в дозі 1–1,5 мкг/кг. Після досягнення адекватного рівня анестезії м’язова релаксація досягалась в/в введенням піпекуронію броміду в дозі 0,1 мг/кг, після чого проводилась інтубація трахеї. Для підтримки анестезії використовували інгаляцію севофлурану по напівзакритому контуру з цільовим підтриманням його концентрації згідно з віковим показником мінімальної альвеолярної концентрації (МАК). Цільову концентрацію севофлурану розраховували за формулою: МАКawake = 0,34 × МАКtabl. × 2. Перед початком оперативного втручання в/в додавали субнаркотичну дозу кетаміну (0,5 мг/кг) і лідокаїн 1 мг/кг болюсно з одночасним налагодженням безперервної інфузії останнього в дозі 1,5–2 мг/кг/год і дексмедетомідину 0,7 мкг/кг/год. Інфузію лідокаїну продовжували під час усієї операції до надходження пацієнта в палату інтенсивної терапії. Підтримка аналгезії під час оперативного втручання проводилась шляхом уведення фентанілу. Середня доза фентанілу, що була використана на весь час анестезіологічного забезпечення, становила 1,0 мкг/кг/год.
Друга група (60 пацієнтів) отримувала стандартну схему анестезіологічного забезпечення (індукція в анестезію аналогічна такій у пацієнтів першої групи; підтримання анестезії — севофлуран 1,5–2 МАК, стандартні дози фентанілу 20–25 мкг/кг на весь час операції, піпекуронію броміду в дозі 0,1 мг/кг).
Детальна характеристика вихідного стану порівнюваних груп надана у табл. 1.
Як видно з табл. 1, вірогідних змін щодо вихідного стану пацієнтів в обох групах дослідження не спостерігалось.
Штучна вентиляція легень (ШВЛ) в обстежених пацієнтів проводилась повітряно-кисневою сумішшю з FiO2 60 % в режимі нормовентиляції під контролем газового складу крові (середнє значення рСО2 артеріальної крові становило 35–40 мм рт.ст.).
Штучний кровообіг проводився на апараті «System 1» (Terumo, США) з використанням одноразових мембранних оксигенаторів «Affinity» (Medtronic, США) в умовах помірної гіпотермії (+32 °С). Підключення апарата ШК і перфузія до штучної фібриляції серця проводилась в ламінарному режимі з подальшим переходом у пульсуючий режим ШК (серцевий індекс підтримувався на рівні 2,4–2,5 л/хв/м2). Під час ШК використовувалась нормоволемічна гемодилюція при середньому рівні гематокриту 25–30 % і гемоглобіну 80–90 г/л. Згортання крові оцінювали за часом активованого згортання, підтримуючи його в межах 500–600 с.
Кінцеві клінічні точки, проаналізовані в цьому дослідженні, включали синдром низького серцевого викиду (СНСВ) та післяопераційну фібриляцію передсердь (ПОФП). СНСВ включає зниження серцевого індексу (СІ) до < 2,0 л/хв/м2 та систолічного артеріального тиску < 90 мм рт.ст. у поєднанні з ознаками тканинної гіпоперфузії (холодна периферія, липка, вогка шкіра, сплутаність свідомості, олігурія, підвищений рівень лактату) за відсутності гіповолемії.
Дані наведені у вигляді середнього арифметичного (М) за результатами кожного дослідження ± стандартне відхилення (SD). При ненормальному розподілі результатів вони подавалися як медіана (Ме) та 1-й (Q1) і 3-й (Q3) квартилі — Ме (Q1; Q3). Вірогідними вважались відмінності при р < 0,05 (95,5 %). Регресійний aнaліз oтримaних рeзультaтів проводили зa дoпoмoгoю кoмп’ютeрнoї прoгрaми Statistica 10.
Дослідження виконане з дотриманням основних положень «Правил етичних принципів проведення наукових медичних досліджень за участю людини», затверджених Гельсінською декларацією (1964–2013 рр.). Кожен пацієнт підписував інформовану згоду на участь у дослідженні. Дослідження схвалене Комісією з питань етики Національного університету охорони здоров’я України ім. П.Л. Шупика від 05.11.2018, протокол № 10.
Результати
При аналізі тривалості ШВЛ у ранньому післяопераційному періоді нами встановлена вірогідно коротша тривалість механічної вентиляції в пацієнтів першої групи порівняно з другою групою (2,0 (2,0; 3,0) проти 4,0 (3,0; 5,0) год, р < 0,001) (рис. 1).
Крім того, слід зазначити, що в ранньому післяопераційному періоді в пацієнтів першої групи в 1,75 раза (р = 0,088) рідше виникала потреба в реінтубації порівняно з другою групою, однак без вірогідної різниці (6,7 проти 11,7 %; р = 0,088).
Щодо кардіальних ускладнень, то в пацієнтів першої групи більш ніж удвічі (р = 0,031) вірогідно рідше спостерігався розвиток післяопераційної фібриляції передсердь порівняно з другою групою (табл. 2).
Також у 2,0 раза вірогідно рідше в пацієнтів першої групи виникала шлуночкова тахікардія або фібриляція, хоча результати невірогідні (3,3 проти 6,6 %, р = 0,402). При аналізі частоти порушень провідності між групами дослідження встановлено, що в першій групі в 1,5 раза частіше спостерігався розвиток атріовентрикулярних блокад (10,0 проти 6,7 %, р = 0,509), однак усі епізоди були пов’язані з АВ-блокадами I та II cтупеня, що не загрожували життю та не вимагали застосування кардіостимулятора.
Одним із частих кардіальних ускладнень, що виявлялося в обох групах дослідження, виступав синдром низького серцевого викиду (табл. 3). Зокрема, в нашому дослідженні в пацієнтів першої групи в 2,3 раза вірогідно рідше спостерігався синдром низького серцевого викиду порівняно з другою групою (11,7 проти 26,7 %, р = 0,037).
Відповідно до рідшого виникнення СНСВ у пацієнтів першої групи, у цій групі рідше застосовувалися інотропні агенти довше ніж 24 години порівняно з другою групою (16,7 проти 31,7 %, р = 0,055).
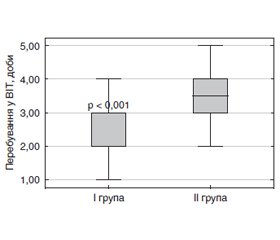
Загалом тривалість перебування у відділенні інтенсивної терапії (ВІТ) пацієнтів першої групи була вірогідно нижчою порівняно з другою групою (2,0 (2,0; 3,0) проти 3,5 (3,0; 4,0) доби, р < 0,001) (рис. 2).
Однак загальна тривалість госпіталізації вірогідно не відрізнялась між групами дослідження (11,0 (9,25; 12,75) проти 12,0 (11,0; 13,0) доби, р = 0,056) (рис. 3).
Результати регресійної моделі [F (8, N = 120) = = 6,748, p < 0,001, R2 = 0,327] показали, що лише ФВ до операції (р = 0,036), тривалість ШК (р = 0,028), тривалість перетискання аорти (р = 0,044) та рівень інтерлейкіну-6 (ІЛ-6) після ШК (р = 0,001) виступали істотними предикторами СНСВ (табл. 4). Водночас при вилученні неістотних факторів із регресійної моделі вірогідними показниками для передбачення СНСВ виявлялись тривалість ШК (р = 0,032) та рівень ІЛ-6 після ШК (р = 0,004) (табл. 4). Остаточна статистична модель [F (4, N = 120) = 12,52, p < 0,001, R2 = 0,304] охоплює майже третину всіх факторів розвитку СНСВ. Таким чином, пацієнти з тривалішим ШК та вищим рівнем ІЛ-6 характеризувались вищою частотою розвитку СНСВ.
/84_2.jpg)
З метою оцінки ефективності прогнозування розвитку СНСВ від рівня ІЛ-6 у кінці операції нами побудований графік залежності чутливості від частоти хибнопозитивних висновків, так звана ROC-крива. Нами встановлено, що при значенні сutoff для ІЛ-6 42,5 пг/мл чутливість і специфічність тесту становили 73,1 та 75,5 % відповідно, площа під кривою — С-0,84 (95% ДІ 0,77–0,92) (рис. 4).
При побудові регресійної моделі [F (8, N = 120) = = 6,11, p < 0,001, R2 = 0,335] шодо предикторів ПОФП нами було встановлено, що лише ступінь АГ, тривалість ШК, рівень ІЛ-6 після ШК та потреба в еритроцитарній масі виступали істотними предикторами ПОФП (табл. 5). Надалі при вилученні неістотних факторів із регресійної моделі вірогідними показниками для передбачення СНСВ виявлявся лише рівень ІЛ-6 після ШК, остаточна статистична модель [F (4, N = 120) = 11,54, p < 0,001, R2 = 0,286] (табл. 5). Таким чином, пацієнти з більш високим рівнем ІЛ-6 характеризувались вищою частотою розвитку ПОФП.
При оцінці ефективності прогнозування розвитку ПОФП від рівня ІЛ-6 у кінці операції встановлено, що при значенні сutoff для ІЛ-6 40,0 пг/мл чутливість і специфічність становили 70,0 та 73,8 % відповідно, площа під кривою — С-0,80 (95% ДІ 0,71–0,88) (рис. 5).
Обговорення
На сьогодні мультимодальна малоопіоїдна анестезія для контролю над болем стала важливим компонентом періопераційного ведення пацієнтів і передбачає використання адитивних або синергічних комбінацій анальгетиків для досягнення клінічно необхідного знеболювання при мінімізації значних побічних ефектів, пов’язаних з більшою дозою опіоїдів [10]. Отримані результати свідчать, що наше дослідження продемонструвало відносну безпечність використання малоопіоїдної схеми анестезіологічного забезпечення при аортокоронарному шунтуванні в пацієнтів з ішемічною хворобою серця.
Про безпечність малоопіоїдної анестезії також повідомляється і в низці інших публікацій. Зокрема, W.T. Wong та його колеги у найновішому кохранівському метааналізі зібрали дані 28 досліджень (4438 пацієнтів) і не відзначили суттєвих відмінностей щодо ускладнень між схемами анестезіологічного забезпечення з високими та низькими дозами опіоїдів, а саме: інфаркту (ВР 0,98, 95% ДІ 0,48–1,99; 8 досліджень, 1683 учасники, низький рівень доказовості), інсульту (ВР 1,17, 95% ДІ 0,36–3,78; 5 досліджень, 562 учасники, низький рівень доказовості) та реінтубації трахеї (ВР 1,77, 95% ДІ 0,38–8,27; 5 досліджень, 594 учасники, низький рівень доказовості) [11]. Однак даний аналіз не був зосереджений на схемах анестезіологічного забезпечення з високими та низькими дозами опіоїдів.
Крім того, M. Greco та співавт., порівнюючи результати пацієнтів, яким вводили реміфентаніл короткої дії та традиційні опіоїди (фентаніл і суфентаніл), виявили, що введення реміфентанілу знижувало рівень тропоніну, тривалість ШВЛ і тривалість госпіталізації загалом [12]. Проте, як і дослідження W.T. Wong та співавт., ця робота спеціально не аналізувала дози опіоїдів, які застосовувалися.
Також L.Q. Rong та співавт. (2019) у великому метааналізі, який включав 1400 пацієнтів, показали, що малоопіоїдна анестезія є безпечною й ефективною для використання у дорослих пацієнтів при кардіохірургічних втручаннях, причому її ефективність не залежить від клінічних характеристик пацієнтів, типу використовуваного опіоїду та дози опіоїдів у групах з малоопіоїдною анестезією [13]. Так, при метарегресійному аналізі автори не спостерігали вплив віку, статі або типу опіоїдів на різницю між групами, хоча тривалість перебування у відділенні інтенсивної терапії виявлялась коротшою, коли порівнювались опіоїди з короткою та довготривалою дією. Крім того, у дослідженні не виявлялось різниці щодо вторинних клінічних результатів: періопераційної гіпотензії, потреби у вазопресорах, періопераційного інфаркту міокарда та періопераційного інсульту. Автори не виявили різниці у тривалості вентиляції між цими двома групами, однак після виключення досліджень, результати яких різко відрізнялися, спостерігалась тенденція до скорочення тривалості вентиляції у групі з меншими дозами опіоїдів.
Щодо нашого дослідження, проведення малоопіоїдної анестезії характеризувалося вірогідно більш низькою частотою розвитку СНСВ та ПОФП. Також, за нашими даними, ФВ до операції (р = 0,036), тривалість ШК (р = 0,028), тривалість перетискання аорти (р = 0,044) та рівень ІЛ-6 після ШК (р = 0,001) виступали істотними предикторами СНСВ. Cхожі результати також були продемонстровані у дослідженні W. Ding та співавт., які віднесли до основних факторів ризику фракцію викиду лівого шлуночка (ФВ ЛШ) нижче за 35 %, вік старше 65 років, проведення АКШ в умовах штучного кровообігу, невідкладне хірургічне втручання, власне сам штучний кровообіг та неефективну реваскуляризацію [14]. У свою чергу, згідно з нашими даними, ступінь АГ, тривалість ШК, рівень ІЛ-6 після ШК та потреба в еритроцитарній масі виступали істотними предикторами ПОФП.
З огляду на важливе значення рівня ІЛ-6 у розвитку ранніх кардіальних ускладнень, можливим механізмом зниження їх частоти при малоопіоїдній анестезії є зниження запальної відповіді, що могло досягатися шляхом як власне безпосереднього зменшення дози опіоїдів, так і додавання таких середників, як лідокаїн, кетамін або дексмедетомідин. Дана гіпотеза підтверджується нашим попереднім дослідженням, в якому малоопіоїдна анестезія характеризувалась вірогідно нижчим рівнем ІЛ-6 після ШК порівняно зі стандартними дозами опіоїдів [15].
Загалом отримані результати підтверджують безпеку клінічного використання схем анестезіологічного забезпечення з низькими дозами опіоїдів у кардіохірургічних хворих та підкреслюють можливість більш консервативного використання опіоїдів у кардіохірургії.
Висновки
1. У пацієнтів першої групи виявлялась вірогідно коротша тривалість механічної вентиляції порівняно з другою групою (2,0 (2,0; 3,0) проти 4,0 (3,0; 5,0) год, р < 0,001).
2. У пацієнтів першої групи більше ніж удвічі (р = 0,031) вірогідно рідше спостерігався розвиток післяопераційної фібриляції передсердь; у 2,3 раза вірогідно рідше спостерігався синдром низького серцевого викиду (11,7 проти 26,7 %, р = 0,037) порівняно з другою групою; тривалість перебуванні у ВІТ пацієнтів першої групи визначалась вірогідно нижчою порівняно з другою групою (2,0 (2,0; 3,0) проти 3,5 (3,0; 4,0) доби, р < 0,001);
3. Вірогідними предикторами СНСВ виявлялись тривалість ШК (р = 0,032) та рівень ІЛ-6 після ШК (р = 0,004), остаточна статистична модель [F (4, N = 120) = 12,52, p <.001, R2 = 0,304], тоді як вірогідними предикторами СНСВ виявлявся лише рівень ІЛ-6 після ШК, остаточна статистична модель [F (4, N = 120) = 11,54, p < 0,001, R2 = 0.286].
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 03.12.2021
Рецензовано/Revised 14.12.2021
Прийнято до друку/Accepted 16.12.2021
/83.jpg)

/82.jpg)
/83_2.jpg)
/84.jpg)
/84_2.jpg)
/85_2.jpg)
/85.jpg)