Международный эндокринологический журнал Том 18, №3, 2022
Вернуться к номеру
Комплексний підхід в лікуванні ожиріння: ефективність застосування агоніста глюкагоноподібного пептиду 1 та дозованого фізичного навантаження
Авторы: Дінець А.В. (1, 2), Горобейко М.Б. (1, 3), Здорна В.В. (1, 4), Хоперія В.Г. (1), Льовін А.В. (1)
(1) — Інститут біології та медицини, Київський національний університет імені Тараса Шевченка, м. Київ, Україна
(2) — Національний науковий центр «Інститут бджільництва імені П.І. Прокоповича», м. Київ, Україна
(3) — Verum Expert Clinic, м. Київ, Україна
(4) — Медичний центр «Андроцентр», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
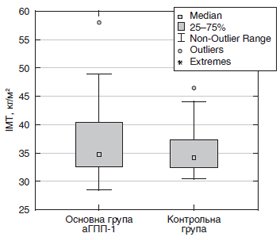
Актуальність. В Україні ожиріння визначають у 24,8 % населення (тобто близько 10 млн осіб), надлишок маси тіла — у 34,3 %. Серед причин, що сприяють ожирінню, є спадковість, переїдання, у тому числі споживання простих вуглеводів, а також малорухомий спосіб життя. Для лікування ожиріння застосовується комплексний підхід, що полягає в дотриманні адекватної харчової поведінки, дозованому фізичному навантаженні та застосуванні фармакологічної корекції, зокрема агоніста глюкагоноподібного пептиду 1 (аГПП-1). На сьогодні недостатньо вивченими серед українських пацієнтів є роль та ефективність застосування аГПП-1 у комбінації з адекватним за обсягом фізичним навантаженням у лікуванні ожиріння. Метою цього дослідження було визначити та оцінити роль аГПП-1 у комбінації з дозованим фізичним навантаженням для зниження маси тіла у пацієнтів з ожирінням, порівняти ефективність такої комбінації з лікуванням ожиріння із застосуванням метформіну та інгібіторів натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2). Матеріали та методи. У проспективне дослідження були залучені 155 пацієнтів з ожирінням, серед яких дані зі спостереження були доступні у 49 пацієнтів. Основну групу становили 30 пацієнтів, які отримували в комплексній терапії аГПП-1 ліраглутид (основна група аГПП-1) у дозах від 1,2 до 3 мг на добу. Контрольна група становила 19 пацієнтів, які отримували комплексну терапію із застосуванням метформіну в щоденних дозах від 500 до 2000 мг, іНЗКТГ-2 в щоденних дозах від 10 до 12,5 мг. У пацієнтів в цьому дослідженні визначали індекс маси тіла (ІМТ), окружність талії (ОТ), окружність стегон та співвідношення ОТ/OC. Кількість щоденних кроків визначали за допомогою педометрів, вбудованих у смартфони або смарт-годинники. Оцінка отриманих даних проводилась із застосуванням непараметричних методів статистики. Результати. В основній групі маса тіла до лікування була в середньому 104,6 кг, після лікування — 96,36 кг (р = 0,000007), у середньому пацієнти втратили 7,8 % (діапазон 1–23,71 %) від початкової маси тіла. ІМТ до лікування в середньому 37,1 кг/м2, після лікування — 34,11 кг/м2 (р = 0,000006). У контрольній групі маса тіла до лікування становила в середньому 99,4 кг, після лікування — 91,74 кг (р = 0,000196), у середньому пацієнти втратили 7,73 % (діапазон 0–16,9 %) від початкової маси тіла. ІМТ до лікування в середньому 35,6 кг/м2, після лікування — 34,11 кг/м2 (р = 0,000196). У всій когорті до початку лікування щоденна кількість кроків > 5000 на день визначалась у 25 (51 %) пацієнтів, після лікування — у 48 (98 %); щоденна кількість кроків > 10 000 на день до лікування визначалась у 6 (11 %) пацієнтів, після лікування була в 5 разів більше — у 31 (63 %) пацієнта. Ці результати свідчать про вірогідну інтенсифікацію фізичного навантаження і високу мотивацію щодо втрати маси тіла в обох групах дослідження. Висновки. Встановлена висока ефективність застосування для зниження маси тіла аГПП-1, метформіну та іНЗКТГ-2 у комбінації з щоденним високим фізичним навантаженням, а саме ходьбою > 5000 кроків на день, що є елементом модифікації способу життя.
Background. The obesity is found in 24.8 % (approximately 10 million people) and overweight in 34.3 % of the population of Ukraine, mainly in females. Obesity is associated with hereditary factors, overeating as well as a sedentary lifestyle. An integrated approach is applied to treat obesity such as combination of adequate eating behavior, high physical activity and administration of pharmacological correction, including glucagon-like peptide 1 agonist (GLP-1). Currently, the little is known about utility and effectiveness of GLP-1 in combination with adequate physical activity for obesity management among Ukrainian patients. The purpose of this study was to determine and evaluate the role of GLP-1 in combination with high physical activity for weight loss in obese patients and to compare with obese patients receiving treatment with metformin and sodium-glucose cotransporter 2 inhibitors (SGLT2i). Materials and methods. A prospective study included 155 obese patients, and follow-up data were available of 49 patients. The study group GLP-1 consisted of 30 patients receiving combination therapy GLP-1 liraglutide in daily doses of 1.2 to 3 mg per day. The control group consisted of 19 patients receiving complex therapy with metformin in daily doses from 500 to 2000 mg, and SGLT2i in daily doses from 10 to 12.5 mg. Body mass index (BMI), waist circumference (WC), hip circumference (HC), and WC/HC ratio were evaluated. Number of daily steps was determined using pedometers built into smartphones or smartwatches. Evaluation of the obtained data was performed using non-parametric statistical methods. Results. In study group GLP-1 the mean weight before the treatment was 104.6 kg, after treatment 96.36 kg (p = 0.000007), the mean weight lost was 7.8 % (range 1–23.71 %) of initial body weight. Mean BMI before treatment was 37.1 kg/m2, after treatment 34.11 kg/m2 (p = 0.000006). In the control group, the mean weight before the treatment was 99.4 kg, after treatment 91.74 kg (p = 0.000196), the mean weight lost was 7.73 % (range 0–16.9 %) of initial body weight. Mean BMI before treatment was 35.6 kg/m2, after treatment 34.11 kg/m2 (p = 0.000196). Analyses of the entrie chorot showed that before treatment, the daily number of steps > 5000/day was determined in 25 (51 %) patients, after treatment in 48 (98 %); the daily number of steps > 10,000/day before treatment was determined in 6 (11 %) patients, after treatment it was 5 times more frequent in 31 (63 %) patients. These results indicate a significant intensification of physical activity, and high motivation for weight loss in both study groups. Conclusions. Our findings suggest that weight loss in obese people is effective in case of administration of GLP-1, metformin, SGLT2i in combination with high physical activities of daily steps > 5000, which is part of life style intervention.
ожиріння; агоністи глюкагоноподібного пептиду 1; метформін; інгібітори натрійзалежного котранспортера глюкози 2-го типу; модифікація способу життя
obesity; glucagon-like peptide 1 agonist; metformin; sodium-glucose cotransporter 2 inhibitors; life style intervention
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Chooi Y.C., Ding C., Magkos F. The epidemiology of obesity. Metabolism. 2019. 92. 6-10. Epub 20180922. doi: 10.1016/j.metabol.2018.09.005. PubMed PMID: 30253139.
- Organization W.H. STEPS prevalence of noncommunicable disease risk factors in Ukraine 2019. World Health Organization. Regional Office for Europe, 2020.
- Yumuk V., Tsigos C., Fried M., Schindler K., Busetto L., Micic D., et al. European Guidelines for Obesity Management in Adults. Obes. Facts. 2015. 8(6). 402-24. Epub 20151205. doi: 10.1159/000442721. PubMed PMID: 26641646; PubMed Central PMCID: PMC5644856.
- ADA. Introduction: Standards of Medical Care in Diabetes-2022. Diabetes Care. 2022. 45(Suppl 1). S1-S2. doi: 10.2337/dc22-Sint.
- Orlyk O.S. Dietary changes in patients with diabetes mellitus in combination with gout. International Journal of Endocrinology (Ukraine). 2016. 3(75). 133-135. (in Ukrainian)
- Tudor-Locke C., Craig C.L., Thyfault J.P., Spence J.C. A step-defined sedentary lifestyle index: <5000 steps/day. Appl. Physiol. Nutr. Metab. 2013. 38(2). 100-14.
- Sisson S.B., Camhi S.M., Tudor-Locke C., Johnson W.D., Katzmarzyk Р.T. Characteristics of step-defined physical activity categories in U.S. adults. Am. J. Health Promot. 2012. 26(3). 152-9. doi: 10.4278/ajhp.100326-QUAN-95.
- Dwyer T., Ponsonby A.-L., Ukoumunne O.C., Pezic A., Venn A., Dunstan D., et al. Association of change in daily step count over five years with insulin sensitivity and adiposity: population based cohort study. BMJ. 2011. 342. doi: https://doi.org/10.1136/bmj.c7249.
- Kharchenko N.V., Anokhina G.A., Kharchenko V.V., Yakubovskaya I.A. Impact of personified nutrition and dosed physical activity in treatment of gall bladder chronic diseases with concomitant obesity. Problems of aging and longevity. 2016. 25(1). 173-80. (in Ukrainian)
- Paluch A.E., Bajpai S., Bassett D.R., Carnethon M.R., Ekelund U., Evenson K.R., et al. Daily steps and all-cause mortality: a meta-analysis of 15 international cohorts. Lancet Public Health. 2022. 7(3). e219-e28. doi: 10.1016/S2468-2667(21)00302-9.
- Bellastella G., Menafra D., Puliani G., Colao A., Savastano S., Obesity Programs of nutrition E, Rеsearch and Assessment (OPERA) Group. How much does obesity affect the male reproductive function? Int. J. Obes. Suppl. 2019. 9(1). 50-64. doi: 10.1038/s41367-019-0008-2.
- Lee K., Kruper L., Dieli-Conwright C.M., Mortimer J.E. The Impact of Obesity on Breast Cancer Diagnosis and Treatment. Curr. Oncol. Rep. 2019. 21(5). 41. doi: 10.1007/s11912-019-0787-1.
- Kwok K.H., Lam K.S., Xu A. Heterogeneity of white adipose tissue: molecular basis and clinical implications. Exp. Mol. Med. 2016. 48. e215. doi: 10.1038/emm.2016.5.
- Velychko V., Mankovskyi B., Tatarchuk T., Lahoda D., Todurov I., Lishchyshyna O. A modern view on the treatment of obesity in adults: A review of the literature. Reproductive Endocrinology. 2021. 61. 45-50. http://dx.doi.org/10.18370/2309-4117.2021.61.45-50 (in Ukrainian)
- Lingli X., Wenfang X. Characteristics and molecular mechanisms through which SGLT2 inhibitors improve metabolic disea–ses: A mechanism review. Life Sci. 2022. 120543. doi: 10.1016/j.lfs.2022.120543.
- Zheng H., Liu M., Li S., Shi Q., Zhang S., Zhou Y., et al. Sodium-Glucose Co-Transporter-2 Inhibitors in Non-Diabetic Adults With Overweight or Obesity: A Systematic Review and Meta-Analysis. Front. Endocrinol. (Lausanne). 2021. 12. 706914. doi: 10.3389/fendo.2021.706914.
- Pu R., Shi D., Gan T., Ren X., Ba Y., Huo Y., et al. Effects of metformin in obesity treatment in different populations: a meta-analysis. Ther. Adv. Endocrinol. Metab. 2020. 11. 2042018820926000. doi: 10.1177/2042018820926000.
- Naumova L., Milevska-Vovchuk L., Boiko Y., Naumova U., Gruba S. Cоmbined treatment of patients with grade 2 obesity. Bulletin of Medical and Biological Research. 2020. 4. 49-52. DOI 10.11603/bmbr.2706-6290.2020.4.11433 (in Ukrainian)
- Dinets A., Nykytiuk O., Gorobeiko M., Barabanchyk O., Khrol N. Milestones and pitfalls in strategic planning of healthcare in capital city in transition. Georgian Med. News. 2021. 315. 189-95. PMID: 34365449.
- WHO. Waist circumference and waist-hip ratio: report of a WHO expert consultation, Geneva, 8-11 December 2008. 2011.
- Tudor-Locke C., Craig C.L., Brown W.J., Clemes S.A., De Cocker K., Giles-Corti B., et al. How many steps/day are enough? For adults. Int. J. Behav. Nutr. Phys. Act. 2011. 8. 79. doi: 10.1186/1479-5868-8-79.
- Gorobeiko M., Dinets A., Hoperia V., Abdalla K. Improved intraoperative verification of parathyroid glands by determining their autofluorescence in the infrared spectrum. International Journal of Endocrinology. 2021. 17(6). http://dx.doi.org/10.22141/2224-0721.17.6.2021.243207.
- Gorobeiko M., Dinets A. Intraoperative detection of parathyroid glands by autofluorescence identification using image-based system: report of 15 cases. J. Med. Case Rep. 2021. 15(1). 414. doi: 10.1186/s13256-021-03009-8.
- Marchenko O., Gorobeiko M., Yuzvenko T.Y., Krushinska Z. Evaluation of the life quality in patients with diabetic foot syndrome before treatment and in the late period. Surgery of Ukraine. 2019. 2. 56-60. DOI: https://doi.org/10.30978/SU2019-2-56 (in Ukrainian)
- Tsymbaliuk I., Unukovych D., Shvets N., Dinets A. Cardiovascular complications secondary to Graves’ disease: a prospective study from Ukraine. PLoS One. 2015. 10(3). e0122388. doi: 10.1371/journal.pone.0122388.
- Ogorodnik T.O., Mishalov V.H., Dinets A.V. Analysis of simultaneous operations in patients with hyperglycemia. Surgery of Ukraine. 2019. 1. DOI: https://doi.org/10.30978/SU2019-1-57.
- McCafferty B.J., Hill J.O., Gunn A.J. Obesity: Scope, Lifestyle Interventions, and Medical Management. Tech. Vasc. Interv. Radiol. 2020. 23(1). 100653. doi: 10.1016/j.tvir.2020.100653.
- Brown E., Wilding J.P.H., Barber T.M., Alam U., Cuthbertson D.J. Weight loss variability with SGLT2 inhibitors and GLP-1 receptor agonists in type 2 diabetes mellitus and obesity: Mechanistic possibilities. Obes. Rev. 2019. 20(6). 816-28. doi: 10.1111/obr.12841.
- Johansen M.Y., Karstoft K., MacDonald C.S., Hansen K.B., Ellingsgaard H., Hartmann B., et al. Effects of an intensive lifestyle intervention on the underlying mechanisms of improved glycaemic control in individuals with type 2 diabetes: a secondary analysis of a randomised clinical trial. Diabetologia. 2020. 63(11). 2410-22. doi: 10.1007/s00125-020-05249-7.
- Iqbal J., Wu H.X., Hu N., Zhou Y.H., Li L., Xiao F., et al. Effect of glucagon-like peptide-1 receptor agonists on body weight in adults with obesity without diabetes mellitus — a systematic review and meta-analysis of randomized control trials. Obes. Rev. 2022. e13435. doi: 10.1111/obr.13435.
- Benza T. Obesity: modern approaches to rational therapy. Liky Ukrainy. 2019. 3. 4-9. (in Russian)
- Kovalenko T.M., Zhabchenko I.A., Lyannoy T.M. Program of complex rehabilitation of pregnant women with alimentary-constitutional obesity in the third trimester. Pedagogy, psychology and medical-biological problems of physical education and sports. 2011. 3. 79-83. (in Ukrainian)
- Ferreira J.C., Patino C.M. Loss to follow-up and missing data: important issues that can affect your study results. J. Bras. Pneumol. 2019. 45(2). e20190091. doi: 10.1590/1806-3713/e20190091.

/15.jpg)
/16.jpg)