Вступ
Атопічний дерматит (АД) — це хронічне запальне захворювання шкіри, що характеризується екзематозними ураженнями та інтенсивним свербінням, що часто суттєво впливає на повсякденну діяльність та якість життя пацієнтів та їхніх сімей [1, 2]. Сенсибілізація до кліщів домашнього пилу (КДП) та харчових алергенів часто зустрічається серед пацієнтів з АД; однак роль сенсибілізації IgE у клінічному перебігу АД недостатньо вивчена [3].
Алергенспецифічна імунотерапія (АСІТ) вважається ефективним медикаментозним лікуванням IgE-опосередкованих захворювань, включаючи бронхіальну астму (БА) легкого та середнього ступеня тяжкості, алергічний риніт (АР) та кон’юнктивіт, анафілаксію на отруту перетинчастокрилих та харчову алергію, і ця терапія використовується більше ніж 100 років [4, 5]. Роль алергенспецифічної імунотерапії у лікуванні пацієнтів з АД вважається суперечливою, і, згідно з поточними рекомендаціями, імунотерапія алергеном не рекомендується як загальний варіант лікування АД.
Субкутанна імунотерапія (СКІТ) продемонструвала потенціал для забезпечення довготривалого контролю захворювання, навіть після завершення лікування [5]. У рандомізованому подвійному сліпому плацебо-контрольованому дослідженні, проведеному в Німеччині, СКІТ з екстрактом кліща була ефективною як додаткова терапія у дорослих пацієнтів, хворих на тяжкий АД, сенсибілізованих до КДП [7]. За останні 30 років сублінгвальна імунотерапія (СЛIT) була введена в практику лікування алергії з ефективністю, порівнянною з такою при СКІТ, але з більш безпечним профілем, що дозволяє самостійне її застосування пацієнтом [5, 6]. Кілька контрольованих досліджень розглядали ефективність СЛIT при АД [8, 9], але її використання в лікуванні АД у дітей на сьогодні потребує подальших досліджень [6, 10].
Метою даного дослідження було вивчити роль СЛIT як додаткового лікування у дітей, хворих на АД, сенсибілізованих до КДП, шляхом проведення рандомізованого 18-місячного клінічного дослідження з екстрактом КДП або плацебо.
Матеріали та методи
Дане рандомізоване плацебо-контрольоване дослідження проводилося з вересня 2020 року по квітень 2022 року в МЦ «Алерголог», м. Київ. У дослідження включені 26 хворих на АД віком 4–18 років, із оцінкою АД за шкалою SCORAD (SCORing for Atopic Dermatiti, шкала для оцінки атопічного дерматиту) від 15 до 70, що мали супутній алергічний риніт та/або контрольовану бронхіальну астму. Усі хворі мали сенсибілізацію до КДП Dermatophagoides pteronyssinus (Dpt), визначену за допомогою шкірної проби та/або специфічного IgE до Dpt, виміряного за допомогою ImmunoCAP. Хворих випадковим чином розділили на дві групи: групу, що отримувала СЛIT, та контрольну групу. Пацієнти групи СЛIT отримували лікування мікст-алергенами побутовими ТОВ «Імунолог» (Україна) та необхідними симптоматичними засобами. Діти контрольної групи отримували лише симптоматичну терапію. Термін лікування становив 18 місяців. Під час лікування через регулярні проміжки часу реєстрували показник за SCORAD та проводили анкетування за СDLQI (Children’s Dermatology Life Quality Index, дерматологічний індекс якості життя дітей). Тип і кількість використовуваного симптоматичного препарату реєструвалися протягом періоду випробування, а також відзначалася кількість побічних ефектів.
Проведене дослідження відповідало етичним стандартам Гельсінської декларації 1975 року та схвалено етичною комісією НМУ імені О.О. Богомольця. Від усіх учасників/батьків дітей, включених до дослідження, була отримана інформована згода.
Були включені пацієнти обох статей віком від 4 до 18 років. Критеріями включення були: тривалість АД понад 2 роки; позитивний шкірний тест з екстрактом КДП або рівень сироваткового Der.p.-специфічного IgE класу 2 або вище (ImmunoCAP; Phadia, Упсала, Швеція); ступінь тяжкості за шкалою SCORAD 15–70 балів.
Критерії виключення були такими: неконтрольована БА; будь-який попередній курс імунотерапії; тяжкі системні захворювання (наприклад, муковісцидоз, цукровий діабет, целіакія) або злоякісні пухлини.
Сироваткові аналізи sIgE
Визначення сироваткового sIgE проводили згідно з рекомендаціями з використанням панелі біологічно стандартизованих алергенів (ImmunoCAP 100 (Thermo Fisher Scientific Inc., Phadia, Швеція)), яка включала екстракт КДП (Dermatophagoides pteronyssinus). За даними виробника, поріг чутливості аналізатора становить 0,01 KuA/I, межа cut-off для специфічних IgE прийнята рівною 0,35 KuA/I. Також при інтерпретації результатів використовували розподіл одержаних концентрацій специфічних IgE-антитіл на класи сенсибілізації згідно з рекомендаціями виробника. Результати визначення специфічних IgE-антитіл вважалися позитивними при рівні > 0,35 KuA/І. Залежно від концентрації алерген-специфічних IgE виділяли класи: 0-й клас — специфічні антитіла відсутні (< 0,35 KuA/І); І клас — дуже низький рівень антитіл, часто без клінічних симптомів алергії (0,35–0,7 KuA/І); ІІ клас — низький рівень антитіл, алергія, клінічні симптоми наявні при показниках, що наближаються до верхньої межі діапазону (0,7–3,5 KuA/І); ІІІ клас — чітко виражений рівень антитіл, клінічні симптоми зазвичай наявні (3,5–17,5 KuA/І); IV клас — високі рівні антитіл, майже завжди супроводжується алергічною реакцією (17,5–50 KuA/І); V клас — дуже високі рівні антитіл (50–100 KuA/І); VI клас — екстремально високий рівень антитіл (> 100 KuA/І).
Лікування
Діти контрольної групи отримували лікування лише левоцетиризину гідрохлоридом для прийому всередину та застосовували місцево емолієнт та крем бетаметазону дипропіонату (1 г крему містить 0,64 мг бетаметазону дипропіонату) на уражені ділянки шкіри протягом 7–14 днів.
Пацієнти першої підгрупи отримували мікст-алергени побутові ТОВ «Імунолог» (Україна) протягом 18 місяців перорально/сублінгвально. Відповідно до інструкцій виробника, мікст-алергени побутові (суміші алергенів, узяті у рівних співвідношеннях) мали такий склад: домашній пил, збагачений Dermatophagoides pteronyssinus; домашній пил, збагачений Dermatophagoides farinaе; домашній пил, збагачений Acarus siro; пір’я подушок. 1 драже містить: 0,2 PNU (контейнер № 1), або 2,0 PNU (контейнер № 2), або 20,0 PNU (контейнер № 3), або 200,0 PNU (контейнер № 4), або 1000,0 PNU (контейнер № 5). Драже з контейнера № 1 застосовувати таким чином: у перший день — 1 драже, у другий — 2 драже, у третій — 3 драже, у четвертий — 4 драже, у п’ятий — 5 драже. Прийом драже з контейнера № 2 розпочинали через день після застосування останніх драже з контейнера № 1: у перший день — 1 драже, у третій день — 2 драже, у п’ятий — 3 драже, у сьомий — 4 драже, у дев’ятий — 5 драже. Прийом драже з контейнера № 3 розпочинали через два дні після застосування останніх драже з контейнера № 2: у перший день — 1 драже, у третій день — 2 драже, у шостий — 3 драже, у дев’ятий — 4 драже, у дванадцятий — 5 драже. Прийом драже з контейнера № 4 розпочинали через тиждень після застосування останніх драже з контейнера № 3: у перший тиждень — 1 драже, у другий тиждень — 2 драже, у третій тиждень — 3 драже, у четвертий тиждень — 4 драже, у п’ятий тиждень — 5 драже. Прийом драже з контейнера № 5 розпочинали через 2 тижні після застосування останніх драже з контейнера № 4: по 1 драже 1 раз на 2 тижні. Надалі драже з контейнера № 5 приймали 1 раз на місяць по 2 драже протягом 14 місяців.
Залежно від ступеня тяжкості АД додавали левоцетиризину гідрохлорид та топічно крем бетаметазону дипропіонат, аналогічно контрольній групі.
Протягом усього дослідження всі пацієнти робили контрольні візити. Основним результатом була зміна за SCORAD порівняно з вихідним рівнем. Базовий рівень за SCORAD оцінювали до початку лікування, а потім на 6, 12 та 18-му місяці лікування.
Статистичну обробку отриманих даних проводили за допомогою статистичного пакета IBM SPSS Statistics Base (версія 22) та програмного забезпечення EZR, версія 1.32 (графічний інтерфейс середовища R, версія 2.13.0). Базу даних дослідження було систематизовано в редакторі Microsoft Excel. Відмінність в ефективності терапії між двома підгрупами визначалась за допомогою Т-критерію Вілкоксона, у кожній підгрупі до та після лікування — за допомогою W-критерію Вілкоксона, відмінність вважалася статистично значущою на рівні p < 0,05.
Результати
26 пацієнтів віком від 4 до 18 років (середній вік 10,38 ± 3,5 року) були включені в дослідження та рандомізовані — 12 хворих увійшли до групи СЛІТ, 14 — до контрольної групи. Усі хворі мали сенсибілізацію до пилового кліща. Не було значущих відмінностей між двома групами за віком, співвідношенням статей, тривалістю, тяжкістю захворювання та вихідним рівнем sIgE (усі p > 0,05; табл. 1). Усі хворі основної та контрольної груп завершили дослідження. Жоден пацієнт не відмовився від дослідження через несприятливі явища в результаті терапії.
Після 18 місяців лікування зниження показника за SCORAD від вихідного рівня становило 43,4 % у групі СЛІТ та 10,3 % у групі плацебо (W = 104,0, p = 0,003) (рис. 1, табл. 2).
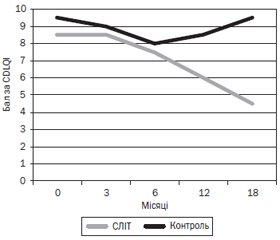
Показник за СDLQI також продемонстрував покращення в групі лікування СЛІТ зі значною різницею порівняно з контрольною групою після 18 місяців лікування, різниця між двома групами за W-критерієм Вілкоксона статистично значима (зниження на 40,7 % у групі СЛІТ, у групі контролю не виявлено покращення, W = 106,5, p = 0,004) (рис. 2, табл. 2).
Не було значущих відмінностей у рівнях сироваткових Der.p.-специфічних sIgE між основною та контрольною групою через 18 місяців від початку лікування (p > 0,05).
Жоден пацієнт не потребував госпіталізації і не був виключений з дослідження через несприятливі події від лікування. Не повідомлялося про серйозні системні побічні ефекти, анафілаксію, гострий напад БА або застосування адреналіну.
Обговорення
АД є хронічним запальним захворюванням шкіри, поширеність якого зростає в усьому світі, що дуже впливає на життя пацієнтів. Алергени, такі як КДП, як важливий фактор навколишнього середовища, сприяють виникненню АД [3].
Роль СКІТ у лікуванні АД була продемонстрована попередніми дослідженнями [11–13]. Застосування СКІТ на основі екстракту КДП серед пацієнтів з КДП-чутливим АД призвело до зниження балів за шкалою SCORAD і зниження потреби в місцевих кортикостероїдах [14]. СЛІТ є безпечнішою та зручнішою альтернативою СКІТ, але поки що вона має обмежене застосування в клінічному лікуванні пацієнтів з АД. Останнім часом лише незначна кількість досліджень повідомили про результати СЛІТ у пацієнтів з АД [15–19]. Дослідження N. Yu [20] продемонструвало, що дворічна СЛІТ до КДП значно покращила клінічні симптоми та зменшила вживання ліків у пацієнтів із легким та середньотяжким АД.
Нашою метою було оцінити клінічну ефективність СЛІТ у дітей з АД. Після 18 місяців лікування більшість хворих у групі СЛІТ продемонстрували значне зниження показників за SCORAD порівняно з такими в групі плацебо (на 43,4 % у групі СЛІТ та на 10,3 % у групі плацебо (W = 104,0, p = 0,003). СЛІТ добре переносилася, тяжких системних реакцій не спостерігалося. Показник за СDLQI також продемонстрував покращення в групі лікування СЛІТ зі значною різницею порівняно з контрольною групою після 18 місяців лікування.
На сьогодні не існує визнаних серологічних індикаторів для прогнозування та визначення ефективності СЛІТ при АД. Однак деякі дослідники вивчали зміни рівня IgE до та після лікування СЛІТ, і результати не були узгоджені [15, 18, 21, 22]. У нашому дослідженні рівні алерген-специфічного IgE в обох групах залишалися незмінними до та після лікування. Для визначення впливу специфічної імунотерапії на рівень IgE можуть знадобитися подальші дослідження.
Безпека СЛІТ широко вивчена [23]. Найпоширенішими побічними реакціями є місцеві побічні ефекти, включаючи оніміння, свербіж, набряк рота та язика. У нашому дослідженні не спостерігалося серйозних системних реакцій або анафілаксії.
Це перше дослідження СЛІТ за участю дітей, хворих на АД, в Україні. У цьому дослідженні є кілька обмежень: невелика вибірка та недостатня тривалість спостереження. У майбутньому потрібна велика кількість підтверджуючих контрольованих досліджень і довготривалих випробувань, щоб перевірити ефект і безпеку СЛІТ у дітей, хворих на АД.
Висновки
Це рандомізоване дослідження показало, що СЛІТ екстрактом КДП може забезпечити значну клінічну ефективність у дітей, хворих на АД, що продемонстровано значним загальним зниженням балів за шкалою SCORAD та бала за опитувальником СDLQI. Залишається необхідність проведення підтверджуючих контрольованих досліджень з довгостроковим курсом лікування.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Це дослідження профінансовано з державного бюджету. Наукове дослідження є фрагментом планової науково-дослідної роботи кафедри педіатрії № 2 Національного медичного університету імені О.О. Богомольця «Особливості клінічного перебігу та лікування бронхіальної астми у дітей з надлишковою масою тіла та ожирінням» (№ 0120U100804).
Подяки. Ми дякуємо пацієнтам та їхнім батькам за участь у дослідженні та за співпрацю.
Отримано/Received 20.04.2022
Рецензовано/Revised 02.05.2022
Прийнято до друку/Accepted 13.05.2022
Список литературы
1. Волосовец А.П., Бекетова Г.В., Березенко В.С., Митюряева И.А., Волосовец Т.Н., Починок Т.В. Динамика заболеваемости и распространенности атопического дерматита у детей Украины за последние 20 лет: медико-экологические аспекты. Педиатрия. Восточная Европа. 2021. (2). 206-216. DOI: 10.34883/PI.2021.9.2.005.
2. Волосовець О.П., Больбот Ю.К., Бекетова Г.В., Березенко В.С., Уманец Т.Р., Речкина О.О. та ін. Алергічний марш у дітей України. Медичні перспективи. 2021. 26(4). 181-188. doi.org/10.26641/2307-0404.2021.4.248227.
3. Bumbacea R.S., Corcea S.L., Ali S., Dinica L.C., Fanfaret I.S., Boda D. Mite allergy and atopic dermatitis: Is there a clear link? (Review). Exp. Ther. Med. 2020 Oct. 20(4). 3554-3560. doi: 10.3892/etm.2020.9120. Epub 2020 Aug 13. PMID: 32905207. PMCID: PMC7465295.
4. Матвєєва С.Ю., Уманець Т.Р. Ефективність сублінгвальної алерген-специфічної імунотерапії у дітей з весняним полінозом та пилково-харчовим синдромом. World Science. 2019. 2(3). 34-41. doi:10.31435/rsglobal_ws/31032019/6409.
5. Incorvaia C., Al-Ahmad M., Ansotegui I.J., Arasi S., Bachert C., Bos C., Bousquet J., et al. Personalized medicine for allergy treatment: Allergen immunotherapy still a unique and unmatched model. Allergy. 2021 Apr. 76(4). 1041-1052. doi: 10.1111/all.14575. Epub 2020 Oct 19. PMID: 32869882.
6. Passalacqua G., Bagnasco D., Canonica G.W. 30 years of sublingual immunotherapy. Allergy. 2020 May. 75(5). 1107-1120. doi: 10.1111/all.14113. Epub 2019 Dec 20. PMID: 31715001.
7. Novak N., Bieber T., Hoffmann M., Fölster-Holst R., Homey B., Werfel T., Sager A., Zuberbier T. Efficacy and safety of subcutaneous allergen-specific immunotherapy with depigmented polymerized mite extract in atopic dermatitis. J. Allergy Clin. Immunol. 2012 Oct. 130(4). 925-31.e4. doi: 10.1016/j.jaci.2012.08.004. Epub 2012 Sep 1. PMID: 22947344.
8. Bae J.M., Choi Y.Y., Park C.O., Chung K.Y., Lee K.H. Efficacy of allergen-specific immunotherapy for atopic dermatitis: a systematic review and meta-analysis of randomized controlled trials. J. Allergy Clin. Immunol. 2013 Jul. 132(1). 110-7. doi: 10.1016/j.jaci.2013.02.044. Epub 2013 May 3. PMID: 23647790.
9. Tam H.H., Calderon M.A., Manikam L., Nankervis H., Núñez I.G., Williams H.C., Durham S.R., Boyle R.J. Specific allergen immunotherapy for the treatment of atopic eczema: a Cochrane systematic review. Allergy. 2016 Sep. 71(9). 1345-56. doi: 10.1111/all.12932. Epub 2016 Jun 22. PMID: 27184158.
10. Caminiti L., Panasiti I., Landi M., De Filippo M., Olcese R., Ciprandi G., Vernich M., Carelli F., Votto M., Barberi S. Allergen immunotherapy in atopic dermatitis: Light and shadow in children. Pediatr. Allergy Immunol. 2020 Nov. 31. Suppl. 26. 46-48. doi: 10.1111/pai.13390. PMID: 33236444.
11. Nahm D.H., Kim M.E., Kwon B., Cho S.M., Ahn A. Clinical Efficacy of Subcutaneous Allergen Immunotherapy in Patients with Atopic Dermatitis. Yonsei Med. J. 2016 Nov. 57(6). 1420-6. doi: 10.3349/ymj.2016.57.6.1420. PMID: 27593870. PMCID: PMC5011274.
12. Zhou J., Chen S., Song Z. Analysis of the long-term efficacy and safety of subcutaneous immunotherapy for atopic dermatitis. Allergy Asthma Proc. 2021 Mar 1. 42(2). e47-e54. doi: 10.2500/aap.2021.42.200126. PMID: 33685566. PMCID: PMC8133014.
13. Elazab S.Z., Hessam W.F., Gomaa A.H. Effect of Cluster Allergen-Specific Immunotherapy in Patients with Atopic Dermatitis Sensitive to House Dust Mite. Egypt J. Immunol. 2018 Jun. 25(2). 97-106. PMID: 30600952.
14. Werfel T., Breuer K., Ruéff F., Przybilla B., Worm M., Grewe M. et al. Usefulness of specific immunotherapy in patients with atopic dermatitis and allergic sensitization to house dust mites: a multi-centre, randomized, dose-response study. Allergy. 2006 Feb. 61(2). 202-5. doi: 10.1111/j.1398-9995.2006.00974.x. PMID: 16409197.
15. Pajno G.B., Caminiti L., Vita D., Barberio G., Salzano G., Lombardo F., Canonica G.W., Passalacqua G. Sublingual immunotherapy in mite-sensitized children with atopic dermatitis: a randomized, double-blind, placebo-controlled study. J. Allergy Clin. Immunol. 2007 Jul. 120(1). 164-70. doi: 10.1016/j.jaci.2007.04.008. Epub 2007 Jun 1. PMID: 17543376.
16. Qin Y.E., Mao J.R., Sang Y.C., Li W.X. Clinical efficacy and compliance of sublingual immunotherapy with Dermatophagoides farinae drops in patients with atopic dermatitis. Int. J. Dermatol. 2014 May. 53(5). 650-5. doi: 10.1111/ijd.12302. Epub 2013 Aug 22. PMID: 23968339.
17. You H.S., Yang M.Y., Kim G.W., Cho H.H., Kim W.J., Mun J.H. et al. Effectiveness of Specific Sublingual Immunotherapy in Korean Patients with Atopic Dermatitis. Ann. Dermatol. 2017 Feb. 29(1). 1-5. doi: 10.5021/ad.2017.29.1.1. Epub 2017 Feb 3. PMID: 28223739. PMCID: PMC5318503.
18. Cadario G., Galluccio A.G., Pezza M., Appino A., Milani M., Pecora S., Mastrandrea F. Sublingual immunotherapy efficacy in patients with atopic dermatitis and house dust mites sensitivity: a prospective pilot study. Curr. Med. Res. Opin. 2007 Oct. 23(10). 2503-6. doi: 10.1185/030079907X226096. PMID: 17784996.
19. Di Rienzo V., Cadario G., Grieco T., Galluccio A.G., Caffarelli C., Liotta G., Pecora S., Burastero S.E. Sublingual immunotherapy in mite-sensitized children with atopic dermatitis: a randomized, open, parallel-group study. Ann. Allergy Asthma Immunol. 2014 Dec. 113(6). 671-673.e1. doi: 10.1016/j.anai.2014.09.009. Epub 2014 Oct 7. PMID: 25304342.
20. Yu N., Luo H., Liang D., Lu N. Sublingual immunotherapy in mite-sensitized patients with atopic dermatitis: a randomized controlled study. Postepy Dermatol. Alergol. 2021 Feb. 38(2). 69-74. doi: 10.5114/ada.2021.104281. Epub 2021 Mar 10. PMID: 34408569. PMCID: PMC8362773.
21. Silny W., Czarnecka-Operacz M. Immunoterapia swoista w leczeniu chorych na atopowe zapalenie skóry-wyniki badania prowadzonego w warunkach podwójnie ślepej próby [Specific immunotherapy in the treatment of patients with atopic dermatitis — results of double blind placebo controlled study]. Pol. Merkur Lekarski. 2006 Dec. 21(126). 558-65. Polish. PMID: 17405298.
22. Zhong H., Deng X., Song Z., Darsow U., Chen W., Chen S., Luo N., Hao F. Immunological changes after ASIT in AD allergen-specific immunotherapy and their potential correlation with clinical response in patients with atopic dermatitis patients sensitized to house dust mite. J. Eur. Acad. Dermatol. Venereol. 2015 Jul. 29(7). 1318-24. doi: 10.1111/jdv.12813. Epub 2014 Nov 6. PMID: 25376542.
23. Muraro A., Roberts G., Halken S., Agache I., Angier E., Fernandez-Rivas M., et al. EAACI guidelines on allergen immunotherapy: Executive statement. Allergy. 2018 Apr. 73(4). 739-743. doi: 10.1111/all.13420. PMID: 29380390.
/34.jpg)
/35.jpg)

/34_2.jpg)
/35_2.jpg)