Международный эндокринологический журнал Том 18, №5, 2022
Вернуться к номеру
Стрес та артеріальна гіпертензія: С- і Н-тип артеріальної гіпертензії і причини резистентності
Авторы: Сіренко Ю.М., Радченко Г.Д., Рековець О.Л.
ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска» НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Неконтрольований артеріальний тиск (АТ), особливо на фоні стресу, пов’язаний з чотириразовим збільшенням ризику розвитку серцево-судинних подій порівняно з пацієнтами з артеріальною гіпертензією (АГ), які досягли цільового рівня АТ. Мета дослідження: оцінити механізми впливу стресу на розвиток артеріальної гіпертензії, типів артеріальної гіпертензії і резистентність. Матеріали та методи. У дослідження було включено 1146 пацієнтів з резистентною АГ, які приймали 3 і більше антигіпертензивних препарати і лікувалися у відділенні вторинних і легеневих гіпертензій ДУ «ННЦ «Інститут кардіології, клінічної і регенеративної медицини ім. акад. М.Д. Стражеска» НАМН України. Рівень офісного АТ при надходженні у відділення при прийомі трьох і більше антигіпертензивних препаратів становив: систолічного — 174,60 ± 0,64 мм рт.ст., діастолічного — 100,50 ± 0,38 мм рт.ст. Пацієнтам проводили наступні обстеження: вимірювання офісного АТ, добове моніторування артеріального тиску, ехокардіографічне дослідження, визначення нічного апное сну, загальний аналіз крові, біохімічний аналіз крові, визначення рівнів тиреотропного гормону, трийодтироніну, тироксину, реніну крові, альдостерону крові та їх співвідношення, визначення метанефринів сечі, кортизолу. Результати. Серед пацієнтів з резистентною артеріальною гіпертензією жінок було більше, ніж чоловіків — 62,7 % проти 36,7 % відповідно. У дослідженні пацієнтів з резистентною АГ, у яких не було досягнуто цільового рівня систолічного АТ, спостерігались достовірно вищі показники АТ при надходженні в стаціонар. У них був достовірно вищий рівень кортизолу крові (155,0 ± 44,0 нг/л проти 35,9 ± 20,8 нг/л, р = 0,026), вищий індекс маси міокарда лівого шлуночка (147,50 ± 3,46 г/м2 проти 135,3 ± 1,74 г/м2), частіше відзначалося ожиріння (42,9 % проти 37,5 %). Висновки. Пацієнти з резистентною артеріальною гіпертензією, які не досягли цільового рівня артеріального тиску, мали вищий рівень кортизолу й індекс маси міокарда лівого шлуночка порівняно з пацієнтами, у яких було досягнуто цільових рівнів артеріального тиску.
Background. Uncontrolled blood pressure (BP), especially in the context of stress, is associated with a fourfold increase in the risk of developing cardiovascular events compared to patients with hypertension who have reached the target BP level. Aim: to evaluate the mechanisms of the influence of stress on the development of hypertension, types of hypertension and resistance. Materials and methods. The study included 1,146 patients with resistant hypertension who were taking 3 or more antihypertensive drugs and were treated at the department of secondary and pulmonary hypertensions of the State Institution “National Scientific Center “M.D. Strazhesko Institute of Cardiology” of the National Academy of Medical Sciences of Ukraine”. The level of office blood pressure upon admission to the department when taking 3 or more antihypertensive drugs was: systolic — 174.60 ± 0.64 mmHg, diastolic — 100.50 ± 0.38 mmHg. Patients underwent the following examinations: measurement of office blood pressure, daily blood pressure monitoring, echocardiography, measurement of nocturnal sleep apnea, general blood analysis, biochemical blood analysis, determining the levels of thyroid-stimulating hormone, triiodothyronine, thyroxine, blood renin, blood aldosterone and their ratio, urine metanephrines, blood cortisol. Results. Among patients with resistant hypertension, there were more women than men — 62.7 versus 36.7 %, respectively. In a study of people with resistant hypertension who did not reach the target level of systolic BP, significantly higher indicators of BP were observed upon admission to the hospital. They had a significantly higher blood cortisol level (155.0 ± 44.0 vs. 35.9 ± 20.8 ng/l, p = 0.026), higher left ventricular mass index (147.50 ± 3.46 vs. 135.30 ± 1.74 g/m2), obesity was more common among them (42.9 versus 37.5 %). Conclusions. Patients with resistant hypertension who did not reach the target level of blood pressure had higher level of cortisol and left ventricular mass index compared to those who achieved the target levels of blood pressure.
симпатоадреналова система; стрес; артеріальна гіпертензія; резистентна гіпертензія; С- і Н-тип артеріальної гіпертензії
sympathoadrenal system; stress; hypertension; resistant hypertension; C and H type hypertension
Вступ
Історичні аспекти формування теорії впливу стресу на серцево-судинну систему
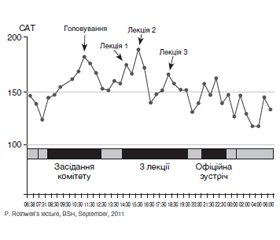
Що таке стрес і які механізми його дії на артеріальний тиск
/15.jpg)
Дані досліджень щодо існування зв’язку між стресом і формуванням артеріальної гіпертензії
Варіанти стрес-індукованої артеріальної гіпертензії
/18.jpg)
Матеріали та методи
/20.jpg)
Результати
Обговорення
Висновки
- Heine H., Weiss M. Life stress and hypertension. Eur. Heart J. 1987 May. 8 Suppl. B. 45-55. doi: 10.1093/eurheartj/8.suppl_b.45. PMID: 3038555.
- Boone J.L. Stress and hypertension. Prim. Care. 1991 Sep. 18(3). 623-49. PMID: 1946791.
- Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія». Наказ МОЗ України № 384 від 24.05.2012. Київ, 2012. 107 с.
- Allen M.T., Matthews K.A., Sherman F.S. Cardiovascular reactivity to stress and left ventricular mass in youth. Hypertension. 1997 Oct. 30(4). 782-7. doi: 10.1161/01.hyp.30.4.782. PMID: 9336373.
- Berntson G.G., Sarter M., Cacioppo J.T. Anxiety and cardiovascular reactivity: the basal forebrain cholinergic link. Behav. Brain Res. 1998 Aug. 94(2). 225-48. doi: 10.1016/s0166-4328(98)00041-2. PMID: 9722275.
- Culman J., Klee S., Ohlendorf C., Unger T. Effect of tachykinin receptor inhibition in the brain on cardiovascular and behavioral responses to stress. J. Pharmacol. Exp. Ther. 1997 Jan. 280(1). 238-46. PMID: 8996202.
- Dolan E., Stanton A., Atkins N., Den Hond E., Thijs L., McCormack P., Staessen J., O’Brien E. Determinants of white-coat hypertension. Blood Press. Monit. 2004 Dec. 9(6). 307-9. doi: 10.1097/00126097-200412000-00007. PMID: 15564985.
- Carroll D., Phillips A.C., Der G., Hunt K., Benzeval M. Blood pressure reactions to acute mental stress and future blood pressure status: data from the 12-year follow-up of the West of Scotland Study. Psychosom. Med. 2011 Nov-Dec. 73(9). 737-42. doi: 10.1097/PSY.0b013e3182359808. Epub 2011 Oct 21. PMID: 22021460.
- Carroll D., Ring C., Hunt K., Ford G., Macintyre S. Blood pressure reactions to stress and the prediction of future blood pressure: effects of sex, age, and socioeconomic position. Psychosom. Med. 2003 Nov-Dec. 65(6). 1058-64. doi: 10.1097/01.psy.0000097330.58739.26. PMID: 14645786.
- Carroll D., Smith G.D., Shipley M.J., Steptoe A., Brunner E.J., Marmot M.G. Blood pressure reactions to acute psychological stress and future blood pressure status: a 10-year follow-up of men in the Whitehall II study. Psychosom. Med. 2001 Sep-Oct. 63(5). 737-43. doi: 10.1097/00006842-200109000-00006. PMID: 11573021.
- Eide I., Kolloch R., De Quattro V., Miano L., Dugger R., Van der Meulen J. Raised cerebrospinal fluid norepinephrine in some patients with primary hypertension. Hypertension. 1979 May-Jun. 1(3). 255-60. doi: 10.1161/01.hyp.1.3.255. PMID: 399237.
- Elder A.T., Jyothinagaram S.G., Padfield P.L., Shaw T.R. Haemodynamic response in soccer spectators: is Scottish football exciting? BMJ. 1991 Dec 21–28. 303(6817). 1609-10. doi: 10.1136/bmj.303.6817.1609. PMID: 1773191; PMCID: PMC1676237.
- Esler M., Jennings G., Lambert G., Meredith I., Horne M., Eisenhofer G. Overflow of catecholamine neurotransmitters to the circulation: source, fate, and functions. Physiol. Rev. 1990 Oct. 70(4). 963-85. doi: 10.1152/physrev.1990.70.4.963. PMID: 1977182.
- Everson S.A., Kaplan G.A., Goldberg D.E., Salonen J.T. Anticipatory blood pressure response to exercise predicts future high blood pressure in middle-aged men. Hypertension. 1996 May/ 27(5)/ 1059-64. doi: 10.1161/01.hyp.27.5.1059. PMID: 8621197.
- Fagard R.H., Cornelissen V.A. Incidence of cardiovascular events in white-coat, masked and sustained hypertension versus true normotension: a meta-analysis. J. Hypertens. 2007 Nov. 25(11). 2193-8. doi: 10.1097/HJH.0b013e3282ef6185. PMID: 17921809.
- Fauvel J.P., M’Pio I., Quelin P., Rigaud J.P., Laville M., Ducher M. Neither perceived job stress nor individual cardiovascular reactivity predict high blood pressure. Hypertension. 2003 Dec. 42(6). 1112-6. doi: 10.1161/01.HYP.0000102862.93418.EE. Epub 2003 Nov 3. PMID: 14597647.
- Ferrier C., Jennings G.L., Eisenhofer G., Lambert G., Cox H.S., Kalff V., Kelly M., Esler M.D. Evidence for increased noradrenaline release from subcortical brain regions in essential hypertension. J. Hypertens. 1993 Nov. 11(11). 1217-27. PMID: 8301103.
- Folkow B. «Structural factor” in primary and secondary hypertension. Hypertension. 1990 Jul. 16(1). 89-101. doi: 10.1161/01.hyp.16.1.89. PMID: 2365448.
- Franklin S.S., Thijs L., Hansen T.W., Li Y., Boggia J., Kikuya M., Björklund-Bodegård K., et al.; International Database on Ambulatory Blood Pressure in Relation to Cardiovascular Outcomes Investigators. Significance of white-coat hypertension in older persons with isolated systolic hypertension: a meta-analysis using the International Database on Ambulatory Blood Pressure Monitoring in Relation to Cardiovascular Outcomes population. Hypertension. 2012 Mar. 59(3). 564-71. doi: 10.1161/HYPERTENSIONAHA.111.180653. Epub 2012 Jan 17. PMID: 22252396; PMCID: PMC3607330.
- Julius S., Esler M. Autonomic nervous cardiovascular regulation in borderline hypertension. Am. J. Cardiol. 1975 Oct 31. 36(5). 685-96. doi: 10.1016/0002-9149(75)90170-8. PMID: 171939.
- Gerin W., Chaplin W., Schwartz J.E., Holland J., Alter R., Wheeler R., Duong D., Pickering T.G. Sustained blood pressure increase after an acute stressor: the effects of the 11 September 2001 attack on the New York City World Trade Center. J. Hypertens. 2005 Feb. 23(2). 279-84. doi: 10.1097/00004872-200502000-00009. PMID: 15662215.
- Harburg E., Erfurt J.C., Hauenstein L.S., Chape C., Schull W.J., Schork M.A. Socio-ecological stress, suppressed hostility, skin color, and Black-White male blood pressure: Detroit. Psychosom. Med. 1973 Jul-Aug. 35(4). 276-96. doi: 10.1097/00006842-197307000-00003. PMID: 4719018.
- Harburg E., Erfurt J.C., Chape C., Hauenstein L.S., Schull W.J., Schork M.A. Socioecological stressor areas and black-white blood pressure: Detroit. J. Chronic Dis. 1973 Sep. 26(9). 595-611. doi: 10.1016/0021-9681(73)90064-7. PMID: 4759583.
- Hill M.N., Miller N.H., Degeest S.; American Society of Hypertension Writing Group, Materson B.J., Black H.R., Izzo J.L. Jr, Oparil S., Weber M.A. Adherence and persistence with taking medication to control high blood pressure. J. Am. Soc. Hypertens. 2011 Jan-Feb. 5(1). 56-63. doi: 10.1016/j.jash.2011.01.001. PMID: 21320699.
- Johansson M., Rundqvist B., Eisenhofer G., Friberg P. Cardiorenal epinephrine kinetics: evidence for neuronal release in the human heart. Am. J. Physiol. 1997 Nov. 273(5). H2178-85. doi: 10.1152/ajpheart.1997.273.5.H2178. PMID: 9374751.
- Johnston D.W., Gold A., Kentish J., Smith D., Vallance P., Shah D., Leach G., Robinson B. Effect of stress management on blood pressure in mild primary hypertension. BMJ. 1993 Apr 10. 306(6883). 963-6. doi: 10.1136/bmj.306.6883.963. PMID: 8490471; PMCID: PMC1677411.
- Julius S., Li Y., Brant D., Krause L., Buda A.J. Neurogenic pressor episodes fail to cause hypertension, but do induce cardiac hypertrophy. Hypertension. 1989 May. 13(5). 422-9. doi: 10.1161/01.hyp.13.5.422. PMID: 2524441.
- Julius S., Nesbitt S. Sympathetic overactivity in hypertension. A moving target. Am. J. Hypertens. 1996 Nov. 9(11). 113S-120S. doi: 10.1016/0895-7061(96)00287-7. PMID: 8931844.
- Kannel W.B., Kannel C., Paffenbarger R.S. Jr, Cupples L.A. Heart rate and cardiovascular mortality: the Framingham Study. Am. Heart J. 1987 Jun. 113(6). 1489-94. doi: 10.1016/0002-8703(87)90666-1. PMID: 3591616.
- de Jonge J., Mulder M.J., Nijhuis F.J. The incorporation of different demand concepts in the job demand-control model: effects on health care professionals. Soc. Sci Med. 1999 May. 48(9). 1149-60. doi: 10.1016/s0277-9536(98)00429-8. PMID: 10220016.
- Aronow W.S., Fleg J.L., Pepine C.J., Artinian N.T., Bakris G., Brown A.S. et al.; ACCF Task Force. ACCF/AHA 2011 expert consensus document on hypertension in the elderly: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. Circulation. 2011 May 31. 123(21). 2434-506. doi: 10.1161/CIR.0b013e31821daaf6. Epub 2011 Apr 25. PMID: 21518977.
- Lovallo W.R., Gerin W. Psychophysiological reactivity: mechanisms and pathways to cardiovascular disease. Psychosom. Med. 2003 Jan-Feb. 65(1). 36-45. doi: 10.1097/01.psy.0000033128. 44101.c1. PMID: 12554814.
- Mancia G., Bombelli M., Facchetti R., Madotto F., Quarti-Trevano F., Grassi G., Sega R. Increased long-term risk of new-onset diabetes mellitus in white-coat and masked hypertension. J. Hypertens. 2009 Aug. 27(8). 1672-8. doi: 10.1097/HJH.0b013e32832be5f9. PMID: 19417688.
- Mancia G., Bombelli M., Facchetti R., Madotto F., Quarti-Trevano F., Polo Friz H., Grassi G., Sega R. Long-term risk of sustained hypertension in white-coat or masked hypertension. Hypertension. 2009 Aug. 54(2). 226-32. doi: 10.1161/HYPERTENSIONAHA. 109.129882. Epub 2009 Jun 29. PMID: 19564548.
- Mancia G., Di Rienzo M., Parati G. Ambulatory blood pressure monitoring use in hypertension research and clinical practice. Hypertension. 1993 Apr. 21(4). 510-24. doi: 10.1161/01.hyp.21.4.510. PMID: 8458650.
- Mancia G., Facchetti R., Bombelli M., Grassi G., Sega R. Long-term risk of mortality associated with selective and combined elevation in office, home, and ambulatory blood pressure. Hypertension. 2006 May. 47(5). 846-53. doi: 10.1161/01.HYP.0000215363.69793.bb. Epub 2006 Mar 27. PMID: 16567588.
- Mancia G., Ferrari A., Gregorini L., Parati G., Pomidossi G., Bertinieri G., Grassi G. et al. Blood pressure and heart rate variabilities in normotensive and hypertensive human beings. Circ. Res. 1983 Jul. 53(1). 96-104. doi: 10.1161/01.res.53.1.96. PMID: 6861300.
- Mancia G., Ferrari A., Pomidossi G., Parati G., Bertinieri G., Grassi G., Gregorini L. et al. Twenty-four-hour blood pressure profile and blood pressure variability in untreated hypertension and during antihypertensive treatment by once-a-day nadolol. Am. Heart J. 1984 Oct. 108(4 Pt 2). 1078-83. doi: 10.1016/0002-8703(84)90584-2. PMID: 6148866.
- Mancia G., Zanchetti A. White-coat hypertension: misnomers, misconceptions and misunderstandings. What should we do next? J. Hypertens. 1996 Sep. 14(9). 1049-52. doi: 10.1097/00004872-199609000-00001. PMID: 8986902.
- Manuck S.B. Cardiovascular reactivity in cardiovascular disease: “once more unto the breach”. Int. J. Behav. Med. 1994. 1(1). 4-31. doi: 10.1207/s15327558ijbm0101_2. PMID: 16250803.
- Markovitz J.H., Matthews K.A., Kannel W.B., Cobb J.L., D’Agostino R.B. Psychological predictors of hypertension in the Framingham Study. Is there tension in hypertension? JAMA. 1993 Nov 24. 270(20). 2439-43. PMID: 8230620.
- Matthews K.A., Woodall K.L., Allen M.T. Cardiovascular reac–tivity to stress predicts future blood pressure status. Hypertension. 1993 Oct. 22(4). 479-85. doi: 10.1161/01.hyp.22.4.479. PMID: 8406652.
- McCubbin J.A., Bruehl S. Do endogenous opioids mediate the relationship between blood pressure and pain sensitivity in normotensives? Pain. 1994 Apr. 57(1). 63-67. doi: 10.1016/0304-3959(94)90108-2. PMID: 8065798.
- Ming E.E., Adler G.K., Kessler R.C., Fogg L.F., Matthews K.A., Herd J.A., Rose R.M. Cardiovascular reactivity to work stress predicts subsequent onset of hypertension: the Air Traffic Controller Health Change Study. Psychosom. Med. 2004 Jul-Aug. 66(4). 459-65. doi: 10.1097/01.psy.0000132872.71870.6d. PMID: 15272089.
- Palatini P., Casiglia E., Pauletto P., Staessen J., Kaciroti N., Julius S. Relationship of tachycardia with high blood pressure and metabolic abnormalities: a study with mixture analysis in three populations. Hypertension. 1997 Nov. 30(5). 1267-73. doi: 10.1161/01.hyp.30.5.1267. PMID: 9369286.
- Parati G., Antonicelli R., Guazzarotti F., Paciaroni E., Mancia G. Cardiovascular effects of an earthquake: direct evidence by ambulatory blood pressure monitoring. Hypertension. 2001 Nov. 38(5). 1093-5. doi: 10.1161/hy1101.095334. PMID: 11711503.
- Parati G., Casadei R., Groppelli A., Di Rienzo M., Mancia G. Comparison of finger and intra-arterial blood pressure monitoring at rest and during laboratory testing. Hypertension. 1989 Jun. 13 (6 Pt 1). 647-55. doi: 10.1161/01.hyp.13.6.647. PMID: 2500393.
- Parati G., Trazzi S., Ravogli A., Casadei R., Omboni S., Mancia G. Methodological problems in evaluation of cardiovascular effects of stress in humans. Hypertension. 1991 Apr. 17(4 Suppl). III50-5. doi: 10.1161/01.hyp.17.4_suppl.iii50. PMID: 2013493.
- Parati G., Pomidossi G., Casadei R., Ravogli A., Groppelli A., Cesana B., Mancia G. Comparison of the cardiovascular effects of different laboratory stressors and their relationship with blood pressure variability. J. Hypertens. 1988 Jun. 6(6). 481-8. doi: 10.1097/00004872-198806000-00008. PMID: 3411126.
- Parati G., Pomidossi G., Ramirez A., Cesana B., Mancia G. Variability of the haemodynamic responses to laboratory tests employed in assessment of neural cardiovascular regulation in man. Clin. Sci (Lond). 1985 Nov. 69(5). 533-40. doi: 10.1042/cs0690533. PMID: 4053509.
- Parati G., Trazzi S., Ravogli A., Casadei R., Omboni S., Mancia G. Methodological problems in evaluation of cardiovascular effects of stress in humans. Hypertension. 1991 Apr. 17 (4 Suppl.). III50-5. doi: 10.1161/01.hyp.17.4_suppl.iii50. PMID: 2013493.
- Perini C., Müller F.B., Rauchfleisch U., Battegay R., Bühler F.R. Hyperadrenergic borderline hypertension is characterized by suppressed aggression. J. Cardiovasc. Pharmacol. 1986. 8 Suppl. 5. S53-6. doi: 10.1097/00005344-198608005-00011. PMID: 2427886.
- Pickering T.G., Devereux R.B., James G.D., Gerin W., Landsbergis P., Schnall P.L., Schwartz J.E. Environmental influences on blood pressure and the role of job strain. J. Hypertens. Suppl. 1996 Dec. 14(5). S179-85. PMID: 9120676.
- Pickering T.G. Mental stress as a causal factor in the development of hypertension and cardiovascular disease. Curr. Hypertens. Rep. 2001 Jun. 3(3). 249-54. doi: 10.1007/s11906-001-0047-1. PMID: 11353576.
- Pickering T.G. Does psychological stress contribute to the development of hypertension and coronary heart disease? Eur. J. Clin. Pharmacol. 1990. 39 Suppl 1. S1-7. PMID: 2261940.
- Pierdomenico S.D., Cuccurullo F. Prognostic value of white-coat and masked hypertension diagnosed by ambulatory monitoring in initially untreated subjects: an updated meta analysis. Am. J. Hypertens. 2011 Jan. 24(1). 52-8. doi: 10.1038/ajh.2010.203. Epub 2010 Sep 16. PMID: 20847724.
- Poulter N.R., Khaw K.T., Hopwood B.E., Mugambi M., Peart W.S., Rose G., Sever P.S. The Kenyan Luo migration study: observations on the initiation of a rise in blood pressure. BMJ. 1990 Apr 14. 300(6730). 967-72. doi: 10.1136/bmj.300.6730.967. PMID: 2344502. PMCID: PMC1662695.
- Rettig R., Folberth C., Stauss H., Kopf D., Waldherr R., Unger T. Role of the kidney in primary hypertension: a renal transplantation study in rats. Am. J. Physiol. 1990 Mar. 258 (3 Pt 2). F606-11. doi: 10.1152/ajprenal.1990.258.3.F606. PMID: 2138422.
- Rumantir M.S., Jennings G.L., Lambert G.W., Kaye D.M., Seals D.R., Esler M.D. The ‘adrenaline hypothesis’ of hypertension revisited: evidence for adrenaline release from the heart of patients with essential hypertension. J. Hypertens. 2000 Jun. 18(6). 717-23. doi: 10.1097/00004872-200018060-00009. PMID: 10872556.
- Saito K., Kim J.I., Maekawa K., Ikeda Y., Yokoyama M. The great Hanshin-Awaji earthquake aggravates blood pressure control in treated hypertensive patients. Am. J. Hypertens. 1997 Feb. 10(2). 217-21. doi: 10.1016/s0895-7061(96)00351-2. PMID: 9037331.
- Schnall P.L., Landsbergis P.A., Baker D. Job strain and cardiovascular disease. Annu Rev. Public Health. 1994. 15. 381-411. doi: 10.1146/annurev.pu.15.050194.002121. PMID: 8054091.
- Sega R., Trocino G., Lanzarotti A., Carugo S., Cesana G., Schiavina R., Valagussa F. et al. Alterations of cardiac structure in patients with isolated office, ambulatory, or home hypertension: Data from the general population (Pressione Arteriose Monitorate E Loro Associazioni [PAMELA] Study). Circulation. 2001 Sep 18. 104(12). 1385-92. doi: 10.1161/hc3701.096100. PMID: 11560854.
- Grassi G., Quarti-Trevano F., Dell’oro R., Cuspidi C., Mancia G. The PAMELA research project: a 25-year long journey. Panminerva Med. 2021 Dec. 63(4). 430-435. doi: 10.23736/S0031-0808.21.04396-2. Epub 2021 Apr 20. PMID: 33878850.
- Staessen J.A., O’Brien E.T., Amery A.K., Atkins N., Baumgart P., De Cort P., Degaute J.P. et al. Ambulatory blood pressure in normotensive and hypertensive subjects: results from an international database. J. Hypertens. Suppl. 1994. 12(7). S1-12. PMID: 7769499.
- Steenland K., Fine L., Belkić K., Landsbergis P., Schnall P., Baker D., Theorell T. et al. Research findings linking workplace factors to CVD outcomes. Occup. Med. 2000 Jan-Mar. 15(1). 7-68. PMID: 10620786.
- Steptoe A., Willemsen G. The influence of low job control on ambulatory blood pressure and perceived stress over the working day in men and women from the Whitehall II cohort. J. Hypertens. 2004 May. 22(5). 915-20. doi: 10.1097/00004872-200405000-00012. PMID: 15097230.
- Timio M., Verdecchia P., Venanzi S., Gentili S., Ronconi M., Francucci B., Montanari M., Bichisao E. Age and blood pressure changes. A 20-year follow-up study in nuns in a secluded order. Hypertension. 1988 Oct. 12(4). 457-61. doi: 10.1161/01.hyp.12.4.457. PMID: 3169953.
- Wilkinson D.J., Thompson J.M., Lambert G.W., Jennings G.L., Schwarz R.G., Jefferys D., Turner A.G., Esler M.D. Sympathetic activity in patients with panic disorder at rest, under laboratory mental stress, and during panic attacks. Arch. Gen. Psychiatry. 1998 Jun. 55(6). 511-20. doi: 10.1001/archpsyc.55.6.511. PMID: 9633669.
- Williams R.B., Marchuk D.A., Gadde K.M., Barefoot J.C., Grichnik K., Helms M.J., Kuhn C.M. et al. Central nervous system serotonin function and cardiovascular responses to stress. Psychosom. Med. 2001 Mar-Apr. 63(2). 300-5. doi: 10.1097/00006842-200103000-00016. PMID: 11292279.
- Wyss J.M., Carlson S.H. The role of the nervous system in hypertension. Curr. Hypertens Rep. 2001 Jun. 3(3). 255-62. doi: 10.1007/s11906-001-0048-0. PMID: 11353577.
- Yamada Y., Miyajima E., Tochikubo O., Matsukawa T., Ishii M. Age-related changes in muscle sympathetic nerve activity in essential hypertension. Hypertension. 1989 Jun. 13 (6 Pt 2). 870-7. doi: 10.1161/01.hyp.13.6.870. PMID: 2737724.
- Dalmazo A.L., Fetter C., Goldmeier S., Irigoyen M.C., Pellanda L.C., Barbosa E.C.D., Moreira T.R., Osório D.R.D. Stress and Food Consumption Relationship in Hypertensive Patients. Arq. Bras. Cardiol. 2019 Sep 2. 113(3). 374-380. doi: 10.5935/abc.20190175. PMID: 31482989; PMCID: PMC6882396.
- Schmieder R.E., Grassi G., Kjeldsen S.E. Patients with treatment-resistant hypertension report increased stress and anxiety: a worldwide study. J. Hypertens. 2013 Mar. 31(3). 610-5. discussion 615. doi: 10.1097/HJH.0b013e32835d6e53. PMID: 23303395.
- Freeman Z.S. Stress and hypertension — a critical review. Med. J. Aust. 1990 Nov 19. 153(10). 621-5. doi: 10.5694/j.1326-5377.1990.tb126276.x. PMID: 2233437.
- Doumas M., Imprialos K.P., Kallistratos M.S., Manolis A.J. Recent advances in understanding and managing resistant/refractory hypertension. F1000Res. 2020 Mar 9. 9. F1000 Faculty Rev-169. doi: 10.12688/f1000research.21669.1. PMID: 32201574; PMCID: PMC7065661.
- Redina O.E., Markel A.L. Stress, Genes, and Hypertension. Contribution of the ISIAH Rat Strain Study. Curr. Hypertens. Rep. 2018 Jun 16. 20(8). 66. doi: 10.1007/s11906-018-0870-2. PMID: 29909475.
- Kaplan N.M. Stress, the sympathetic nervous system and hypertension. J. Human Stress. 1978 Sep. 4(3). 29-34. doi: 10.1080/0097840X.1978.9934993. PMID: 690419.
- Hassoun L., Herrmann-Lingen C., Hapke U., Neuhauser H, Scheidt-Nave C., Meyer T. Association between chronic stress and blood pressure: findings from the German Health Interview and Examination Survey for Adults 2008-2011. Psychosom. Med. 2015. 77(5). 575-82. https://doi.org/10.1097/PSY.0000000000000183.
- Mancia G. White-coat hypertension: growing evidence in favour of its adverse prognostic significance. J. Hypertens. 2017. 35(4). 710-2. https://doi.org/10.1097/HJH.0000000000001289.
- Liu M.Y., Li N., Li W.A., Khan H. Association between psychosocial stress and hypertension: a systematic review and meta-analysis. Neurol. Res. 2017. 39(6). 573–580. https://doi.org/10.1080/01616412.2017.1317904.
- Huang Y., Huang W., Mai W., Cai X., An D., Liu Z., Huang H., Zeng J., Hu Y., Xu D. White-coat hypertension is a risk factor for cardiovascular diseases and total mortality. J. Hypertens. 2017 Apr. 35(4). 677-688. doi: 10.1097/HJH.0000000000001226. PMID: 28253216; PMCID: PMC5338886.
- Matthews K.A., Katholi C.R., McCreath H., Whooley M.A., Williams D.R., Zhu S., Markovitz J.H. Blood pressure reactivity to psychological stress predicts hypertension in the CARDIA study. Circulation. 2004 Jul 6. 110(1). 74-8. doi: 10.1161/01.CIR.0000133415.37578.E4. Epub 2004 Jun 21. PMID: 15210592.
- Cohen B.E., Edmondson D., Kronish I.M. State of the Art Review: Depression, Stress, Anxiety, and Cardiovascular Disease. Am. J. Hypertens. 2015 Nov. 28(11). 1295-302. doi: 10.1093/ajh/hpv047. Epub 2015 Apr 24. PMID: 25911639; PMCID: PMC4612342.
- Yan L.L., Liu K., Matthews K.A., Daviglus M.L., Ferguson T.F., Kiefe C.I. Psychosocial factors and risk of hypertension: the Coronary Artery Risk Development in Young Adults (CARDIA) study. JAMA. 2003 Oct 22. 290(16). 2138-48. doi: 10.1001/jama.290.16.2138. PMID: 14570949.
- Hildrum B., Mykletun A., Holmen J., Dahl A.A. Effect of anxiety and depression on blood pressure: 11-year longitudinal population study. Br. J. Psychiatry. 2008 Aug. 193(2). 108-13. doi: 10.1192/bjp.bp.107.045013. PMID: 18669991.
- Delaney J.A., Oddson B.E., Kramer H., Shea S., Psaty B.M., McClelland R.L. Baseline depressive symptoms are not associated with clinically important levels of incident hypertension during two years of follow-up: the multi-ethnic study of atherosclerosis. Hypertension. 2010 Feb. 55(2). 408-14. doi: 10.1161/HYPERTENSIONAHA.109.139824. Epub 2010 Jan 11. PMID: 20065156; PMCID: PMC2821214.
- Fredrikson M., Matthews K.A. Cardiovascular responses to behavioral stress and hypertension: a meta-analytic review. Ann. Behav. Med. 1990. 12(1). 30-9. https://doi.org/10.1207/s15324796abm1201_3.
- Abolbashari M. White Coat Hypertension and Cardiovascular Diseases: Innocent or Guilty. Curr. Cardiol. Rep. 2018 Mar 8. 20(4). 25. doi: 10.1007/s11886-018-0964-0. PMID: 29520630.
- Markel A.L., Redina O.E., Gilinsky M.A., Dymshits G.M., Kalashnikova E.V., Khvorostova Y.V. et al. Neuroendocrine profiling in inherited stress-induced arterial hypertension rat strain with stress-sensitive arterial hypertension. J Endocrinol. 2007 Dec. 195(3). 439-50. doi: 10.1677/JOE-07-0254. PMID: 18000306.
- Mancia G., Fagard R., Narkiewicz K., Redon J., Zanchetti A., Böhm M., Christiaens T. et al. 2013 ESH/ESC guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur. Heart J. 2013 Jul. 34(28). 2159-219. doi: 10.1093/eurheartj/eht151.
- de Boer I.H., Heerspink H.J.L., Hurst C., Khunti K., Liew A., Michos E.D., Navaneethan S.D. et al. Executive summary of the 2020 KDIGO Diabetes Management in CKD Guideline: evidence-based advances in monitoring and treatment. Kidney Int. 2020 Oct. 98(4). 839-848. doi: 10.1016/j.kint.2020.06.024.
- Graham I.M., Daly L.E., Refsum H.M., Robinson K., Brattström L.E., Ueland P.M., Palma-Reis R.J. et al. Plasma homo cysteine as a risk factor for vascular disease. The European Concerted Action Project. JAMA. 1997. 277(22). 1775-1781. https:// doi.org/10.1001/jama.1997.03540460039030.
- Zhou F., Hou D., Wang Y., Yu D. Evaluation of H-type hypertension prevalence and its influence on the risk of increased carotid intima-media thickness among a high-risk stroke population in Hainan Province, China. Medicine. 2020. 99(35). e21953. https://doi.org/10.1097/ md.0000000000021953.
- Sirenko Yu., Rekovets O., Torbas O. Predictors of Resistance Hypertension and Achievement of Target Blood Pressure Levels in Patients with Resistant Hypertension. IntechOpen 2018 DOI: http://dx.doi.org/10.5772/intechopen.88126.

/14.jpg)
/18_2.jpg)