Международный эндокринологический журнал Том 18, №5, 2022
Вернуться к номеру
Позитивний ефект вітаміну D на зниження маси тіла у пацієнтів з ожирінням на тлі лікування глюкагоноподібним пептидом 1 та модифікації способу життя
Авторы: Горобейко М.Б. (1), Здорна В.В. (2, 3), Дінець А.В. (1, 3)
(1) — Інститут біології та медицини, Київський національний університет імені Тараса Шевченка, м. Київ, Україна
(2) — Медичний центр «Андроцентр», м. Київ, Україна
(3) — Лабораторія апітерапії, Національний науковий центр «Інститут бджільництва імені П.І. Прокоповича», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
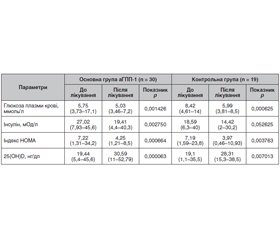
Актуальність. Ожиріння, предіабет та цукровий діабет 2-го типу (ЦД2) є глобальними хворобами, якими також уражено населення України, з щорічним зростанням захворюваності. Інсулінорезистентність виникає майже у 90 % пацієнтів з ожирінням, сприяє накопиченню білої жирової тканини та має ризики щодо подальшого розвитку предіабету та ЦД2. Проте інші чинники також відіграють негативну роль у плані розвитку ожиріння, зокрема це дефіцит холекальциферолу (вітаміну D). Вітамін D — стероїдний гормон, основна функція якого полягає в регуляції кальцієво-фосфорного метаболізму, проте ця молекула також демонструє різні властивості, зокрема вплив на вуглеводний обмін. Мета дослідження: визначити та оцінити роль підвищення рівня вітаміну D у пацієнтів, які отримували терапію агоністами глюкагоноподібного пептиду 1 (аГПП-1) у комбінації з дозованим фізичним навантаженням для лікування ожиріння, та порівняти ефективність такої комбінації з пацієнтами, у яких у програмі заходів з лікування ожиріння застосовувались метформін та інгібітори натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2). Матеріали та методи. У проспективне дослідження були залучені 155 пацієнтів з ожирінням, серед яких дані спостереження були доступні у 49 пацієнтів. Основну групу становили 30 пацієнтів, які отримували в комплексній терапії аГПП-1 ліраглутид (основна група аГПП-1) у дозах від 1,2 до 3 мг на добу. Контрольна група становила 19 пацієнтів і отримувала комплексну терапію із застосуванням метформіну в щоденних дозах від 500 до 2000 мг, іНЗКТГ2 у щоденних дозах від 10 до 12,5 мг. Лікування дефіциту вітаміну D проводилось холекальциферолом у дозі 4000 МО/добу. Результати. В основній групі аГПП-1 маса тіла до лікування була в середньому 104,6 кг, після лікування — 96,36 кг (р = 0,000007); у середньому пацієнти втратили 7,8 % (діапазон 1–23,71 %) від початкової маси тіла. ІМТ до лікування в середньому становив 37,1 кг/м2, після лікування — 34,11 кг/м2 (р = 0,000006). У контрольній групі маса тіла до лікування становила в середньому 99,4 кг, після лікування — 91,74 кг (р = 0,000196); у середньому пацієнти втратили 7,73 % (діапазон 0–16,9 %) від початкової маси тіла. ІМТ до лікування в середньому становив 35,6 кг/м2, після лікування — 34,11 кг/м2 (р = 0,000196). Аналіз параметрів вуглеводного обміну показав вірогідно нижчий рівень глюкози крові — 5,75 ммоль/л в основній групі аГПП-1 порівняно з 8,42 ммоль/л у контрольній (p = 0,00024). Слід зазначити, що аналогічна клінічна картина також спостерігалась після лікування, незважаючи на компенсацію ЦД2 у всіх пацієнтів: вірогідно нижчий рівень глюкози крові — 5,03 ммоль/л в основній групі аГПП-1 порівняно з 5,99 ммоль/л у пацієнтів контрольної групи (p = 0,002453). Проте вірогідно вищі рівні інсуліну спостерігалися в основній групі аГПП-1 до лікування — 27,02 мОд/л порівняно з 18,59 мОд/л у пацієнтів контрольної групи (p = 0,003286). Після лікування спостерігалась аналогічна ситуація щодо вірогідно вищих рівнів інсуліну: 19,41 мОд/л у пацієнтів основної групи аГПП-1 порівняно з 14,42 мОд/л у пацієнтів контрольної групи (р = 0,0024). Відповідні зміни також спостерігались щодо показників індексу НОМА. Висновки. Отримані результати свідчать про високу ефективність підвищення рівня вітаміну D у разі його недостатності у пацієнтів у комплексі заходів з лікування ожиріння ліраглутидом, метформіном або іНЗКТГ-2.
Background. Obesity, prediabetes and type 2 diabetes mellitus (T2DM) are global diseases affecting the population of Ukraine, with an annual increase in morbidity. Insulin resistance occurs in up to 90 % of obese patients, contributing to the accumulation of white adipose tissue, and has a risk for the further development of prediabetes and T2DM. However, other factors also play a negative role in the development of obesity, particularly cholecalciferol (vitamin D) deficiency. Vitamin D is a steroid hormone the main function of which is to regulate calcium and phosphorus metabolism, but this molecule also exhibits various properties, including the effects on carbohydrate metabolism. The purpose of this study was to identify and evaluate the role of vitamin D elevation in patients receiving glucagon-like peptide-1 agonists (GLP-1a) in combination with lifestyle interventions for the treatment of obesity and to compare its effectiveness with that in patients treating with metformin and sodium-glucose cotransporter 2 inhibitors (SGLT2i). Materials and methods. A prospective study included 155 obese patients, and follow-up data were available for 49 of them. The study group consisted of 30 patients receiving combination therapy with GLP-1a liraglutide at a dose of 1.2 to 3.0 mg per day. The control group included 19 patients receiving combination therapy with metformin in daily doses of 500 to 2,000 mg, and SGLT2i in daily doses of 10 to 12.5 mg. Treatment of vitamin D deficiency was performed with cholecalciferol at a dose of 4,000 IU/day. Results. In study group GLP-1a, 25 (83.3 %) patients had vitamin D insufficiency, which is statistically similar to control group (p > 0.05) — 17 (89.5 %) cases. All patients with vitamin D insufficiency received 4,000 IU of cholecalciferol daily during the follow-up period. In study group GLP-1a, the mean body mass before the treatment was 104.6 kg, after treatment — 96.36 kg (p = 0.000007), the mean weight lost was 7.8 % (range is 1–23.71 %) of the initial level. Mean body mass index (BMI) before treatment was 37.1 kg/m2, after treatment — 34.11 kg/m2 (p = 0.000006). In the control group, the mean weight before the treatment was 99.4 kg, after treatment — 91.74 kg (p = 0.000196), the mean weight lost was 7.73 % (range is 0–16.9 %) of the initial level. BMI before treatment averaged 35.6 kg/m2, after treatment — 34.11 kg/m2 (p = 0.000196). The analysis of carbohydrate metabolism parameters showed a significantly lower blood glucose level — 5.75 mmol/l in the study group GLP-1a compared to 8.42 mmol/l in the control group (p = 0.00024). It should be noted that a similar clinical picture was also observed after treatment, despite the compensation of T2DM in all patients: a significantly lower blood glucose level — 5.03 mmol/l in the study group GLP-1a compared to 5.99 mmol/l in controls (p = 0.002453). However, significantly higher levels of insulin were detected in the study group GLP-1a before treatment — 27.02 mU/L compared to 18.59 mU/L in control patients (p = 0.003286). After treatment, a similar situation was observed in terms of significantly higher levels of insulin: 19.41 mU/l in patients of the study group GLP-1a compared to 14.42 mU/l in controls (p = 0.0024). Corresponding changes were also observed for the HOMA index. Conclusions. Our results suggest high effectiveness of increasing the level of vitamin D in case of its insufficiency as a part of measures for the treatment of obese patients with liraglutide, metformin or SGLT2i.
ожиріння, агоністи глюкагоноподібного пептиду 1, метформін, інгібітори натрійзалежного котранспортера глюкози 2-го типу, вітамін D
obesity; glucagon-like peptide-1 agonists; metformin; sodium-glucose cotransporter 2 inhibitors; vitamin D
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Chooi Y.C., Ding C., Magkos F. The epidemiology of obesity. Metabolism. 2019. 92: 6-10. doi: 10.1016/j.metabol.2018.09.005. PMID: 30253139.
- Organization W.H. STEPS prevalence of noncommunicable disease risk factors in Ukraine 2019. World Health Organization. Regional Office for Europe, 2020.
- Yumuk V., Tsigos C., Fried M., Schindler K., Busetto L., Micic D., et al. European Guidelines for Obesity Management in Adults. Obes. Facts. 2015. 8(6). 402-24. doi: 10.1159/000442721.
- ADA. Introduction: Standards of Medical Care in Diabetes-2022. Diabetes Care. 2022. 45(Suppl 1). S1-S2. doi: 10.2337/dc22-Sint.
- Dereń K., Nyankovskyy S., Nyankovska O., Łuszczki E., Wyszyńska J., Sobolewski M., Mazur A. The prevalence of underweight, overweight and obesity in children and adolescents from Ukraine. Sci Rep. 2018. 8(1). 3625. doi: 10.1038/s41598-018-21773-4.
- Yakovenko V., Henn L., Bettendorf M., Zelinska N., Soloviova G., Hoffmann G.F., Grulich-Henn J. Risk Factors for Childhood Overweight and Obesity in Ukraine and Germany. J. Clin. Res. Pediatr. Endocrinol. 2019. 11(3). 247-252. doi: 10.4274/jcrpe.galenos.2019.2018.0157.
- Dinets A., Gorobeiko M., Zdorna V., Hoperia V., Lovin A. An integrated approach for obesity management: the effectiveness of glucagon-like peptide 1 agonist and life-style interventions for obesity management. International Journal of Endocrinology (Ukraine). 2022. 18(3). 145-152. https://doi.org/10.22141/2224-0721.18.3.2022.1161.
- Gün E., Uzun H., Bolu S., Arslanoğlu İ., Kocabay K. Serum 25-hydroxyvitamin D is associated with insulin resistance independently of obesity in children ages 5–17. Prim. Care Diabetes. 2020. 14(6). 741-6. doi: 10.1016/j.pcd.2020.06.006.
- Nur-Eke R., Özen M., Çekin A.H. Pre-Diabetics with Hypovitaminosis D Have Higher Risk for Insulin Resistance. Clin. Lab. 2019. 65(5). doi: 10.7754/Clin.Lab.2018.181014.
- Tkach S., Pankiv V., Pankiv I. Modern views on the metabolism and biological effects of vitamin D. International Journal of Endocrinology (Ukraine). 2022. 18(2). 109-17. https://doi.org/10.22141/2224-0721.18.2.2022.1156.
- Szymczak-Pajor I., Śliwińska A. Analysis of Association between Vitamin D Deficiency and Insulin Resistance. Nutrients. 2019. 11(4). 794. doi: 10.3390/nu11040794.
- Dinets A., Nykytiuk O., Gorobeiko M., Barabanchyk O., Khrol N. Milestones and pitfalls in strategic planning of healthcare in capital city in transition. Georgian Med. News. 2021(315). 189-95. PMID: 34365449.
- Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., Gordon C.M., Hanley D.A., Heaney R.P., Murad M.H., Weaver C.M. Guidelines for preventing and treating vitamin D deficiency and insufficiency revisited. J. Clin. Endocrinol. Metab. 2012. 97(4). 1153-8. doi: 10.1210/jc.2011-2601.
- Tsymbaliuk I., Unukovych D., Shvets N., Dinets A. Cardiovascular complications secondary to Graves’ disease: a prospective study from Ukraine. PLoS One. 2015. 10(3). e0122388. doi: 10.1371/journal.pone.0122388.
- Aludwan M., Kobyliak N., Abenavoli L., Kyriienko D., Fagoonee S., Pellicano R., Komisarenko I. Vitamin D3 deficiency is associated with more severe insulin resistance and metformin use in patients with type 2 diabetes. Minerva Endocrinol. 2020. 45(3). 172-180. doi: 10.23736/S0391-1977.20.03161-2.
- Xu Z., Gong R., Luo G., Wang M., Li D., Chen Y., Shen X., Wei X., Feng N., Wang S. Association between vitamin D3 levels and insulin resistance: a large sample cross-sectional study. Sci Rep. 2022. 12(1). 119. doi: 10.1038/s41598-021-04109-7.
- Karampela I., Sakelliou A., Vallianou N., Christodoulatos G.S., Magkos F., Dalamaga M. Vitamin D and Obesity: Current Evidence and Controversies. Curr. Obes. Rep. 2021. 10(2). 162-180. doi: 10.1007/s13679-021-00433-1.
- Pourshahidi L.K. Vitamin D and obesity: current perspectives and future directions. Proc. Nutr. Soc. 2015. 74(2). 115-24. doi: 10.1017/S0029665114001578.
- Pankiv I.V. The impact of vitamin D status and supplementation on thyroid autoimmunity. International Journal of Endocrinology (Ukraine). 2020. 16(8). 105-109. DOI: 10.22141/2224-0721.16.8.2020.222889.
- Lotfi-Dizaji L., Mahboob S., Aliashrafi S., Vaghef-Mehrabany E., Ebrahimi-Mameghani M., Morovati A. Effect of vitamin D supplementation along with weight loss diet on meta-inflammation and fat mass in obese subjects with vitamin D deficiency: A double-blind placebo-controlled randomized clinical trial. Clin. Endocrinol. (Oxf.). 2019. 90(1). 94-101. doi: 10.1111/cen.13861.
- Bouillon R., Marcocci C., Carmeliet G., Bikle D., White J.H., Dawson-Hughes B., et al. Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions. Endocr. Rev. 2019. 40(4). 1109-51. doi: 10.1210/er.2018-00126.
- Mason C., Xiao L., Imayama I., Duggan C.R., Bain C., Foster-Schubert K.E., et al. Effects of weight loss on serum vitamin D in postmenopausal women. Am. J. Clin. Nutr. 2011. 94(1). 95-103. doi: 10.3945/ajcn.111.015552.
- Drincic A.T., Armas L.A., Van Diest E.E., Heaney R.P. Voumetric dilution, rather than sequestration best explains the low vitamin D status of obesity. Obesity (Silver Spring). 2012. 20(7). 1444-8. doi: 10.1038/oby.2011.404.
- Bolland M.J., Chiu W.W., Davidson J.S., Grey A., Bacon C., Gamble G.D., et al. The effects of seasonal variation of 25-hydroxyvitamin D on diagnosis of vitamin D insufficiency. N. Z. Med. J. 2008. 121(1286). 63-74. PMID: 19098949.
- Wamberg L., Christiansen T., Paulsen S.K., Fisker S., Rask P., Rejnmark L., et al. Expression of vitamin D-metabolizing enzymes in human adipose tissue — the effect of obesity and diet-induced weight loss. Int. J. Obes. (Lond.). 2013. 37(5). 651-7. doi: 10.1038/ijo.2012.112.
- Bassatne A., Chakhtoura M., Saad R., Fuleihan G.E. Vitamin D supplementation in obesity and during weight loss: A review of randomized controlled trials. Metabolism. 2019. 92. 193-205. doi: 10.1016/j.metabol.2018.12.010.
- Pramono A., Jocken J.W.E., Blaak E.E. Vitamin D deficiency in the aetiology of obesity-related insulin resistance. Diabetes Metab. Res. Rev. 2019. 35(5). e3146. doi: 10.1002/dmrr.3146.
- Contreras-Bolívar V., García-Fontana B., García-Fontana C., Muñoz-Torres M. Mechanisms Involved in the Relationship between Vitamin D and Insulin Resistance: Impact on Clinical Practice. Nutrients. 2021. 13(10). doi: 10.3390/nu13103491.
- Morisset A.S., Tardio V., Weisnagel J., Lemieux S., Bergeron J., Gagnon C. Associations Between Serum 25-Hydroxyvitamin D, Insulin Sensitivity, Insulin Secretion, and β-Cell Function According to Glucose Tolerance Status. Metab. Syndr. Relat. Disord. 2015. 13(5). 208-13. doi: 10.1089/met.2014.0159.
- LeBlanc E.S., Rizzo J.Н., Pedula K.L., Ensrud K.Е., Cauley J., Hochberg M. et al. Associations between 25-hydroxyvitamin D and weight gain in elderly women. J. Womens Health (Larchmt). 2012. 21(10). 1066-73. doi: 10.1089/jwh.2012.3506.
- Rafiq S., Jeppesen P.B. Insulin Resistance Is Inversely Associated with the Status of Vitamin D in Both Diabetic and Non-Diabetic Populations. Nutrients. 2021. 13(6). doi: 10.3390/nu13061742.

/41.jpg)