Журнал «Здоровье ребенка» Том 17, №3, 2022
Вернуться к номеру
Фактори ризику розвитку ретинопатії у недоношених дітей
Авторы: Оболонська О.Ю. (1), Вакуленко Л.І. (1), Бадогіна Л.П. (1), Оболонський О.І. (2), Ліхачова І.А. (2), Коврига О.В. (1)
(1) — Дніпровський державний медичний університет, м. Дніпро, Україна
(2) — КП «Дніпропетровська обласна дитяча клінічна лікарня» ДОР», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
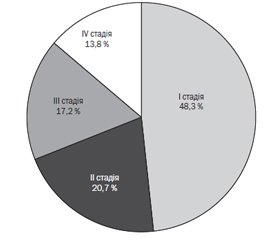
Актуальність. Ретинопатія недоношених є одним із станів, що спричиняють інвалідність у передчасно народжених дітей. Потребують подальшого вивчення фактори, які потенційно можуть спричинити ретинопатію недоношених. Мета дослідження: визначення факторів ризику розвитку ретинопатії у недоношених новонароджених для кращого її контролю. Матеріали та методи. Проведений ретроспективний аналіз 50 медичних карт стаціонарного хворого недоношених дітей зі строком гестації при народженні 28–34 тижні та медичної документації їхніх матерів. Виділено 2 групи: група І — 29 дітей з ретинопатією, ІІ група — 21 дитина без ретинопатії. Результати. Серед 50 дітей переважна більшість — 38 (76,0 %) народились у гестаційному віці 28–31 тиждень, без вірогідної відмінності у групах. З І стадією ретинопатії було 14 (48,3 %) недоношених, з ІІ стадією — 6 (20,7 %), з ІІІ — 5 (17,2 %), з IV — 4 (13,8 %). Були виявлені найбільш впливові фактори ризику розвитку ретинопатії недоношених. Наявність ретинопатії статистично значуще корелювала зі строком гестації при народженні менше ніж 34 тижні (ρ = 0,64, р < 0,001), потребою в дотації кисню ≥ 40 % (ρ = 0,59, р < 0,001), розвитком бронхолегеневої дисплазії (ρ = 0,34, р < 0,01), сепсисом (ρ = 0,59, р < 0,001), внутрішньошлуночковими крововиливами (ρ = 0,56, р < 0,001). Визначено, що наявність обтяженого материнського анамнезу у вигляді хронічних вогнищ інфекції та хоріоамніоніту є вагомим фактором ризику розвитку ретинопатії (ρ = 0,56, р < 0,001). Наявність інфекції у матері у 3,8 раза (р < 0,05) збільшувала шанс розвитку ретинопатії ІІІ–ІV ст. у дитини та у 5 разів — ретинопатії І–ІІ стадії. При поєднанні хоріоамніоніту та хронічних вогнищ інфекції ризик розвитку тяжкої ретинопатії становив майже 95 % (р < 0,007). Висновки. Обтяжений материнський анамнез у вигляді хронічних вогнищ інфекції та/або хоріамніоніту є вагомим фактором ризику розвитку ретинопатії у дітей. Хоріоамніоніт є предиктором тяжкої ретинопатії. Лікування хронічних вогнищ інфекції у вагітних має розглядатися як обов’язковий захід профілактики ретинопатії у недоношених новонароджених.
Background. Retinopathy of prematurity is one of the disabling conditions in premature babies. Despite the fact that the main predictors for the development of retinopathy of prematurity are known, the factors that can potentially cause it require further study. The purpose was to determine risk factors for the development of retinopathy in premature newborns for better control. Materials and methods. A retrospective analysis of 50 medical records of inpatient premature babies with a gestational age of 28–34 weeks and the medical charts of their mothers was carried out. Two groups were distinguished: the first one — 29 children with retinopathy, the second one — 21 patient without retinopathy. Results. The vast majority of children — 38 (76.0 %) were born at a gestational age of 28–31 weeks. Differences between groups were not significant. The analysis showed that 14 (48.3 %) premature children were diagnosed with stage I retinopathy, 6 (20.7 %) — with stage II, 5 (17.2 %) — with stage ІІІ and 4 (13.8 %) — with stage IV. The most influential risk factors for the development of retinopathy of prematurity were identified. The presence of retinopathy significantly correlated with gestational age of less than 34 weeks (ρ = 0.64, p < 0.001), need for oxygen subsidy ≥ 40 % (ρ = 0.59, р < 0.001), development of bronchopulmonary dysplasia (ρ = 0.34, р < 0.01), sepsis (ρ = 0.59, р < 0.001), intraventricular hemorrhages (ρ = 0.56, р < 0.001). It was also found that the presence of a burdened maternal history in the form of chronic foci of infection and chorioamnionitis is a significant risk factor for the development of retinopathy (ρ = 0.56, р < 0.001). Moreover, the presence of an infection in the mother increased the risk of retinopathy stage III–IV in a child by 3.8 times (p < 0.05), and stage I–II retinopathy — by 5 times. With a combination of chorioamnionitis and chronic foci of infection, the risk of developing severe retinopathy was almost 95 % (р < 0.007). Conclusions. Burdened maternal history in the form of chronic foci of infection and/or choriamnionitis is an important risk factor for the development of retinopathy in children. Chorioamnionitis is a predictor of severe retinopathy. Treatment of chronic foci of infection in pregnant women should be considered as a mandatory measure to prevent retinopathy in premature newborns.
ретинопатія недоношених; фактори ризику; хронічні вогнища інфекції; хоріоамніоніт
retinopathy of prematurity; risk factors; chronic foci of infection; chorioamnionitis
Вступ
Матеріали та методи
Результати
/24.jpg)
/25.jpg)
Обговорення
Висновки
- Kim C.Y., Jung E., Kim E.N. et al. Chronic Placental Inflammation as a Risk Factor of Severe Retinopathy of Prematurity. J. Pathol. Transl. Med. 2018. 52(5). 290-297. doi: 10.4132/jptm.2018.07.09.
- Lyu Z., Mao J.B., Chen Y.Q., Zhu M.Q., Lian H.L., Wu M.Y. Association between postnatal weight gain and severe retinopathy of prematurity in preterm babies with very low birth weight. Chin. J. Ocul. Fundus Dis. 2016. 32. 172-6. doi: 10.3760/cma.j.issn.1005-1015.2016.02.014.
- Horbar J.D., Edwards E.M., Greenberg L.T. et al. Variation in Performance of Neonatal Intensive Care Units in the United States. JAMA Pediatr. 2017. 171(3). e164396. doi: 10.1001/jamapediatrics.2016.4396.
- Chang J.W. Risk factor analysis for the development and progression of retinopathy of prematurity. PLoS One. 2019. 14(7). e0219934. doi: 10.1371/journal.pone.0219934.
- Prakalapakorn S.G., Greenberg L., Edwards E.M., Ehret D.E.Y. Trends in Retinopathy of Prematurity Screening and Treatment: 2008–2018. Pediatrics. 2021. 147(6). e2020039966. doi: 10.1542/peds.2020-039966.
- Kim S.J., Port A.D., Swan R., Campbell J.P., Chan R.V.P., Chiang M.F. Retinopathy of prematurity: a review of risk factors and their clinical significance. Surv. Ophthalmol. 2018. 63(5). 618-637. doi: 10.1016/j.survophthal.2018.04.002.
- Rivera J.C., Holm M., Austeng D. et al. Retinopathy of prematurity: inflammation, choroidal degeneration, and novel promising therapeutic strategies. J. Neuroinflammation. 2017. 14(1). 165. doi: 10.1186/s12974-017-0943-1.
- Wallace D.K., Dean T.W., Hartnett M.E. et al. Pediatric Eye Disease Investigator Group. A Dosing Study of Bevacizumab for Retinopathy of Prematurity: Late Recurrences and Additional Treatments. Ophthalmology. 2018. 125(12). 1961-6. doi: 10.1016/j.ophtha.2018.05.001.
- Filippi L., Cammalleri M., Amato R. et al. Decoupling Oxygen Tension from Retinal Vascularization as a New Perspective for Management of Retinopathy of Prematurity. New Opportunities From β-adrenoceptors. Front. Pharmacol. 2022. 13. 835771. doi: 10.3389/fphar.2022.835771.
- Hanif M., Ariff S., Ansar A., Ahmed K., Hussain A.S. Characteristics оf Preterm with Sight Threatening Retinopathy оf Prematurity. J. Ayub Med. Coll. Abbottabad. 2020. 32(2). 174-178.
- Ratra D., Akhundova L., Das M.K. Retinopathy of prematurity like retinopathy in full-term infants. Oman J. Ophthalmol. 2017. 10. 167-72. doi: 10.4103/ojo.OJO_141_2016_2016.
- Cayabyab R., Ramanathan R. Retinopathy of Prematurity: Therapeutic Strategies Based on Pathophysiology. Neonatology. 2016. 109(4). 369-76. doi: 10.1159/000444901.
- Mao J.B., Yu X.T., Shen L.J. et al. Risk factors of retinopathy of prematurity in extremely low birth weight infants by strictly controlling oxygen inhalation after birth. Zhonghua Yan Ke Za Zhi. 2019. 55(4). 280-288. Chinese. doi: 10.3760/cma.j.issn.0412-4081.2019.04.010.
- Villamor-Martinez E., Cavallaro G., Raffaeli G. et al. Chorioamnionitis as a risk factor for retinopathy of prematurity: An updated systematic review and meta-analysis. PLoS One. 2018. 13(10). e0205838. doi: 10.1371/journal.pone.0205838.
- Jackson C.M., Wells C.B., Tabangin M.E., Meinzen-Derr J., Jobe A.H., Chougnet C.A. Pro-inflammatory immune responses in leukocytes of premature infants exposed to maternal chorioamnionitis or funisitis. Pediatr. Res. 2017. 81. 384-390. doi: 10.1038/pr.2016.232.
- Dammann O., Rivera J.C., Chemtob S. The prenatal phase of retinopathy of prematurity. Acta Paediatr. 2021. 110(9). 2521-2528. doi: 10.1111/apa.15945.
- Hansen E.D., Hartnett M.E. A review of treatment for retinopathy of prematurity. Expert Rev. Ophthalmol. 2019. 14(2). 73-87. DOI: 10.1080/17469899.2019.1596026.
- Borțea C.I., Stoica F., Boia M. et al. Risk Factors Associated with Retinopathy of Prematurity in Very and Extremely Preterm Infants. Medicina (Kaunas). 2021. 57(5). 420. doi: 10.3390/medicina57050420.
- Наказ МОЗ України від 21.09.2009 р. № 683 «Про затвердження Протоколу з лікування дітей з ретинопатією недоношених». Доступно: https://zakononline.com.ua/documents/show/38807_38807.
- Fujinaga H., Baker C.D., Ryan S.L. et al. Hyperoxia disrupts vascular endothelial growth factor-nitric oxide signaling and decreases growth of endothelial colony-forming cells from preterm infants. Am. J. Physiol Lung Cell Mol. Physiol. 2009. 297(6). L1160-9. doi: 10.1152/ajplung.00234.2009.
- Stark A., Dammann C., Nielsen H.C., Volpe M.V. A Pathogenic Relationship of Bronchopulmonary Dysplasia and Retinopathy of Prematurity? A Review of Angiogenic Mediators in Both Diseases. Frontiers in Рediatrics. 2018. 6. 125. https://doi.org/10.3389/fped.2018.00125.
- Sood B.G., Madan A., Saha S. et al. NICHD neonatal research network. Perinatal systemic inflammatory response syndrome and retinopathy of prematurity. Pediatr. Res. 2010. 67(4). 394-400. doi: 10.1203/PDR.0b013e3181d01a36.

/24_2.jpg)
/25_2.jpg)