Резюме
Актуальність. В сучасній ортопедії існує чимала кількість варіантів заміщення дефектів кісткової тканини. Увагу дослідників привертали кераміки з фосфатів кальцію. Дослідження показали, що кераміка на основі гідроксіапатиту (ГА) — Ca10(PO4)6(OH)2 та трикальційфосфату (ТКФ) — Ca3(PO4)2 має низку переваг перед іншими біоматеріалами. Проте не з’ясовано, яким саме чином армування вплине на швидкість утворення кісткової тканини в зоні імплантації та на її щільність. Мета: в експерименті на лабораторних тваринах дослідити в динаміці зміни щільності кісткової тканини в зоні дефекту, заповненого цементами на основі α′-TКФ. Матеріали та методи. Проведено рентгенометричне дослідження оптичної щільності кісткової тканини лабораторних щурів після заміщення кісткових дефектів цементами на основі ТКФ. Досліджували зміну оптичної щільності кісткової тканини щурів, яким було зроблено заміщення штучно утвореного дефекту метаепіфізарної зони стегнової кістки α-ТКФ (5 тварин) та α-ТКФ, армованим голчастими кристалами ГА (5 тварин). Щурам в терміни 1, 2 та 3 місяці виконувалася цифрова рентгенографія оперованої та інтакт-ної зон. Було виміряно оптичну щільність кортикального шару кістки в зоні імплантації оперованої кістки та кортикального шару інтактної стегнової кістки метаепіфізарної зони на тому ж рівні. Результати. Визначено, що оптична щільність інтактної кістки у тварин в обох групах упродовж експерименту поступово збільшувалася. Різниці в значенні оптичної щільності інтактних кісток не виявлено (р >> 0,05). Незважаючи на те, що на первинному етапі матеріал заміщення на основі α-ТКФ + ГА має більшу оптичну щільність, у подальшому він деградує і заміщується кістковою тканиною, оптична щільність якої наближається до рівня інтактної кістки. Проведені дослідження показали, що через 1 місяць після заповнення кісткового дефекту більша щільність тканини в зоні дефекту спостерігається у випадку його заповнення кістковим цементом на основі α-ТКФ + ГА, що, скоріше за все, обумовлено більш високою щільністю самого матеріалу порівняно з цементом, у складі якого тільки α-ТКФ. На 2-му місяці після заповнення дефекту спостерігається вирівнювання щільності кісткової тканини в зоні дефекту з щільністю неушкодженої кістки, що дозволяє припустити, що процес заміщення штучно утвореного дефекту метаепіфізарної зони кістковою тканиною відбувся. Висновки. Оптична щільність інтактної кістки у тварин в обох групах упродовж експерименту поступово збільшувалася від 90 ± 8 од. до 98 ± 7 од. в групі з Ca3PO4 + α-ТКФ та від 89 ± 5 од. до 100 ± 12 од. в групі з Ca3PO4 + α-ТКФ + ГА, але статистично значущої різниці щодо оптичної щільності інтактних кісток не виявлено (р >> 0,05). Через 1 місяць після заміщення дефекту Ca3PO4 + α-ТКФ + ГА відмічали статистично значуще (р = 0,017) більшу оптичну щільність оперованої кістки (113 ± 6 од.), ніж при заміщенні Ca3PO4 + α-ТКФ (101 ± 8 од.). Через 2 місяці після початку експерименту оптична щільність інтактних і оперованих кісток на рівні зони заміщення дефекту в обох групах була статистично однаковою, що підтвердилося й через 3 місяці. Це може свідчити про заміщення запов-нювача кістковою тканиною.
Background. In modern orthopedics, there are many options for replacing bone defects. The attention of researchers was drawn to calcium phosphate ceramics. Studies have shown that hydroxyapatite (HA) — Ca10(PO4)6(OH)2 and tricalcium phosphate (TCP) — Ca3(PO4)2 ceramics has a number of advantages over other biomaterials. However, it is not clear how reinforcement will affect the rate of bone formation in the implantation zone and its density. The purpose was to study the dynamics of changes in bone density in the area of a defect filled with α-TCP cements in an experiment on laboratory animals. Materials and methods. X-ray study of the optical density of the bone tissue of laboratory rats after replacing bone defects with TCP cements was carried out. Changes in the optical density of the bone tissue of rats who underwent the replacement of an artificially formed defect in the metaepiphyseal zone of the femur with α-TCP (5 animals) and α-TCP reinforced with needle-like HA crystals (5 animals) were studied. Rats underwent digital radiography of the operated and intact bones in 1, 2, and 3 months. The optical density of the cortical bone was measured in the area of implantation of the operated bone and the cortical layer of the intact femur of the metaepiphyseal zone at the same level. Results. It was found that the optical density of intact bone in animals in both groups gradually increased during the experiment. Differences in the value of the optical density of intact bones were not found (p >> 0.05). Despite the fact that at the initial stage, the replacement material based on α-TCP + HA has a higher optical density, it subsequently degrades and is replaced by bone tissue the optical density of which approaches the level of intact bone. The studies conducted have shown that one month after the replacement of a bone defect, a higher tissue density in the defect zone is observed if it is filled with α-TCP + HA bone cement that is most likely due to a higher density of the material itself compared to cement containing only α-TCP. Two months after filling a defect, there is an alignment of the bone density in the defect zone with the density of intact bone, which suggests that the process of repla-cing the artificially formed defect in the metaepiphyseal zone with bone tissue has occurred. Conclusions. The optical density of intact bone in animals of both groups during the experiment gradually increased: from 90 ± 8 units to 98 ± 7 units in the group of Ca3PO4 + α-TCP and from 89 ± 5 units to 100 ± 12 units in the group of Ca3PO4 + α-TCP + HA, but there was no statistically significant difference in the value of the optical density of intact bones (p >> 0.05). One month after the replacement of a defect with Ca3PO4 + α-TCP + GA, a statistically significantly (p = 0.017) higher optical density of the operated bone (113 ± 6 units) was noted compared to the replacement with Ca3PO4 + + α-TCP (101 ± 8 units). Two months after the experiment was started, the optical density of intact and operated bones at the level of defect replacement was statistically equal in both groups, which was confirmed in 3 months as well. This may indicate the replacement of the filler with bone tissue.
Вступ
У сучасній ортопедії існує чимала кількість варіантів заміщення дефектів кісткової тканини, проте питання є досі актуальним та не до кінця вирішеним через низку недоліків існуючих зараз методик. Увагу дослідників та науковців кераміки з фосфатів кальцію привертали з 60-х років ХХ століття. Цей інтерес пов’язаний з їхньою хімічною подібністю із мінеральним компонентом людських кісток. Дослідження показали, що кераміка на основі гідроксіапатиту (ГА) — Ca10(PO4)6(OH)2 та трикальційфосфату (ТКФ) — Ca3(PO4)2 має низку переваг перед іншими біоматеріалами. Саме тому вищевказані матеріали отримали значне поширення в стоматології, ортопедії та щелепно-лицевій хірургії [5]. Зокрема, низка біокерамік вітчизняного виробництва пройшла випробовування у ДУ «Інститут патології хребта та суглобів ім. проф. М. І. Ситенка НАМН України», що дало змогу впровадити їх у клінічну практику [6–8].
Замісні матеріали на основі ТКФ зручні у використанні, проте мають відносно слабкі механічні властивості, що робить недоцільним використання їх у зонах навантаження кісткової тканини. Покращити ці характеристики можливо армуванням кальційфосфатного цементу (КФЦ). Найбільш відповідними для цього є голчасті монокристали ГА, що входять до складу кісткової емалі [9]. Проте, з огляду на низький потенціал біодеградації ГА, не з’ясовано, яким саме чином армування вплине на швидкість утворення кісткової тканини в зоні імплантації та на її щільність, тому дослідження такого матеріалу, як і неармованого КФЦ на основі α′-TКФ, в умовах in vivo залишається актуальним зав-данням.
Мета: в експерименті на лабораторних тваринах дослідити в динаміці зміни щільності кісткової тканини в зоні дефекту, заповненого цементами на основі α′-TКФ.
Матеріали та методи
У лабораторії біомеханіки ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України» проведено рентгенометричне дослідження оптичної щільності кісткової тканини лабораторних щурів після заміщення кісткових дефектів цементами на основі ТКФ. Дослідження проводили за допомогою програмного комплексу X-rays, розробленого в Харківському національному університеті радіоелектроніки [1, 2].
Досліджували зміну оптичної щільності кісткової тканини щурів, яким було зроблено заміщення штучно утвореного дефекту метаепіфізарної зони стегнової кістки α-ТКФ (5 тварин) та α-ТКФ, армованим голчастими кристалами ГА (5 тварин). Щурам в терміни 1, 2 та 3 місяці виконувалася цифрова рентгенографія оперованої та інтактної зон. Було виміряно оптичну щільність кортикального шару кістки в зоні імплантації оперованої кістки та кортикального шару інтактної стегнової кістки метаепіфізарної зони на тому ж рівні.
Отримані дані обробляли статистично, розраховуючи середнє значення (М) та його стандартне відхилення (SD), максимальне та мінімальне значення вибірок. Порівняння проводилося за допомогою Т-тесту для незалежних вибірок, аналіз зміни оптичної щільності проводився за допомогою алгоритму загальної лінійної моделі для повторних вимірювань. Для перевірки нульової гіпотези, що між змінами оптичної щільності різних кісток з різними матеріалами заміщення відмінностей не існує, використовували багатомірний тест Піллая [3]. Розрахунки проводили в програмі IBM SPSS Statistics 20.0 [4].
Результати та обговорення
За отриманими рентгенографічними даними кісток тварин оцінювалася оптична щільність кортикального шару кісткової тканини інтактної та оперованої кісток на 1, 2 та 3-му місяці експерименту. Результати дослідження щільності кісткової тканини в зоні дефекту через 1 міс. після його заповнення наведені в табл. 1.
За результатами аналізу було визначено, що оптична щільність інтактної кістки у тварин в обох групах упродовж експерименту поступово збільшувалася. Різниці в значенні оптичної щільності інтактних кісток не виявлено (р >> 0,05).
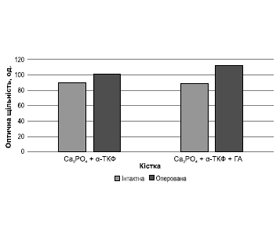
У перший місяць експерименту у тварин при заміщенні дефекту α-ТКФ, армованим голчастими кристалами ГА, відмічали статистично значуще (р = 0,017) більшу оптичну щільність оперованої кістки (113 ± 6 од.), ніж при заміщенні α-ТКФ (101 ± 8 од.). При цьому було визначено, що оптична щільність зони заміщення дефекту α-ТКФ, армованим голчастими кристалами ГА, була статистично (р = 0,002) більшою, ніж на інтактній кістці. Оптична щільність кісток із заміщенням кістковим цементом на основі α-ТКФ була близькою до аналогічної зони інтактної кістки (p = 0,089).
Наочне уявлення про співвідношення показників оптичної щільності кісткової тканини щурів у зоні дефекту через 1 міс. після його заповнення можна отримати за допомогою діаграми, яка наведена на рис. 1.
Результати дослідження щільності кісткової тканини в зоні дефекту через 2 міс. після його заповнення кістковими цементами наведені в табл. 2.
Через 2 місяці після проведення експериментального оперативного втручання відмічається зменшення оптичної щільності зони заміщення до практично однакового рівня: при заміщенні α-ТКФ — до 92 ± 10 од., при заміщенні α-ТКФ + ГА — до 93 ± 10 од. Статистична різниця не відмічається (р = 0,776). Оптична щільність інтактних і оперованих кісток на рівні зони заміщення дефекту кісткової тканини в обох групах була статистично однаковою.
Для наочного уявлення про співвідношення показників оптичної щільності кісткової тканини щурів у зоні дефекту через 2 міс. після його заповнення кістковими цементами була побудована діаграма, яка наведена на рис. 2.
У табл. 3 наведені результати дослідження щільності кісткової тканини в зоні дефекту через 3 міс. після його заповнення кістковими цементами.
На 3-му місяці після проведеного експерименту спостерігається збільшення оптичної щільності як інтактних, так і оперованих кісток, при цьому різниці між ними не виявлено. Як і не виявлено статистичної різниці оптичної щільності кісток різних груп.
Наочне уявлення про співвідношення показників оптичної щільності кісткової тканини щурів у зоні дефекту через 3 міс. після його заповнення кістковими цементами можна отримати за допомогою діаграми, яка наведена на рис. 3.
Проведений багатомірний тест Піллая показав, що в динаміці оптичної щільності кісткової тканини тварин не простежується значущої різниці (F = 1,390; p = 0,298).
На графіках (рис. 4) відображено динаміку оптичної щільності кісток щурів упродовж експерименту.
На означених діаграмах динаміка оптичної щільності кісток тварин, починаючи з 2-го місяця експерименту, однакова, що підтверджує оцінка міжгрупових факторів (F = 2,193; p = 0,196).
Таким чином, незважаючи на те, що на первинному етапі матеріал заміщення на основі α-ТКФ + ГА має більшу оптичну щільність, у подальшому він деградує і заміщується кістковою тканиною, оптична щільність якої наближається до рівня інтактної кістки.
Проведені дослідження показали, що через 1 місяць після заповнення кісткового дефекту більша щільність тканини в зоні дефекту спостерігається у випадку його заповнення кістковим цементом на основі α-ТКФ + ГА, що, скоріше за все, обумовлено більш високою щільністю самого матеріалу порівняно з цементом, у складі якого тільки α-ТКФ. На 2-му місяці після заповнення дефекту спостерігається вирівнювання щільності кісткової тканини в зоні дефекту з щільністю неушкодженої кістки, що дозволяє припустити, що процес заміщення штучно утвореного дефекту метаепіфізарної зони кістковою тканиною відбувся. Підтвердити це припущення допоможуть подальші морфологічні дослідження.
Висновки
1. Оптична щільність інтактної кістки у тварин в обох групах упродовж експерименту поступово збільшувалася від 90 ± 8 од. до 98 ± 7 од. у групі з Ca3PO4 + α-ТКФ та від 89 ± 5 од. до 100 ± 12 од. у групі з Ca3PO4 + α-ТКФ + ГА, але статистично значущої різниці щодо оптичної щільності інтактних кісток не виявлено (р >> 0,05).
2. Через 1 місяць після заміщення дефекту Ca3PO4 + α-ТКФ + ГА відмічали статистично значуще (р = 0,017) більшу оптичну щільність оперованої кістки (113 ± 6 од.), ніж при заміщенні Ca3PO4 + α-ТКФ (101 ± 8 од.).
3. Через 2 місяці після початку експерименту оптична щільність інтактних і оперованих кісток на рівні зони заміщення дефекту в обох групах була статистично однаковою, що підтвердилося й через 3 місяці. Це може свідчити про заміщення заповнювача кістковою тканиною.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 01.07.2022
Рецензовано/Revised 08.07.2022
Прийнято до друку/Accepted 16.07.2022
Список литературы
1. Тимошенко О.П., Карпинский М.Ю., Верецун А.Г. Исследование диагностических возможностей программного комплекса «Х-rays». Медицина и... 2001. № 1. С. 62-64.
2. Вирва О.Є., Головіна Я.О., Малик Р.В., Карпінський М.Ю., Карпінська О.Д. Рентгенометричне дослідження кісткової щільності у разі алокомпозитного ендопротезування (експеримент in vivo). Ортопедия, травматология и протезирование. 2020. № 4. С. 18-24. DOI: 10.15674/0030-59872020418-24.
3. Бююль Ахим, Цефлер Петер. SPSS: искусство обработки информации. Анализ статистических данных и восстановление скрытых закономерностей: Пер. с нем. СПб.: ДиаСофтЮП, 2005. 608 с.
4. Наследов А. SPSS 19: профессиональный статистический анализ данных. СПб.: Питер, 2011. 400 с.
5. Зиман З.З. Кальцій-фосфатні біоматеріали. Навчальний посібник. Харків, 2018. 285 с.
6. Филиппенко В.А., Бондаренко С.Е., Мезенцев В.А., Ашукина Н.А. Применение современных биоматериалов для пластики костных дефектов вертлужной впадины при эндопротезировании тазобедренного сустава. Ортопедия, травматология и протезирование. 2012. № 4. С. 24-28.
7. Корж Н.А., Вырва О.Е., Дедух Н.В., Малышкина С.В. Керамические материалы в ортопедии и травматологии (от лабораторных исследований к практической медицине — достижения института). Ортопедия, травматология и протезирование. 2007. № 3. С. 20-30.
8. Zyman Z., Glushko V., Dedukh N. [et al.] Porous calcium phosphate ceramic granules and their behaviour in differently loaded areas of skeleton. Journal of Materials Science. Materials in Medicine. 2008. Vol. 19 (5). P. 2197-2205.
9. Kanazawa T., Umegaki T., Uchiyama N. Thermal crystallization of amorphous calcium phosphate to α-tricalcium phosphate. J. Chem. Tech. Biotechnol. 1982. Vol. 32. P. 399-406.
10. Fillingham Y. Bone grafts and their substitutes. The Bone & Joint Journal. 2016. Vol. 98-B (1 Suppl. A): Р. 6-9. doi: 10.1302/0301-620X.98B.36350.
11. Sohn H.S. Review of bone graft and bone substitutes with an emphasis on fracture surgeries. ВМС. Biomaterials Research. 2019. Vol. 23. Article ID: 9. doi: 10.1186/s40824-019-0157-y.
12. Laurencin C., Khan Y., El-Amin S.F. Bone graft substitutes. Expert review of medical devices. 2006. Vol. 3 (1). Р. 49-57. doi: 10.1586/17434440.3.1.49.
13. Zyman Z., Goncharenko A., Rokhmistrov D. Phase evolution during heat treatment of amorphous calcium phosphate derived from fast nitrate synthesis. Processing and Application of Ceramics. 2017. Vol. 11(2). Р. 147-153.
14. Zyman Z., Goncharenko A., Rokhmistrov D. Kinetics and mechanisms of the transformation of precipitated amorphous calcium phosphate with a Ca/P ratio of 1:1 to calcium pyrophosphates. J. Cryst. Growth. 2017. Vol. 478. Р. 117-122.
/26.jpg)

/24.jpg)
/25.jpg)
/26_2.jpg)