Журнал «Здоровье ребенка» Том 17, №4, 2022
Вернуться к номеру
Особливості реакцій організму дітей з онкологічними захворюваннями при внутрішньовенній анестезії з пропофолом
Авторы: Снісарь В.І., Миронов Д.В.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
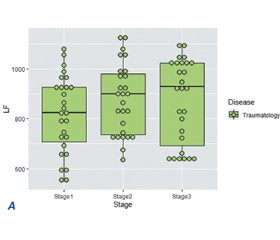
Актуальність. Хірургія є одним з наріжних каменів лікування раку. Останнім часом тотальна внутрішньовенна анестезія (ТВА) при онкологічних операціях стає більш популярною та практичною внаслідок кількох основних причин. Однак важливо оцінити адаптаційні реакції організму у дітей, яким проводять хірургічне лікування та анестезію. Мета дослідження: вивчити компенсаторно-адаптаційні механізми у відповідь на хірургічний та анестезіологічний стрес, адекватність ТВА у дітей з онкологічними захворюваннями шляхом оцінки рівня гормонів стресу та показників варіабельності серцевого ритму. Матеріали та методи. Обстежені 23 дитини з онкологічною патологією віком 10,68 ± 4,51 року (перша група), а також 27 дітей, які оперувалися з приводу малих травматологічних причин, віком 9,30 ± 3,85 року (друга група). Оперативне втручання дітям обох обстежених груп виконувалося під тотальною внутрішньовенною анестезією з пропофолом. Результати. Вже на другому етапі спостереження у 100 % пацієнтів першої групи відзначалося вірогідне зниження рівня систолічного тиску. Щодо травматологічних хворих, то на тлі ТВА тільки у 92,59 % пацієнтів на другому етапі спостерігалося зниження рівня систолічного тиску, що продовжувалося у 77,77 % пацієнтів і на третьому етапі. Аналізуючи показники варіабельності серцевого ритму, ми побачили, що у 30,43 % пацієнтів з онкологічними захворюваннями вже на другому етапі дослідження спостерігалося підвищення рівня у діапазоні високих частот HF. Щодо потужності спектра LF, то у половини пацієнтів відмічалося його зниження. У всіх обстежених пацієнтів було підвищення рівня кортизолу. Однак у дітей з онкологією підвищення було в 2,8 раза, а у травматологічних пацієнтів — у 4,4 раза. При цьому вихідний рівень кортизолу був вищий у дітей з онкологією. Висновки. Профіль реакцій на стрес у дітей із раком відрізняється від такого у дітей із травматологічною патологією. Тотальна внутрішньовенна анестезія з пропофолом покращила результати оперативного лікування пацієнтів, пригнічуючи екстремальні стресові реакції. Подальші дослідження необхідні, щоб зрозуміти, як оптимізувати модуляцію стресових реакцій та знайти точні маркери для оптимальної модуляції.
Background. Surgery is one of the cornerstones of cancer treatment. Recently, total intravenous anesthesia (TIA) has become more popular and practical in oncological surgeries due to several main reasons. However, it is important to assess the adaptive reactions of children who undergo surgical treatment and anesthesia. The objective: to study the compensatory and adaptive mechanisms in response to surgical and anesthetic stress, adequacy of TIA in children with oncological diseases by assessing the level of stress hormones and indicators of heart rate variability. Materials and methods. Twenty-three children with cancer aged 10.68 ± 4.51 years (first group) were examined, and also 27 children aged 9.30 ± 3.85 years (second group) were operated for minor trauma. Surgeries in children of both examined groups were performed under total intravenous anesthesia with propofol. Results. Already at the second stage of observation, 100 % of patients in the first group had a significant decrease in systolic blood pressure. As for trauma patients, only 92.59 % of them had a decrease in the level of systolic pressure on the background of TIA at the second stage, and 77.77 % of patients had it even at the third stage. Analyzing the parameters of heart rate variability, we saw that 30.43 % of cancer patients already at the second stage of the research had an increase in the level in the high frequency range. As for the power of the low-frequency spectrum, its decrease was noted in half of the patients. All examined people had elevated cortisol levels. However, children with tumors had a 2.8-fold its increase, trauma patients — a 4.4-fold increase. At the same time, children with cancer had higher initial level of cortisol. Conclusions. Children with oncology and children with trauma have different profiles of stress reactions. Total intravenous anesthesia with propofol improved the outcomes of surgical treatment by suppressing extreme stress reactions. Further research is needed to understand how to optimize the modulation of stress responses and to find precise markers for optimal modulation.
діти; внутрішньовенна анестезія; онкологічне захворювання; стрес
children; intravenous anesthesia; cancer; stress
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Jemal A., Siegel R., Ward E. et al. Cancer statistics, 2009. CA Cancer J. Clin. 2009. Vol. 59(4). P. 225-249. doi: 10.3322/caac.20006.
- Ries L.A., Percy C.L., Bunin G.R. Introduction. Cancer incidence and survival among children and Anesthesia for the Child with Cancer 207 adolescents: United States SEER Program 1975–1995. Еd. by Ries L.A., Smith M.A., Gurney J.G. et al. Bethesda, MD, 1999. P. 1-16.
- Horner M.J., Ries L.A., Krapcho M. et al. SEER cancer statistics review, 1975–2006. Bethesda (MD): National Cancer Institute; 2009. URL: http://seer.cancer. gov/csr/1975_2006/.
- Oeffinger K.C., Mertens A.C., Sklar C.A. et al. Chronic health conditions in adult survivors of childhood cancer. N. Engl. J. Med. 2006. Vol. 355(15). P. 1572-1582. doi: 10.1056/NEJMsa060185.
- Dubowitz J.A., Sloan E.K., Riedel B.J. Implicating anaesthesia and the perioperative period in cancer recurrence and metastasis. Clin. Exp. Metastasis. 2018. Vol. 35. P. 347-358. doi: 10.1007/s10585-017-9862-x.
- Latham G.J. Anesthesia for the child with cancer. Anesthesiol. Clin. 2014. Vol. 32(1). P. 185-213. doi: 10.1016/j.anclin.2013.10.002.
- Винник Ю.А., Маланов В.А., Бреславец В.П. и др. Оптимизация методов тотальной внутривенной анестезии в онкологии. Клиническая онкология, специальный выпуск. 2011. № II. С. 176.
- Hiller J.G., Perry N.J., Poulogiannis G., Riedel B., Sloan E.K. Perioperative events influence cancer recurrence risk after surgery. Nat. Rev. Clin. Oncol. 2018. Vol. 15. P. 205-218. doi: 10.1038/nrclinonc.2017.194.
- Kim M.H., Kim D.W., Kim J.H., Lee K.Y., Park S., Yoo Y.C. Does the type of anesthesia really affect the recurrence-free survival after breast cancer surgery? Oncotarget. 2017. Vol. 8. P. 90477-90487. doi: 10.18632/oncotarget.21014.
- Lee J.H., Kang S.H., Kim Y., Kim H.A., Kim B.S. Effects of propofol-based total intravenous anesthesia on recurrence and overall survival in patients after modified radical mastectomy: a retrospective study. Korean J. Anesthesiol. 2016. Vol. 69. P. 126-132. doi: 10.4097/kjae.2016.69.2.126.
- Oh T.K., Kim K., Jheon S. et al. Long-term oncologic outcomes for patients undergoing volatile versus intravenous anesthesia for non-small cell lung cancer surgery: a retrospective propensity matching analysis. Cancer Control. 2018. Vol. 25(1). P. 1073274818775360. doi: 10.1177/1073274818775360.
- Yan T., Zhang G.H., Wang B.N., Sun L., Zheng H. Effects of propofol/remifentanil-based total intravenous anesthesia versus sevoflurane-based inhalational anesthesia on the release of VEGF-C and TGF-β and prognosis after breast cancer surgery: a prospective, randomized and controlled study. BMC Anesthesiol. 2018. Vol. 18. P. 131. doi: 10.1186/s12871-018-0588-3.
- Yap A., Lopez-Olivo M.A., Hiller J., Riedel B. Anesthetic technique and cancer outcomes: a meta-analysis of total intravenous versus volatile anesthesia. Can. J. Anesth. 2019. Vol. 66. P. 546-561. doi: 10.1007/s12630-019-01330-x.
- Cao Y., Fan L., Li L., Zhou J. Propofol suppresses cell proliferation in gastric cancer cells through NRF2-mediated polyol pathway. СЕРР. 2022. Vol. 49, No. 2. P. 264-274. doi: 10.1111/1440-1681.13595.
- Shi H., Yan C., Chen Y., Wang Zh., Guo J., Pei H. Propofol inhibits the proliferation, migration, invasion and epithelial to mesenchymal transition of renal cell carcinoma cells by regulating microRNA-363/Snail1. Am. J. Transl. Res. 2021. Vol. 13(4). P. 2256-2269.
- Huang X., Liu J., Xie H. Propofol suppresses osteosarcoma cell function by regulating FOXO1/TUSC7. J. Pharm. Pharmacol. 2021. Vol. 73(6). P. 720-725. doi: 10.1093/jpp/rgab004.
- Alphin R.S., Martens J.R., Dennis D.M. Frequency-dependent effects of propofol on atrioventricular nodal conduction in guinea pig isolated heart. Anesthesiology. 1995. Vol. 83 (2). P. 382-394. doi: 10.1097/00000542-199508000-00019.
- Altememi G.F., Alkadhi K.A. Nitric oxide is required for the maintenance but not initiation of ganglionic long-term potentiation. Neuroscience. 1999. Vol. 94. P. 897-902. doi: 10.1016/s0306-4522(99)00362-0.
- Фесенко У.А. Пропофол. Харків: ТОВ «МАСИВ А.І.», 2013. 72 с.
- Yuki K., Matsunami E., Tazawa K., Wang W., DiNardo J.A., Koutsogiannaki S. Pediatric Perioperative Stress Responses and Anesthesia. Transl. Perioper. Pain Med. 2017. Vol. 2(1). P. 1-12.
- Haxholdt O.S., Kehlet H., Dyrberg V. Effect of fentanyl on the cortisol and hyperglycemic response to abdominal surgery. Acta Anaesthesiol. Scand. 1981. Vol. 25(5). P. 434-436. doi: 10.1111/j.1399-6576.1981.tb01681.x
- Anand K.J., Sippell W.G., Aynsley-Green A. Randomised trial of fentanyl anaesthesia in preterm babies undergoing surgery: effects on the stress response. Lancet. 1987. Vol. 1(8524). P. 62-66. doi: 10.1016/s0140-6736(87)91907-6.
- Ellis D.J., Steward D.J. Fentanyl dosage is associated with reduced blood glucose in pediatric patients after hypothermic cardiopulmonary bypass. Anesthesiology. 1990. Vol. 72(5). P. 812-815. doi: 10.1097/00000542-199005000-00007.
- Gruber E.M., Laussen P.C., Casta A. et al. Stress response in infants undergoing cardiac surgery: a randomized study of fentanyl bolus, fentanyl infusion, and fentanyl-midazolam infusion. Anesth. Analg. 2001. Vol. 92(4). P. 882-890. doi: 10.1097/00000539-200104000-00016.
- Jameson P., Desborough J.P., Bryant A.E., Hall G.M. The effect of cortisol suppression on interleukin-6 and white blood cell responses to surgery. Acta Anaesthesiol. Scand. 1997. Vol. 41. P. 304-308. doi: 10.1111/j.1399-6576.1997.tb04683.x.
- Yahara N., Abe T., Morita K., Tangoku A., Oka M. Comparison of interleukin-6, interleukin-8, and granulocyte colony-stimulating factor production by the peritoneum in laparoscopic and open surgery. Surg. Endosc. 2002. Vol. 16(11). P. 1615-1619. doi: 10.1007/s00464-001-8205-8.
- Ushiyama T., Nakatsu T., Yamane Sh. et al. Heart rate variability for evaluating surgical stress and development of postoperative complications. Clin. Exp. Hypertens. 2008. Vol. 30(1). P. 45-55. doi: 10.1080/10641960701813908.
- Coffey J.C., Wang J.H., Smith M.J.F., Bouchier-Hayes D., Cotter T.G., Redmond H.P. Excisional surgery for cancer cure: therapy at a cost. Lancet Oncol. 2003. Vol. 4. P. 760-768. doi: 10.1016/s1470-2045(03)01282-8.
- Салтанов А.И., Ордуханян З.С., Коломийский А.Ю. и др. Хирургический стресс в детской онкологии. Вопр. онкол. 1990. № 36(11). С. 1326-1330.

/29.jpg)
/30.jpg)