Журнал «Медицина неотложных состояний» Том 18, №4, 2022
Вернуться к номеру
Нутритивна терапія у хворих на ШВЛ із приводу гострого пошкодження головного мозку
Авторы: Підгірний Я.М., Мерза Р.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
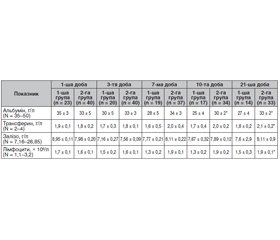
Актуальність. Гостре пошкодження мозку (ГПМ) визначається як гострий церебральний розлад, як наслідок травми або цереброваскулярної події (зокрема, субарахноїдального крововиливу, внутрішньочерепного крововиливу або гострого ішемічного інсульту). Терапевтичні можливості при ГПМ є обмеженими. Результат хвороби значною мірою визначається ускладненнями, які виникають у процесі перебігу ГПМ. Серед ускладнень особливе місце займає гіпоксія та інфекція. Тому респіраторна (РТ) та нутритивна терапія (НТ) є важливими технологіями, що мають використовуватися в комплексі інтенсивної терапії хворих із ГПМ. Матеріали та методи. Нами обстежені 63 хворі з ГПМ. Хворі були розділені на 2 групи: 1-ша група — 23 хворі (ретроспективна), 2-га група — 40 хворих (проспективна). Хворі обох груп не відрізнялися між собою за віком, статтю, тяжкістю ГПМ та антропометричними даними. Нутритивну дисфункцію діагностували на основі визначення альбуміну, трансферину, заліза сироватки крові, абсолютної кількості лімфоцитів. У хворих обох груп НТ проводилася згідно з рекомендаціями ESPEN та ASPEN, їх забезпечували енергією (25–30 ккал/кг маси тіла), вуглеводами (4–5 г/кг маси при швидкості їх введення 0,5 г/кг/год), азотом (1,5–2 г/кг), жирами (до 2 г/кг). У хворих другої групи НТ проводили з підвищеним умістом білка. Висновки. НТ із підвищеним умістом білка сприяла зменшенню терміну ШВЛ та перебування в реанімаційному відділенні. Останнє було наслідком зменшення частоти виникнення інфекційно-асоційованого трахеобронхіту та пневмонії.
Background. Acute brain injury (ABI) is an acute cerebral disorder resulting from a trauma or cerebrovascular event (including subarachnoid hemorrhage, intracranial hemorrhage, or acute ischemic stroke). Therapeutic options for ABI are limited. The outcome of the disease is largely determined by the complications that arise during ABI. Hypoxia and infection take a special place among complications. Therefore, respiratory and nutritional therapy (NT) are important technologies that should be used in the intensive care of patients with ABI. Materials and methods. We examined 63 patients with ABI. They were divided into 2 groups: the first group consisted of 23 people (retrospectively) and the second group of 40 patients (prospectively). Patients of both groups did not differ in age, sex, ABI severity, and anthropometric data. Nutritional dysfunction was diagnosed based on the albumin, transferrin, serum iron levels and the absolute lymphocyte count. In patients of both groups, NT was carried out according to the ESPEN and ASPEN guidelines, and provided them with energy (25–30 kcal/kg body weight), carbohydrates (4–5 g/kg body weight at a rate of infusion of 0.5 g/kg/h), nitrogen (1.5–2 g/kg), fats (up to 2 g/kg). In the second group, NT with an increased protein content was performed. Conclusions. NT with increased protein content contributed to a reduction in duration of mechanical ventilation and stay in the intensive care unit. The last was the result of a decrease in the incidence of infection-associated tracheobronchitis and pneumonia.
гостре пошкодження мозку; респіраторна терапія; нутритивна терапія
acute brain injury; respiratory therapy; nutritional therapy
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Ананьев Е.П., Полупан А.А., Мацковский И.В. и др. Использование режима IntelliVent-ASV для поддержки целевого диапазона EtCO2 у пациентов с тяжелой ЧМТ. Вопросы нейрохирургии. 2017. 5. 63-68. DOI: 10.17116/neiro201781563.https:doi.org/1017116/neiro201781563.
- Белкин А.А., Ершов В.И., Иванова Г.Е. Нарушение глотания при неотложных состояниях — постинтубационная дисфагия. Анестезиология и реаниматология. 2018. 4. 76-82. DOI: 10.17116/anaesthesiology201804176.
- Горбачев В.И., Лохов А.В., Горбачева С.М. К вопросу о респираторной поддержке больных с тяжелыми формами инсультов на догоспитальном этапе. Скорая медицинская помощь. 2018. 3(19). 69-74. https://doi.org/10.24884/2072-6716-2018-19-3-56-61.
- Ершов В.И., Грицан А.И., Белкин А.А., Заболотских И.Б., Горбачев В.И., Лебединский К.М и др. Российское многоцентровое обсервационное клиническое исследование «Реестр респираторной терапии у пациентов с острым нарушением мозгового кровообращения (RETAS)»: вопросы искусственной вентиляции легких. Анестезиология и реаниматология. 2021. 6. 25-34. https://doi.org/10.17116/anaesthesiology202106125.
- Ptaszkowska L., Ptaszkowski K., Halski T., Taradaj J., Dymarek R., Paprocka-Borowicz M. Immediate effects of the respiratory stimutionon ventilation parameters in ischemic stroke survivors: A randomized interventional stidy (CONSORT). Medicine (Baltimore). 2019. 98(38). e17128. https://doi.org/10.1097/MD.0000000000017128.
- Robba C., Bonatti G., Battaglini D., Rocco P.R.М., Pelosi P. Mechanical ventilation in patients with acute ischemic stroke: from pathophesiology to clinical practice. Criticale Care. 2019. 23(1). 388. https://doi.org/10.1186/s13054-019-2662-8.
- Robba C., Poole D., McNett M., Asehnoune K. Mechanical ventilation in patients with acute brain injury: recommendations of the European Society of Intensive Care Medicine consensus. Innetsive Care Med. 2020. 46. 2397-2410.

/12.jpg)