Вступ
Когнітивні розлади, які виникають після перенесених оперативних втручань, а саме післяопераційна когнітивна дисфункція (ПОКД), є суттєвою проблемою сучасної анестезіології [1]. За даними ВООЗ, у світі щороку проводиться близько 234 мільйонів великих оперативних втручань, при цьому приблизно в 50 мільйонів пацієнтів виникають післяопераційні ускладнення. Проблема післяопераційних когнітивних розладів є однією з найбільш актуальних в анестезіології в останні десятиліття, оскільки порушення когнітивних функції відбивається на професійних якостях, соціальному статусі пацієнтів і навіть на побутовій незалежності, що, безумовно, впливає на якість життя [2].
У 2019 році в десятку провідних причин смертності у світі вперше увійшли хвороба Альцгеймера та інші форми деменції, які в країнах Америки та Європи посіли третє місце. Смертність від цих хвороб переважно стосується жінок: у всьому світі понад 65 % людей, які померли у 2019 році в результаті хвороби Альцгеймера та інших форм деменції, — жінки [3, 4].
Когнітивні розлади, які розвиваються в післяопераційному періоді, є одним із предикторів розвитку стійкої когнітивної дисфункції і підвищують ризик деменції, тому з року в рік зростає увага до цієї проблеми як анестезіологів, так і лікарів інших спеціальностей. Це спонукає до застосування мультидисциплінарного підходу до вирішення проблеми запобігання та лікування післяопераційної когнітивної дисфункції [5–10].
Останніми роками фундаментальні дослідження в галузі нейрофізіології показали здатність мозку відновлювати та поліпшувати пізнавальні функції незалежно від віку через репаративні процеси та компенсацію порушених функцій завдяки реорганізації центральної нервової системи [11–13].
Пригнічення когнітивних функцій у післяопераційному періоді є наслідком поєднання факторів ризику виникнення ПОКД та факторів, які безпосередньо їх викликають.
Фактори ризику розвитку ПОКД:
— генетична схильність;
— наявність патології ЦНС;
— передопераційний рівень когнітивних функцій;
— похилий вік;
— вид хірургічного втручання;
— вид і тривалість анестезії.
Періопераційні фактори розвитку ПОКД:
— підвищення внутрішньочерепного тиску зі зниженням перфузії мозку і, як наслідок, його гіпоксією;
— системна гіпотензія в інтра- та післяопераційному періоді;
— спазм церебральних судин унаслідок гіпокапнії при хибних параметрах штучної вентиляції;
— порушення метаболізму;
— небажані ефекти застосування седативних препаратів або анестетиків;
— інциденти інтраопераційного пробудження;
— залишкові ефекти препаратів загальної анестезії та продуктів їх біодеградації;
— неадекватна післяопераційна аналгезія.
З огляду на фактори ризику розвитку ПОКД випереджувальна нейрозахисна терапія набуває суттєвого практичного значення для запобігання пошкодженню нейронів або корекції когнітивної дисфункції в ранньому післяопераційному періоді. Вона повинна містити вибір оптимального варіанта анестезії, адекватну інтраопераційну корекцію гемодинаміки, газообміну та гомеостазу, бути спрямована на запобігання або переривання патологічних каскадів, які викликають дисфункцію нейронів.
Напрямки медикаментозної профілактики і корекції ПОКД
1. Вибір анестезії такого типу, який забезпечить максимальний захист від хірургічної агресії й одночасно справлятиме мінімальний вплив на когнітивні функції.
2. Захист клітин головного мозку від несприятливого впливу загальної дії анестетиків та анальгетиків за допомогою лікарських засобів, що покращують клітинний метаболізм.
3. Захист та відновлення клітинного метаболізму, порушеного через вплив препаратів, що використовуються для анестезії.
4. Профілактика та терапія когнітивних розладів фармацевтичними препаратами з ноотропним та нейропротекторним ефектом.
На даний час маловивченою є ефективність різних церебропротективних фармакологічних препаратів як засобів, що запобігають або усувають когнітивні розлади у хворих в післяопераційному періоді, що спонукало до виконання цієї роботи.
Мета: визначення впливу перенесеного оперативного втручання на когнітивні функції, оцінка ефективності окремих методів фармакологічної профілактики та лікування післяопераційних розладів когнітивних функцій.
Матеріали та методи
Дослідження виконано в КП «Обласна клінічна лікарня ім. І.І. Мечникова» ДОР, для дослідження були обрані пацієнти обох статей віком від 55 до 75 років, яким проводилося планове оперативне втручання на органах черевної порожнини.
Критерії включення: 1) тяжкість вихідного стані та травматичність оперативного втручання за ASA II–III ступеня; 2) передбачуваний об’єм крововтрати не більше від 20 %.
Критерії невключення: 1) гострі порушення мозкового кровообігу та транзиторні ішемічні атаки в минулому і ті, які виникли під час поточної госпіталізації на передопераційному етапі; 2) гіпертонічна хвороба ІІІ стадії або гіпертонічні кризи в анамнезі; серцева недостатність III–IV функціонального класу; стала фібриляція передсердь; цукровий діабет із підтвердженими ознаками діабетичної ангіопатії; будь-яка інша супутня патологія, яка може впливати на когнітивні функції; наявність клінічно значущого когнітивного зниження, виявленого на передопераційному етапі.
Критерії виключення: 1) об’єм інтраопераційної крововтрати більше від 20 %; 2) гемодинамічні розлади під час оперативного лікування та анестезіологічного забезпечення; 3) будь-які ускладнення в періопераційному періоді, які супроводжуються епізодами системної гіпоксії та/або гіпотензії тривалістю понад 30 хвилин; 4) ознаки порушення мозкового кровообігу або транзиторна ішемічна атака в післяопераційному періоді; 5) тяжкий перебіг післяопераційного періоду, який вимагав тривалого ліжкового режиму і затримував переведення хворого з відділення анестезіології та інтенсивної терапії; 6) повторне оперативне втручання протягом дослідження.
У дослідження включені 62 пацієнти, які були рандомізовані в три групи дослідження: контрольну (контроль), першу дослідницьку (тіоцетам) і другу дослідницьку (меглюміну натрію сукцинат). Робочі назви груп для таблиць і діаграм: контроль, тіоцетам та меглюміну натрію сукцинат. Для рандомізації використовувався метод конвертів. Розподіл хворих по групах та їх антропометричні дані подані в табл. 1.
За нозологією та видом оперативного втручання групи були подібними (табл. 2). При клінічному обстеженні хворих було виявлено супутні захворювання переважно серцево-судинної та ендокринної систем в окремих хворих (табл. 3).
Хворим усіх трьох груп оперативні втручання на органах черевної порожнини проводилися в умовах тотальної внутрішньовенної анестезії методом атаралгезії.
Премедикація: напередодні операції перед сном: феназепам 2 мг перорально; за 45–50 хвилин до операції: димедрол 1 мг + сибазон 10 мг внутрішньом’язово; на операційному столі перед початком операції: атропін 0,1% 1 мл + морфіну гідрохлорид 1% 1 мл + сибазон 20 мг внутрішньовенно.
Вводний наркоз: тіопентал натрію 3 мг/кг + фентаніл 100 мкг внутрішньовенно.
Міорелаксація: дитилін 1,5 мг/кг внутрішньовенно перед інтубацією трахеї; ардуан — стартова доза 0,06 мг/кг, далі за потребою по 0,01 мг/кг кожні 25–30 хвилин.
Основний наркоз: фентаніл 10 мкг/кг в першу годину і по 5 мкг/кг/год до кінця операції; сибазон 10 мг кожні 30 хвилин до кінця операції.
Штучна вентиляція легень під час операції проводилася в режимі нормовентиляції (режим CMV або PCV-VG, ДО = 6–7 мл/кг, ХОД до 10 л/хв).
Інфузійно-трансфузійна терапія під час операції проводилася колоїдними та кристалоїдними розчинами, які при великих обсягах оперативного втручання доповнювалися переливанням свіжозамороженої плазми та еритроцитарної маси за традиційною схемою поповнення крововтрати.
Післяопераційне знеболювання здійснювалось під контролем вираженості больового синдрому з використанням візуально-аналогової шкали за допомогою наркотичних препаратів із поступовим зменшенням частоти введення і переходом на ненаркотичні засоби. З наркотичних препаратів використовувався морфіну гідрохлорид 1,0 мл 1% розчину внутрішньом’язово. Тривалість його застосування у всіх хворих становила 2 доби. Починаючи з 3-ї доби після оперативного втручання знеболювання здійснювалося ненаркотичним аналгетиком кеторолаком 1 мл 3% розчину внутрішньом’язово за вимогою. Види оперативних втручань, виконаних хворим блоку операційної травми, наведені в табл. 4.
/18.jpg)
При госпіталізації до лікарні всім хворим проводився стандартний комплекс клініко-діагностичних заходів: збирався детальний анамнез, проводилося загальноклінічне обстеження, здійснювався забір крові та сечі для лабораторних досліджень. Клініко-лабораторне обстеження хворих включало також визначення показників центральної гемодинаміки (систолічного артеріального тиску, ударного об’єму, серцевого викиду, серцевого індексу), газообміну (PaO2, PvO2, PaCO2, PvCO2), забезпечення киснем (VO2, DO2), обміну глюкози (глюкоза, лактат, піруват, відношення лактату до пірувату).
Для дослідження когнітивних функцій була використана методика тестування за допомогою «Прогресивних матриць Равена» [14]. При виконанні тесту Равена актуалізуються такі когнітивні процеси, як сприйняття (зоровий аналіз і синтез), увага (мають значення стійкість уваги та її розподіл, загальна продуктивність, працездатність, переключення) і образне мислення.
Після закінчення тестування підраховувалася кількість правильних відповідей, кожна з яких отримала 1 бал, і визначався відсоток правильних відповідей від максимально можливих 60 балів. Виявлення когнітивної дисфункції у хворих з операційною травмою здійснювалось шляхом порівняння стану когнітивних функцій на етапах дослідження з вихідним значенням, взятим за 100 %. За ознакою когнітивної дисфункції взято межу, запропоновану L.S. Rassmussen [1], — зниження понад 10 % від вихідного значення.
Для визначення вихідної когнітивної дисфункції у хворих, включених в дослідження, проведене вирахування загального середнього вихідного значення для всіх трьох груп блоку операційної травми. Ця величина взята за референтну норму для даної когорти хворих. Вона становила 47,10 ± 3,22 бала. Загальноприйнятою ознакою когнітивної дисфункції є зниження більше ніж на 10 % від норми. Значення, яке відповідає цій межі, дорівнювало 42,39 бала. Цей рівень знаходиться поза межею довірчого інтервалу, що дало підстави вважати його прийнятним для застосування в даному дослідженні.
Для визначення впливу операційної травми на когнітивні функції були обрані сім етапів: 1) до операції; 2) інтраопераційний; 3) кінець операції; 4) через 1 добу після операції; 5) на 5-ту добу; 6) на 14-ту добу; 7) на 30-ту добу.
Більшість показників гомеостазу організму зазвичай змінюється значно частіше, ніж проводиться їх реєстрація. Використання значення, зареєстрованого у заздалегідь визначений час, може не відбивати повною мірою стан організму протягом досліджуваного періоду, що може вносити суттєву помилку і в середні величини, і в результати порівняння груп. Особливо це стосується етапу оперативного втручання. Для зменшення впливу коливань параметрів гемодинаміки як величину, що відповідає інтраопераційному етапу дослідження, ми використовували середнє значення серії вимірів [15].
Для профілактики та лікування післяопераційних розладів когнітивних функцій ми використали два препарати, які представляють два напрямки фармакотерапії: тіоцетам — ноотропний препарат із поліорганопротективною дією і меглюміну натрію сукцинат — соль янтарної кислоти, важливий компонент циклу Кребса, який також має поліорганопротективну дію, пов’язану із забезпеченням видобутку енергії.
Тіоцетам застосовувався за такою схемою: одразу після надходження до ВІТ протягом 7 днів (або довше, якщо хворий не має можливості приймати ліки ентерально): 20 мл тіоцетаму (2 г пірацетаму + 0,6 г тіотриазоліну) одноразово. Далі протягом наступного 21 дня: по 1 таблетці тіоцетаму форте 3 рази на день (1 таблетка містить: пірацетаму 400 мг; морфолінієвої солі тіазотної кислоти 100 мг, що еквівалентно 66,5 мг тіазотної кислоти).
Меглюміну натрію сукцинат застосовувався за такою схемою: початкова навантажувальна доза (при планових операціях — до початку оперативного втручання, при критичних станах — при надходженні до ВІТ) — внутрішньовенна краплинна інфузія 800 мл меглюміну натрію сукцинату (12–14 мл/кг). Далі краплинна інфузія 400 мл (5–8 мл/кг) 1 раз на добу протягом 7 днів.
Статистична обробка отриманих даних проводилась за допомогою статистичних формул табличного редактора Calc програмного комплексу LibreOffice 7.2.5.2.
Результати
Показники гемодинаміки у хворих, оперованих в умовах тотальної внутрішньовенної анестезії методом атаралгезії, на всіх етапах обстеження були у вікових референтних межах, або їх відхилення за ці межі не мали клінічного значення. На інтраопераційному етапі виявлене незначне підвищення ЧСС, систолічного, діастолічного і середнього артеріального тиску. При цьому коливання рівнів ударного об’єму, серцевого викиду і серцевого індексу були клінічно незначущими.
Зміни гемодинаміки на наступних етапах у всіх трьох групах характеризувалися подальшим зниженням артеріального тиску до вихідного рівня і тенденцією ударного об’єму і серцевого викиду до збільшення. Діастолічний артеріальний тиск і середній артеріальний тиск через добу і на 5-ту добу після операції залишалися нижчими за вихідні значення.
Рівні гемоглобіну, гематокриту і кількість еритроцитів у ранньому післяопераційному періоді у хворих контрольної групи знизились в середньому на 11,6–12,9 %, але не виходили за межі фізіологічних значень. Так, гемоглобін знизився з вихідних 136,4 ± 9,5 г/л до 118,1 ± 8,0 г/л через добу після операції, гематокрит — із 0,43 ± 0,03 л/л до 0,39 ± 0,02 л/л, а кількість еритроцитів — із 4,35 ± 0,35 Т/л до 3,86 ± 0,14 Т/л. При цьому статистично вірогідна різниця між вихідним і наступними етапами була тільки в гематокриту (p < 0,001), тоді як за іншими показниками вірогідної різниці не було. Аналогічними були коливання показників кисневотранспортної системи і в дослідних групах.
Аналіз газового складу артеріальної і венозної крові у хворих контрольної групи виявив знижений рівень напруги кисню в артеріальній крові на всіх етапах дослідження. Знижений рівень напруги кисню в артеріальній крові на вихідному етапі та його коливання протягом наступних етапів дослідження не супроводжувалися змінами інших показників газового складу крові.
У першій дослідній групі, у якій в післяопераційному періоді застосовували тіоцетам, на інтраопераційному етапі спостерігалось зниження показників як постачання, так і використання кисню. За умови стабільності інших показників газів крові і кислотно-лужного стану, а також лактату і пірувату зниження показників постачання і споживання кисню на інтраопераційному етапі можна вважати клінічно незначущим. Вже через добу після операції ці показники повернулися на вихідні рівні. При цьому важливо підкреслити стабільність рівнів лактату і пірувату у хворих цієї групи протягом всіх етапів дослідження.
У другій дослідній групі, у якій інтенсивна терапія післяопераційного періоду включала меглюміну натрію сукцинат, потреби організму в кисні були повністю задоволені. Так, на відміну від контрольної групи, у хворих, які отримували меглюміну натрію сукцинат, на 5-ту добу післяопераційного періоду відмічене підвищення напруження кисню в артеріальні крові і показників кислотно-лужного стану. При тому, що атаралгезія підтримувала забезпеченість киснем під час оперативного втручання на належному рівні, доповнення інтенсивної післяопераційної терапії меглюміну натрію сукцинатом запобігало можливим епізодам гіпоксемії та ішемії в післяопераційному періоді.
Порівняння показників соматичного стану хворих досліджуваних груп показало відсутність значного впливу меглюміну натрію сукцинату і тіоцетаму на показники кисневотранспортної та серцево-судинної систем. Аналіз показників, які характеризують стан гомеостазу хворих протягом періопераційного періоду, дозволяє зробити висновок, що тотальна внутрішньовенна анестезія методом атаралгезії забезпечувала достатній захист соматичного стану хворих похилого віку від хірургічної агресії при абдомінальних оперативних втручаннях.
Вихідний стан когнітивних функцій у хворих, оперованих в умовах атаралгезії, становив 49,83 % (95% ДІ 44,30–55,33) правильних відповідей, що відповідає середньому рівню інтелектуальних можливостей. Вплив оперативного втручання й атаралгезії на стан когнітивних функцій мав хвилеподібний характер. У ранньому післяопераційному періоді він проявився зниженням когнітивних функцій на 22,2 % від вихідного рівня (різниця вірогідна, p = 0,00096). Кількість правильних відповідей хворих на цьому етапі становила лише 36,91 % (95% ДІ 34,19–39,62), що було на 25,9 % нижче за вихідний рівень (рис. 1). Це зниження було пов’язане перш за все з порушенням складного сприйняття, помилками в побудові конкретних і особливо абстрактних умовиводів. У той же час при визначенні порушення вищої форми абстракції та динамічного синтезу кількість правильних відповідей не змінилася.
На 14-ту добу стан когнітивних функцій покращувався — хворі показали 47,90 % (95% ДІ 44,14–51,66) правильних відповідей, що було лише на 3,87 % нижче від вихідного рівня. Тобто через 14 днів когнітивні функції хоча й були зниженими, проте різниця з вихідним рівнем не досягала порогового рівня й статистично була невірогідною.
На 30-ту добу післяопераційного періоду хворі давали 45,88 % (95% ДІ 42,54–49,21) правильних відповідей, що було нижче від вихідного рівня на 7,92 %. Ця тенденція до погіршення когнітивних функцій у віддаленому періоді після планового оперативного втручання в умовах атаралгезії свідчить про нестійкий ефект самостійного відновлення нормального функціонування нервової системи у хворих похилого віку. При аналізі різниці між результатом на 30-ту добу і вихідним рівнем окремо в кожного пацієнта виявлено ознаки когнітивної дисфункції в 10 з 19 пацієнтів (52,6 % випадків).
Вихідний стан когнітивних функцій у хворих підгрупи, яка отримувала в післяопераційному періоді тіоцетам, був нижчим, ніж у контрольній підгрупі, — 44,10 % (95% ДІ 38,76–49,45), хоча ця різниця була статистично невірогідною. Серед хворих цієї групи на вихідному етапі когнітивну дисфункцію виявлено в 9 хворих.
При застосуванні тіоцетаму вплив оперативного втручання й атаралгезії на стан когнітивних функцій у ранньому післяопераційному періоді був повністю нівельований — середня кількість правильних відповідей на 5-ту добу становила 46,79 % (95% ДІ 43,01–50,56). При цьому, на відміну від контрольної групи, уже на цьому етапі намітилася тенденція до поліпшення когнітивних функцій. На наступних етапах ця тенденція привела до значного їх підвищення. Так, на 14-ту добу загальний показник інтелектуальних здібностей становив 59,73 % (95% ДІ 55,87–63,59), а на 30-ту добу — 63,63 % (95% ДІ 60,55–66,71) (рис. 2).
На підставі аналізу цих даних можна зробити висновок, що тіоцетам не тільки повністю ліквідує наслідки негативної дії на нервову систему факторів операційної травми й атаралгезії, а й надає додатковий позитивний вплив, завдяки якому в післяопераційному періоді інтелектуальні можливості в пацієнтів похилого віку перевищують їх доопераційний рівень.
Вихідний стан когнітивних функцій у хворих, які отримували в післяопераційному періоді меглюміну натрію сукцинат, був нижчим, ніж в контрольній групі, — 47,76 % (95% ДІ 41,91–53,60), але ця різниця була статистично невірогідною. У цій групі у 9 хворих когнітивна дисфункція була виявлена вже на вихідному етапі.
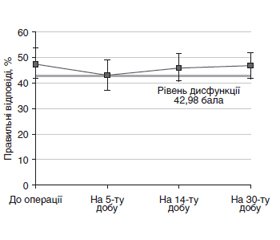
При застосуванні меглюміну натрію сукцинату операційна травма й атаралгезія значно менше впливали на стан когнітивних функцій у ранньому післяопераційному періоді, ніж в контрольній групі, але й захист був виражений менше — середня кількість правильних відповідей на 5-ту добу становила 42,99 % (95% ДІ 37,02–48,95), що в абсолютних цифрах було нижче від вихідного рівня на 4,77 %, а у відносних — на 9,99 %, що майже відповідало критерію визначення когнітивної дисфункції. Проте мала різниця при таких довірчих інтервалах дозволяє стверджувати, що в цій групі когнітивні функції в ранньому післяопераційному періоді статистично не відрізнялися від вихідного рівня (рис. 3).
/21.jpg)
Когнітивно-зберігаючий вплив меглюміну натрію сукцинату проявився стабільністю когнітивних функцій і на наступних етапах. Так, на 14-ту добу їх рівень становив 46,06 % (95% ДІ 40,68–51,44), а на 30-ту — 46,73 % (95% ДІ 41,65–51,81). При цьому зміни когнітивних функцій різного рівня складності мали певні особливості. Аналіз кількості помилок в різних серіях «Прогресивних матриць Равена» у цій групі хворих виявив зміни, аналогічні тим, що були в контрольній групі. З ускладненням завдань від серії до серії кількість правильних відповідей під час тестування на кожному етапі дослідження зменшувалась. Проте, на відміну від контрольної групи, у групі меглюміну натрію сукцинату це зменшення було більш лінійним.
Для більш чіткого визначення впливу досліджуваних препаратів на стан когнітивних функцій виконане порівняння якісних показників, а саме частоти виникнення когнітивної дисфункції в досліджуваних групах. Для цього була використана методика розрахунку показників доказової медицини.
У контрольній групі на 5-ту добу когнітивна дисфункція виникала у 89,5 % хворих (показник CER = 0,89), на 14-ту добу її прояви залишилися у 36,8 % хворих (CER = 0,37), але на 30-ту добу кількість хворих із проявами когнітивної дисфункції зросла до 52,6 % (CER = 0,53).
Частота когнітивної дисфункції на 5-ту добу в групах із різними варіантами церебропротекції була меншою: у групі з меглюміну натрію сукцинатом вона становила 38,0 % (показник EER = 0,38), а в групі з тіоцетамом — 22,7 % (EER = 0,23) (табл. 5).
Різниця між групами меглюміну натрію сукцинату й тіоцетаму на 14-ту добу була більш суттєвою. Так, частота події в групі тіоцетаму була лише 5 % (показник EER = 0,05), тоді як у групі з меглюміну натрію сукцинатом — 14 % (EER = 0,14). Проте на 30-ту добу в обох групах частота виявлення когнітивної дисфункції була приблизно однаковою й на 88–89 % нижчою за контрольну групу.
Отже, можна визнати, що у хворих похилого віку при абдомінальних хірургічних втручаннях в умовах атаралгезії меглюміну натрію сукцинат дозволяє зберегти когнітивні функції на доопераційному рівні, значно зменшуючи частоту розвитку когнітивної дисфункції, особливо в ранньому післяопераційному періоді. Тоді як тіоцетам у цієї категорії хворих не тільки запобігає розвитку порушень когнітивних функцій, що проявляється зниженням частоти когнітивної дисфункції як у ранньому, так і у віддаленому післяопераційному періодах, а й суттєво їх покращує, причому покращення продовжується й у віддаленому періоді.
Обговорення
Вихідний стан досліджених клініко-лабораторних показників між групами суттєво не відрізнявся. Коливання показників гемодинаміки, кисневотранспортної системи, кислотно-лужного стану й газів крові протягом періопераційного періоду не мали статистично значущої різниці між контрольною та досліджуваними групами. Це дає підстави асоціювати відмінності в післяопераційній динаміці когнітивних функцій із дією обраних методів їх профілактики і відновлення.
Когнітивні функції хворих похилого віку після оперативного втручання на органах черевної порожнини в умовах атаралгезії, незважаючи на достатній інтраопераційний захист соматичного стану, забезпечений атаралгезією, протягом раннього післяопераційного періоду погіршувалися. Причому погіршення зазнавали перш за все помірно складні функції — складне сприйняття, побудова конкретних і абстрактних умовиводів. Через 14 днів загальний показник когнітивних функцій у хворих контрольної групи повертався практично до вихідного рівня, що може свідчити про потенціальну оборотність змін, які виникають унаслідок негативного впливу операції та анестезії на ЦНС. У той же час тенденція до повторного погіршення когнітивних функцій через 30 діб після операції дає підстави припускати, що оперативний стрес, операція та анестезія запускають каскад патофізіологічних процесів, який може підтримуватися в організмі хворого тривалий час.
Меглюміну натрію сукцинат, хоча і неповною мірою, запобігає пригніченню когнітивних функцій у ранньому післяопераційному періоді і сприяє повному відновленню їх до вихідного рівня на наступних етапах. Цей його клінічний ефект може бути пов’язаний із поліорганопротективною дією, в основі якої лежить здатність сукцинату включатися в цикл видобутку енергії, запобігаючи таким чином епізодам гіпоергозу.
Комбінований препарат тіоцетам, що містить поліорганопротективний препарат тіотриазолін і ноотроп пірацетам, за рахунок першого компонента, ймовірно, запобігає активації патофізіологічного каскаду, який негативно впливає на когнітивні функції в ранньому і віддаленому післяопераційному періоді, а за рахунок другого компонента покращує метаболізм і взаємодію нейронів. Обидві фармакологічні дії поєднуються в клінічний ефект — повне запобігання погіршенню когнітивних функцій у ранньому післяопераційному періоді та їх суттєве покращення у віддаленому післяопераційному періоді.
Отже, підсумовуючи вищесказане, можна вважати доцільним проведення подальших розгорнутих досліджень ефективності меглюміну натрію сукцинату і тіоцетаму при застосуванні їх у хворих похилого віку після перенесеного оперативного втручання на органах черевної порожнини, виконаного в умовах анестезіологічного захисту методом атаралгезії.
Висновки
1. У хворих похилого віку після оперативного втручання на органах черевної порожнини, виконаного в умовах анестезіологічного захисту методом атаралгезії, у післяопераційному періоді відзначається хвилеподібне погіршення когнітивних функцій із первинним погіршенням в перші 5 діб, повторним погіршенням на 30-ту добу та частковим відновленням на 14-ту добу.
2. Застосування меглюміну натрію сукцинату дозволяє запобігти пригніченню когнітивних функцій у ранньому і віддаленому післяопераційних періодах.
3. Комбінований препарат тіоцетам не тільки запобігає погіршенню, а й покращує когнітивні функції у хворих похилого віку протягом як раннього, так і віддаленого післяопераційного періоду.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 20.02.2022
Рецензовано/Revised 04.03.2022
Прийнято до друку/Accepted 15.03.2022
/21.jpg)

/17.jpg)
/18.jpg)
/20.jpg)
/21_2.jpg)