Вступ
При виконанні лапароскопічних операцій на органах черевної порожнини накладення пневмоперитонеуму, а частіше карбоксиперитонеуму визначає особливості їх анестезіологічного менеджменту. Анестезіологічне забезпечення лапароскопічних оперативних втручань має враховувати особливості технологій ендовідеохірургічного втручання (ЕВХВ): використання карбоксиперитонеуму, специфічні «круті» положення тіла на операційному столі, нерідко більша тривалість операції.
Для створення пневмоперитонеуму, який забезпечує поле зору хірурга, можуть застосовуватись різні типи газу, температури й тиску. Ідеальний газ для пневмоперитонеуму має бути дешевим, безбарвним, негорючим, легко виводитися з організму, нетоксичним, нешкідливим для хворого й персоналу. Гази, що використовуються або використовувалися раніше, являють собою CO2, закис азоту (N2O, «газ, що веселить»), повітря, кисень, азот (N2) та інертні гази — гелій (He) і аргон (Ar) [1].
CO2 є найпоширенішим і відповідає більшості вищезгаданих критеріїв. Він всмоктується очеревиною, доставляється в легені з кров’ю і видихається. Будучи розчинною кислотою, він викликає гіперкапнію, гіперкарбію та ацидоз, які анестезіолог повинен компенсувати гіпервентиляцією. Гіперкарбія може безпосередньо знижувати скорочувальну здатність серця й підвищувати чутливість міокарда до аритмогенних ефектів катехоламінів, побічно призводити до симпатичної стимуляції з тахікардією [2].
Внутрішньочеревний тиск у здорових осіб без ожиріння становить 5 мм рт.ст. і менше, з ожирінням — 9–10 мм рт.ст. При ЕВХВ потрібне підвищення внутрішньочеревного тиску до 15 мм рт.ст. і вище, що призводить до низки ефектів: системної абсорбції вуглекислого газу й підвищення вимог до його усунення; збільшення венозного застою; зниження портального кровотоку; зниження діурезу; зниження дихального комплаєнсу; підвищення тиску в дихальних шляхах; погіршення роботи серця. Однак тиск на очеревину знижує кровообіг у судинах з низьким тиском, капілярах і венах, що може сприяти запальній або стресовій реакції. Тиск на печінку (вени), діафрагму й легені може зменшити переднавантаження на серце, зменшити об’єм легень приблизно на третину, спровокувати ателектаз, шунтування легеневого кровообігу й порушення вентиляційно-перфузійного співвідношення. Теплий зволожений CO2 не має переваг перед холодним сухим газом, але пов’язаний зі збільшеними фінансовими затратами. Отже, бажано знизити тиск, щоб звести до мінімуму серцево-легеневі ускладнення, і одночасно знайти баланс, щоб забезпечити добре поле зору [1].
Оцінка парціального тиску вуглекислого газу в артеріальній крові (PaCO2) шляхом прямого аналізу газів артеріальної крові є золотим стандартом моніторингу вуглекислого газу під час загальної анестезії. Однак, оскільки пряме вимірювання PaCO2 є інвазивним і дискретним, моніторинг парціального тиску вуглекислого газу в кінці видиху (PetCO2) кращий для безперервного моніторингу вуглекислого газу [3].
За останні десятиліття способи капнографії були значно покращені завдяки розробці більш швидких інфрачервоних датчиків, які вимірюють рівень CO2 на вході дихальних шляхів у реальному часі [4]. Знання того, як CO2 виділяється з кровотоку через альвеоли в атмосферне повітря, допомагає отримати необхідну інформацію про вентиляцію і перфузію. Важливим обмеженням моніторингу PetCO2 є його низька точність через такі фактори, як невідповідність вентиляції та перфузії, шунт і хірургічне положення пацієнта, включно з положенням Тренделенбурга або лежачи на боці й животі. Точність моніторингу PetCO2 знижується через тривалий карбоксиперитонеум [4].
Як підхожа альтернатива був запропонований черезшкірний моніторинг парціального тиску вуглекислого газу (PtcCO2), на який не впливає невідповідність вентиляції і перфузії. Моніторинг PtcCO2 вимірював PaCO2 більш точно, ніж моніторинг PetCO2 під час роботизованої радикальної простатектомії, що потребує тривалого карбоксиперитонеуму й крутого положення Тренделенбурга. Моніторинг PtcCO2 також забезпечує більш точні вимірювання для налаштування вентилятора й ефективніше виявляє гіперкапнію, ніж моніторинг PetCO2[5].
Досліджено зв’язок між інтраопераційною концентрацією вуглекислого газу в кінці видиху і післяопераційною нудотою і блюванням (ПОНБ) при гінекологічній лапароскопічній хірургії [6]. Первинним результатом у цьому дослідженні була ПОНБ, що визначалась протягом двох днів після операції. Вторинними результатами були нудота протягом двох днів після операції, блювання протягом двох днів після операції, ПОНБ протягом 3–7 днів після операції і тривалість перебування в стаціонарі після операції для пацієнтів, які дожили до виписки. Низький інтраопераційний PetCO2 (середній рівень PetCO2 менше за 35 мм рт.ст.) не був суттєво пов’язаний ні зі збільшенням частоти ПОНБ, ні з подовженням тривалості перебування в пацієнток, які перенесли гінекологічну лапароскопічну операцію.
Проведено ретроспективне обсерваційне дослідження дорослих пацієнтів, які перенесли лапароскопічну абдомінальну операцію. Незалежний зв’язок між підвищенням РаСО2 і змінами концентрації калію в плазмі оцінювали шляхом вимірювання газів артеріальної крові протягом 15 хв після індукції анестезії та протягом 15 хв після завершення операції. У пацієнтів, які перенесли лапароскопічну операцію на органах черевної порожнини, наприкінці операції спостерігається підвищення РaCO2, що незалежно пов’язано з підвищенням концентрації калію в плазмі. Однак цей ефект невеликий і в основному залежить від інфузійної внутрішньовенної терапії (розчин Plasma-Lyte 148) і наявності діабету [7].
Отже, розробка стратегії зниження гіперкапнії при трансабдомінальній і екстраабдомінальній ендовідеохірургічній герніопластиці є актуальною.
Мета дослідження: вивчити можливість корекції гіперкапнії при трансабдомінальних і екстраабдомінальних ендовідеохірургічних герніопластиках.
Матеріали та методи
Дослідження виконане на базі хірургічного центру Державної наукової установи «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами м. Києва відповідно до стандартів належної клінічної практики (Good Clinical Practice) і принципів Гельсінської декларації 1964 року і її останніх змін з використанням лабораторно-технічних можливостей установи. Усі пацієнти давали усну й письмову добровільну інформовану згоду на проведення обстеження, аналізів, лікування, виконання операції, знеболювання й обробку отриманих даних. Дозвіл на проведення дослідження і протокол дослідження був схвалений комісією з питань біоетики установи.
Дослідження було проспективним нерандомізованим. У групу дослідження увійшли 139 чоловіків, яким проводилися ендовідеохірургічні втручання у зв’язку з грижами передньої черевної стінки й паховими грижами. Вік хворих становив 34–76 років, функціональний клас тяжкості стану за ASA — II–IV. У 42 (30,2 %) пацієнтів були супутні захворювання, переважно серця, судин і шлунково-кишкового тракту. У групу І (n = 72) увійшли пацієнти, яким проводилася лапароскопічна трансабдомінальна преперитонеальна герніопластика (Transabdominal Preperitoneal Plastic, ТАРP). У групу ІІ (n = 67) — пацієнти, яким була виконана ендоскопічна тотальна екстраперитонеальна герніопластика (Totally Extraperitoneal Plastic, TEP). Групи хворих були репрезентативні за віком і статтю. Тривалість операції становила 2–2,5 год. У групі І у 9 (12,5 %) пацієнтів виконувалися симультанні операції: ТАРP + лапаро–скопічна холецистектомія. У групі ІІ 22 (32,8 %) пацієнтам були виконані двобічні TEP. До групи дослідження не включали пацієнтів з тяжкою цереброваскулярною патологією, які мали органічну неврологічну симптоматику, а також пацієнтів з дилатаційною кардіоміопатією та ішемічною хворобою серця IV функціонального класу з фракцією викиду серця менше за 35 %. Безпосередньо перед операцією внутрішньовенно вводили цефтріаксон 2 г, фентаніл 0,1 мг. Крім того, внутрішньовенно краплинно здійснювали інфузію 1000 мг розчину парацетамолу. З метою запобігання нудоті й блюванню в ранньому післяопераційному періоді перед оперативним втручанням призначали селективний антагоніст 5НТ3 серотонінових рецепторів ондансетрон у загальній дозі 8 мг. Оперативні втручання проводилися під загальним знеболюванням з використанням інгаляційного анестетика севофлюрану й наркотичного анальгетика фентанілу (дозовано 3–5 мкг/кг/год) в умовах низькопотокової штучної вентиляції легень наркозно-дихальним апаратом Dräger Fabius Tiro (Dräger, Germany). Індукцію наркозу здійснювали пропофолом з розрахунку 1,5–2,5 мкг/кг. Як м’язовий релаксант використовувався атракуріуму бесилат у загальноприйнятих дозах. Анестезіологічне забезпечення й періопераційна інтенсивна терапія проводилися згідно з Міжнародними стандартами безпечної анестезіологічної практики WFSA (World Federation Of Societies of Anesthesiologists, 2010). За 20 хв до пробудження внутрішньовенно вводили 50 мг декскетопрофену і далі, після закінчення операції, у тій же дозі через 8 год. Моніторинг інтраперитонеального й екстраперитонеального тиску проводився монітором хірургічного інсуфлятора вуглекислого газу (СО2). Вентиляційні показники, газовий склад дихальної суміші, який включав і PetCO2, показники серцево-судинної системи, температура тіла, нервово-м’язова провідність і глибина наркозу контролювалися вбудованим монітором наркозно-дихального апарата Dräger Fabius Tiro і біомонітором Infinity Delta (Dräger, Germany). Газовий склад і кислотно-лужний стан артеріальної крові визначали аналізатором Cobas b 221 (Roche Diagnostics GmbH, Germany, Austria). Показники центральної гемодинаміки контролювалися безперервним розрахунковим методом esCCO, який є високоточним і дає змогу отримувати дані, максимально наближені до дійсних, у режимі реального часу біомонітором Life Scope PVM-2701, Nihon Konden (Japan, Europe GmbH). Усім пацієнтам визначали середній артеріальний тиск (Mean Blood Pressure, MBP), серцевий індекс (Cardiac Index, CI), доставку кисню (Oxygen Delivery, DO2), споживання кисню (Oxygen Uptake, VO2), коефіцієнт екстракції кисню (Oxygen Extraction Ratio, O2ER), дихальний коефіцієнт (Respiratory quotient, RQ — відношення видаленого вуглекислого газу до спожитого кисню) і дихальний об’єм (Tidal volume, TV). Під час штучної вентиляції легень дихальний об’єм підтримувався на рівні 6–8 мл/кг ідеальної маси тіла (ІМТ). Частота дихання коливалась у межах 12–18 дих/хв, що разом з дихальним об’ємом підтримувало цільові значення PetCO2 у межах 35–37 мм рт.ст. Інтраабдомінальний тиск в групі І становив ≤ 16 мм рт.ст., екстраперитонеальний тиск у групі ІІ — 17–19 мм рт.ст. Етапи обстеження: 1-й етап — вихідні дані, 2-й — відразу після індукції та накладання пневмоперитонеуму, 3-й етап — 30 хв, 4-й етап — 60 хв, 5-й етап — 90 хв, 6-й етап — 120 хв, 7-й етап — 150 хв.
Для отримання вентиляційних показників і газового складу дихальної суміші на першому етапі обстеження разом з наркозно-дихальним апаратом використовувалася герметична вентиляційна лицева маска.
Статистичне опрацювання результатів здійснювали за допомогою пакета програм MedStat v. 4 (ліцензійний № MS 000020). Використовуючи вказаний програмний пакет, перевірили отримані кількісні параметри й підтвердили їх відповідність закону нормального розподілу Гауса за критерієм Шапіро — Уїлка. Маючи нормальний розподіл значень параметрів, визначали середнє арифметичне значення (М) і його стандартну похибку (m). Оцінювали значущість відмінностей показників за допомогою критеріїв Стьюдента (t). Для всіх видів аналізу критичний рівень значущості (p) становив < 0,05.
Результати та обговорення
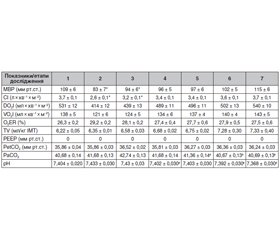
Результати дослідження наведені в табл. 1, 2.
На момент індукції наркозу, накладання карбоксиперитонеуму в групі І і екстраперитонеальної інсуфляції СО2 в групі ІІ в обох групах спостерігалось значуще зниження показників гемодинаміки, що, імовірно, було пов’язано з положенням пацієнта на операційному столі й гемодинамічним ефектом дії пропофолу. У групі І цьому, імовірно, сприяло ще й накладання карбоксиперитонеуму, що внаслідок компресії нижньої порожнистої вени й зниження венозного повернення крові до серця могло посилити вищевказані гемодинамічні зміни. Так, у групі І МВР знизився на 26 мм рт.ст. (23,9 %) і набув значення 83 ± 7 мм рт.ст., а в групі ІІ знизився на 18 мм рт.ст. (16,7 %) і набув значення 90 ± 6 мм рт.ст. Синхронно на цьому етапі в обох групах спостерігалось зниження серцевого індексу з переважанням змін у групі І. Так, СІ в групі І знизився на 29,7 % і набув значення 2,6 ± 0,1 л × хв–1 × м–2, а в групі ІІ, відповідно, на 16,7 % і набув значення 3,0 ± 0,2 л × хв–1 × м–2 (р < 0,05). Менш виражене зниження гемодинамічних показників у групі ІІ, ймовірно, пов’язане з відсутністю карбоксиперитонеуму, відповідно, і ефекту здавлювання порожнистої вени й зниження повернення венозної крові до серця. При цьому в обох групах унаслідок гемодинамічних порушень спостерігалося порушення кисневого режиму за рахунок зниження доставки та споживання кисню з більш вираженими проявами в групі І. Так, у групі І на момент індукції, накладання карбоксиперитонеуму й початку операції порівняно з вихідними значеннями DO2 знизилась на 117 мл × хв–1 × м–2 (22 %), а VO2 — на 17 мл × хв–1 × м–2 (12,3 %) при підвищенні показників екстракції кисню до 29,2 ± 0,2 %, що вказує на напруження кисневого режиму й відповідні ризики енергокисневого забезпечення при тривалому карбоксиперитонеумі. У групі ІІ зниження DO2 і VO2 було дещо менше: DO2 — на 86 мл × хв–1 × м–2 (16,3 %), VO2 — на 14 мл × хв–1 × м–2 (10,2 %) при нормальному значенні екстракції кисню (27,8 ± 0,2 %). Більш виражені порушення кисневого режиму в групі І, імовірно, були пов’язані з негативними проявами карбоксиперитонеуму, про які було сказано вище. Надалі в обох групах спостерігалось поступове відновлення показників гемодинаміки й кисневого режиму до їх вихідних значень (табл. 1, 2).
/27.jpg)
Динаміка показників вентиляції та кислотно-лужного стану (КЛС) пацієнтів групи I свідчать про поступове зростання TV. При цьому підвищення позитивного тиску наприкінці видиху (Positive End Expiratory Pressure, РЕЕР) практично не змінюється. Концентрація PetCO2 також практично не змінювалася, а PaCO2 дещо збільшувалася. Респіраторний ацидоз, що розвивався на 150-й хвилині операції, був субкомпенсованим (табл. 1).
Динаміка показників вентиляції і КЛС пацієнтів групи II свідчать про значно більше поступове зростання TV і РЕЕР, викликане діями анестезіолога. При цьому розвивається погано контрольована гіперкапнія вже через 30 хв після початку операції (табл. 2).
Встановлено, що при підвищенні інтраабдомінального тиску й екстраперитонеального тиску під час оперативного втручання зростала концентрація СО2 як в артеріальній крові, так і в суміші, що видихається. З негативних ефектів гіперкапнії на особливу увагу заслуговує респіраторний, а надалі — змішаний ацидоз. В обох групах під час операції підвищувалися TV, PaCO2, etCO2 (табл. 1). Однак це підвищення в групі I не було критичним і легко коригувалося протягом операції. Зміни показників у групі II були вірогідно вищими й вимагали ретельної корекції. Підвищення PetСО2, PaCO2, що вимагають корекції, у другій групі наставали вже через 30 хв після створення екстраперитонеального тиску. У групі I ці зміни розвиваються лише через 1,5 год після початку операції. У групі I зміни рН крові були відсутні, тоді як у групі II, незважаючи на активну корекцію газів крові, розвивався некомпенсований ацидоз. Причому респіраторний ацидоз протягом оперативного втручання трансформувався в некомпенсований змішаний ацидоз. Тому застосовувалася корекція 4,2% розчином соди-буфер. Дозу вираховували залежно від показників дефіциту баз (–ВЕ) за формулою: об’єм 0,5-молярного буферованого гідрокарбонату натрію 4,2 % у мл = –ВЕ × кг маси тіла хворого × 0,3 × 2 (фактор 0,3 відповідає частці позаклітинної рідини порівняно із загальною рідиною). Препарат сода-буфер створений за принципом бікарбонатного буфера крові, тому більш фізіологічний для організму й більш патогенетичний для корекції метаболічного ацидозу порівняно з препаратом соди.
У групі II відзначалося стійке зростання PetСО2, РаСО2, зниження рН з другої години, що потребувало відповідного менеджменту. І, незважаючи на корекцію, відзначалося наростання гіперкапнії і метаболічного ацидозу, який тривав ще кілька годин після операції.
Нами розроблена програма періопераційного менеджменту усунення гіперкапнії та її наслідків. Для цього застосовувалися безпечне збільшення дихального об’єму та частоти дихання, підвищення позитивного тиску наприкінці видиху, зміни співвідношення вдих/видих із 2 : 1 на 1 : 1. Незважаючи на заходи, повної компенсації процесів, що відбуваються, досягти не вдалося. Протягом усіх етапів дослідження відбувалося збільшення досліджуваних показників: дихального об’єму, позитивного тиску в кінці видиху, концентрації СО2 у суміші, яка видихається, та артеріальній крові.
Встановлено взаємозв’язок важелів менеджменту VT з концентрацією СО2 і рH артеріальної крові. При дослідженні взаємозв’язку між РаСО2 і рН крові встановлено сильний обернений кореляційний зв’язок (коефіцієнт парної кореляції Пірсона — 0,965), що показує механізм розвитку ацидозу і шляхи його корекції. Усе це підтверджує ефективність важелів менеджменту «технічної» гіперкарбії і зниження ризику метаболічного ацидозу. Розроблена нами програма періопераційного менеджменту усунення гіперкапнії і її наслідків дозволяє уникнути розвитку критичної гіперкапнії і критичного ацидозу, а також уникнути небезпечних ускладнень післяопераційного періоду.
Висновки
1. У I групі на момент індукції, накладання карбоксиперитонеуму й початку операції порівняно з вихідними значеннями знизились DO2 і VO2 при підвищенні показників екстракції кисню до 29,2 ± 0,2 %, що вказує на напруження кисневого режиму й відповідні ризики енергокисневого забезпечення при тривалому карбоксиперитонеумі.
2. У групі ІІ зниження DO2 і VO2 було дещо менше при нормальному значенні екстракції кисню (27,8 ± 0,2 %). Більш виражені порушення кисневого режиму в групі I, імовірно, були пов’язані з негативними проявами карбоксиперитонеуму. Надалі в обох групах спостерігалось поступове відновлення показників гемодинаміки й кисневого режиму до вихідних значень.
3. Встановлено, що при підвищенні інтраабдомінального й екстраперитонеального тиску під час оперативного втручання зростала концентрація СО2 як в артеріальній крові, так і в суміші, що видихається. З негативних ефектів гіперкапнії на особливу увагу заслуговує респіраторний, а надалі — змішаний ацидоз.
4. В обох групах під час операції підвищувалися TV, PaCO2, etCO2. Однак підвищення PetСО2, PaCO2 у групі I розвивалося лише через 1,5 год після початку операції, не було критичним і легко коригувалося протягом операції. У групі II підвищення PetСО2, PaCO2, що вимагають ретельної корекції, відбувалося вже через 30 хв після створення екстраперитонеального тиску.
5. Розроблена програма періопераційного менеджменту усунення гіперкапнії та її наслідків. Для цього застосовувалися безпечне збільшення дихального об’єму й частоти дихання, підвищення позитивного тиску наприкінці видиху, зміни співвідношення вдиху/видиху із 2 : 1 на 1 : 1.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Дана науково-дослідна робота виконується в рамках комплексної НДР «Оптимізація надання спеціалізованої та високоспеціалізованої медичної допомоги хірургічного профілю на принципах «хірургії швидкого шляху» при окремих захворюваннях щитоподібної та прищитоподібних залоз, носоглотки, внутрішніх і репродуктивних органів, черевної стінки, судин і суглобів, зокрема, з використанням атомно-силової мікроскопії та із застосуванням методу преламінації для обробки імплантів». Номер держреєстрації: 0119U001046. Джерело фінансування: Державний бюджет України.
Інформація про внесок кожного автора. В.І. Черній — методологічний супровід, остаточне затвердження статті, написання статті, редагування статті; А.І. Денисенко — концепція і дизайн дослідження, збір даних, аналіз та інтерпретація даних.
Отримано/Received 20.05.2022
Рецензовано/Revised 03.06.2022
Прийнято до друку/Accepted 10.06.2022

/27.jpg)