Журнал "Гастроэнтерология" Том 56, №3, 2022
Вернуться к номеру
Інсулінорезистентність та мікробні метаболіти кишечника при дитячому ожирінні
Авторы: Завгородня Н.Ю., Кленіна І.А., Татарчук О.М., Грабовська О.І., Петішко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Стаття присвячена вивченню вмісту фекальних коротколанцюгових жирних кислот (SCFA) та їх зв’язку з інсулінорезистентністю в дітей з ожирінням. Установлено, що кишкова мікрофлора в дітей з ожирінням характеризується змінами якісного складу та зростанням метаболічної активності кишкової мікрофлори. Помірне підвищення HOMA-IR супроводжується зростанням концентрації прозапальних цитокінів, уміст яких корелює з умістом оцтової, пропіонової кислот, та зниженням метаболічної активності кишкової мікрофлори. Прогресування інсулінорезистентності супроводжується подальшим зростанням концентрації прозапальних цитокінів, рівень HOMA-IR корелює з умістом пропіонової SCFA. Отже, модуляція вмісту SCFA може бути перспективним способом терапевтичного впливу з метою корекції інсулінорезистентності та ожиріння в дітей.
The article deals with the study on the content of fecal short-chain fatty acids (SCFA) and their association with insulin resistance in obese children. It was found that intestinal microflora in obese children is characterized by changes in the qualitative composition and increased metabolic activity of the intestinal microflora. A moderate increase of HOMA-IR is accompanied by elevated concentration of anti-inflammatory cytokines, the content of which correlates with that of acetic, propionic acid and a decrease in the metabolic activity of intestinal microflora. The progression of insulin resistance is accompanied by a further increase in the concentration of anti-inflammatory cytokines, the level of HOMA-IR correlates with the level of propionic SCFA. Thus, modulation of SCFA content may be a promising way of therapeutic influence to correct insulin resistance and obesity in children.
ожиріння; діти; кишкова мікробіота; інсулінорезистентність
obesity; children; intestinal microbiota; insulin resistance
Вступ
Матеріали та методи
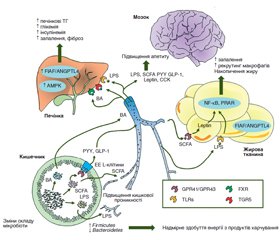
Результати
/53.jpg)
Обговорення
Висновки
- Obesity and overweight. https://www.who.int/news-room/fact-sheets/detail/obesity-and-overweight
- Horesh A., Tsur A.M., Bardugo A., Twig G. Adolescent and Childhood Obesity and Excess Morbidity and Mortality in Young Adulthood — a Systematic Review. Curr Obes Rep. 2021. Vol. 10(3). P. 301-310. doi: 10.1007/s13679-021-00439-9.
- Orsso C.E., Peng Y., Deehan E.C. et al. Composition and Functions of the Gut Microbiome in Pediatric Obesity: Relationships with Markers of Insulin Resistance. Microorganisms. 2021. Vol. 9(7). P. 1490. doi: 10.3390/microorganisms9071490.
- Turnbaugh P.J., Hamady M., Yatsunenko T. et al. A core gut microbiome in obese and lean twins. Nature. 2009. 457(7228). Р. 480-484. doi: 10.1038/nature07540.
- Turnbaugh P.J., Ridaura V.K., Faith J.J., Rey F.Е., Knight R., Gordon J.I. The effect of diet on the human gut microbiome: a metagenomic analysis in humanized gnotobiotic mice. Sci Transl Med. 2009. Vol. 1(6). Р. 6ra14. doi: 10.1126/scitranslmed.3000322.
- Bäckhed F., Ding H., Wang T. et al. The gut microbiota as an environmental factor that regulates fat storage. Proc Natl Acad Sci USA. 2004. Vol. 101(44). Р. 15718-23. doi: 10.1073/pnas.0407076101.
- Cani P.D., Van Hul M., Lefort C., Depommier C., Rastelli M., Everard A. Microbial regulation of organismal energy homeostasis. Nat Metab. 2019. Vol. 1(1). Р. 34-46. doi: 10.1038/s42255-018-0017-4.
- Bastos R.M.C., Rangel É.B. Gut microbiota-derived metabolites are novel targets for improving insulin resistance. World J Diabetes. 2022. Vol. 13(1). Р. 65-69. doi: 10.4239/wjd.v13.i1.65.
- Jang H.R., Lee H.Y. Mechanisms linking gut microbial metabolites to insulin resistance. World J Diabetes. 2021. Vol. 12(6). Р. 730-744. doi: 10.4239/wjd.v12.i6.730.
- Vrieze A., Van Nood E., Holleman F. et al. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. 2012. Vol. 143(4). Р. e913-e917.
- Zhang L., Ouyang Y., Li H., et al. Metabolic phenotypes and the gut microbiota in response to dietary resistant starch type 2 in normal-weight subjects: a randomized crossover trial. Scientific Reports. 2019. Vol. 9(1). Р. 4736. doi: 10.1038/s41598-018-38216-9.
- Sandberg J.C., Björck I.M.E., Nilsson A.C. Impact of rye-based evening meals on cognitive functions, mood and cardiometabolic risk factors: a randomized controlled study in healthy middle-aged subjects. Nutrition Journal. 2018. Vol. 17(1). Р. 102. doi: 10.1186/s12937-018-0412-4.
- Zhao L., Zhang F., Ding X. et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes. Science. 2018. Vol. 359(6380). Р. 1151-1156. doi: 10.1126/science.aao5774.
- Petraroli M., Castellone E., Patianna V., Esposito S. Gut microbiota and obesity in adults and children: The state of the art. Front Pediatr. 2021. Vol. 9. Р. 1-9. doi: 10.3389/fped.2021.657020.
- Zavhorodnia N.Yu., Lukianenko O.Yu., Klenina I.A., Hrabovska O.I., Tatarchuk O.M., Vishnarevska N.S. Assessment of the intestinal microbiota and fecal shortchain fatty acids content in children with nonalcoholicfatty liver disease. Гастроентерологія. 2020. Т. 54 (1). С. 56-62. doi: 10.22141/2308-2097.54.1.2020.199143.
- World Health Organization: Growth reference 5–19 years. BMI-for-age (5–19 years). URL: https://www.who.int/tools/growth-reference-data-for-5to19-years/indicators/bmi-for-age
- Gungor N., Saad R., Janosky J., Arslanian S. Validation of surrogate estimates of insulin sensitivity and insulin secretion in children and adolescents. The Journal of pediatrics. 2004. Vol. 144(1). Р. 47-55. https://doi.org/10.1016/j.jpeds.2003.09.045
- Shashaj B., Luciano R., Contoliet B. et al. Reference ranges of HOMA-IR in normal-weight and obese young Caucasians. Acta diabetologica. 2016. Vol. 53(2). Р. 251-260. https://doi.org/10.1007/s00592-015-0782-4
- Holmes Z.C., Silverman J.D., Dressman H.K., et al. Short-Chain Fatty Acid Production by Gut Microbiota from Children with Obesity Differs According to Prebiotic Choice and Bacterial Community Composition. mBio. 2020. Vol. 11(4). Р. 00914-20. doi: 10.1128/mBio.00914-20.
- Turnbaugh P.J., Ley R.E., Mahowald M.A., Magrini V., Mardis E.R., Gordon J.I. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006. Vol. 444(7122). Р. 1027-1031. doi: 10.1038/nature05414.
- Fei N., Zhao L. An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice. ISME J. 2013. Vol. 7(4). Р. 880-884. doi: 10.1038/ismej.2012.153.
- Gawlik A., Salonen A., Jian C. et al. Personalized approach to childhood obesity: Lessons from gut microbiota and omics studies. Narrative review and insights from the 29th European childhood obesity congress. Pediatr Obes. 2021. Vol. 16(10). Р. e12835. doi: 10.1111/ijpo.12835.
- Breton J., Galmiche M., Déchelotte P. Dysbiotic Gut Bacteria in Obesity: An Overview of the Metabolic Mechanisms and Therapeutic Perspectives of Next-Generation Probiotics. Microorganisms. 2022. Vol. 10(2). Р. 452. doi: 10.3390/microorganisms10020452.
- Baranowski T., Motil K.J. Simple Energy Balance or Microbiome for Childhood Obesity Prevention? Nutrients. 2021. Vol. 13(8). Р. 2730. doi: 10.3390/nu13082730.
- Alcazar M., Escribano J., Ferré N. et al. Gut microbiota is associated with metabolic health in children with obesity. Clin Nutr. 2022. Vol. 41(8). Р. 1680-1688. doi: 10.1016/j.clnu.2022.06.007.
- Le Chatelier E., Nielsen T., Qin J. et al. Richness of human gut microbiome correlates with metabolic markers. Nature. 2013. Vol. 500. Р. 541-546. doi: 10.1038/nature12506.
- Barczyńska R., Litwin M., Sliżewska K. et al. Bacterial Microbiota and Fatty Acids in the Faeces of Overweight and Obese Children. Pol J Microbiol. 2018. Vol. 67(3). Р. 339-345. doi: 10.21307/pjm-2018-041.
- Riva A., Borgo F., Lassandro C. et al. Pediatric obesity is associated with an altered gut microbiota and discordant shifts in Firmicutes populations. Environ Microbiol. 2017. Vol. 19. Р. 95-105. 10.1111/1462-2920.13463
- Murugesan S., Ulloa-Martínez M., Martínez-Rojano H. et al. Study of the diversity and short-chain fatty acids production by the bacterial community in overweight and obese Mexican children. Eur J Clin Microbiol Infect Dis. 2015. Vol. 34(7). Р. 1337-1346. doi: 10.1007/s10096-015-2355-4.
- Wei Y., Liang J., Su Y. et al. The associations of the gut microbiome composition and short-chain fatty acid concentrations with body fat distribution in children. Clin Nutr. 2021. Vol. 40(5). Р. 3379-3390. doi: 10.1016/j.clnu.2020.11.014.
- Nandy D., Craig S.J.C., Cai J. et al. Metabolomic profiling of stool of two-year old children from the INSIGHT study reveals links between butyrate and child weight outcomes. Pediatr Obes. 2022. Vol. 17(1). Р. e12833. doi: 10.1111/ijpo.12833.
- Gyarmati P., Song Y., Dotimas J., Yoshiba G., Christison A. Cross-sectional comparisons of gut microbiome and short-chain fatty acid levels among children with varied weight classifications. Pediatr Obes. 2021. Vol. 16(6). Р. e12750. doi: 10.1111/ijpo.12750.
- Jaimes J.D., Slavíčková A., Hurych J. et al. Stool metabolome-microbiota evaluation among children and adolescents with obesity, overweight, and normal-weight using 1H NMR and 16S rRNA gene profiling. PLoS One. 2021. Vol. 16(3). Р. e0247378. doi: 10.1371/journal.pone.0247378.
- Cho I., Yamanishi S., Cox L. et al. Antibiotics in early life alter the murine colonic microbiome and adiposity. Nature. 2012. Vol. 488(7413). Р. 621-6. doi: 10.1038/nature11400.
- Houtman T.A., Eckermann H.A., Smidt H., de Weerth C. Gut microbiota and BMI throughout childhood: the role of firmicutes, bacteroidetes, and short-chain fatty acid producers. Sci Rep. 2022. Vol. 12(1). Р. 3140.
- Huang L., Thonusin C., Chattipakorn N., Chattipakorn S.C. Impacts of gut microbiota on gestational diabetes mellitus: a comprehensive review. Eur J Nutr. 2021. Vol. 60(5). Р. 2343-2360. doi: 10.1007/s00394-021-02483-6.
- Wu H., Tremaroli V., Schmidt C., et al. The Gut Microbiota in Prediabetes and Diabetes: A Population-Based Cross-Sectional Study. Cell Metab. 2020. Vol. 32(3). Р. 379-390.e3. doi: 10.1016/j.cmet.2020.06.011
- Vitale M., Giacco R., Laiola M. et al. Acute and chronic improvement in postprandial glucose metabolism by a diet resembling the traditional Mediterranean dietary pattern: Can SCFAs play a role? Clin Nutr. 2021. Vol. 40(2). Р. 428-437. doi: 10.1016/j.clnu.2020.05.025
- Vetrani C., Costabile G., Luongo D., et al. Effects of whole-grain cereal foods on plasma short chain fatty acid concentrations in individuals with the metabolic syndrome. Nutrition. 2016. Vol. 32(2). Р. 217-221. doi: 10.1016/j.nut.2015.08.006.
- Sanna S., van Zuydam N.R., Mahajan A., et al. Causal relationships among the gut microbiome, short-chain fatty acids and metabolic diseases. Nat Genet. 2019. Vol. 51(4). Р. 600-605. doi: 10.1038/s41588-019-0350-x.
- Jia Z., Chen X., Chen J., et al. ACSS3 in brown fat drives propionate catabolism and its deficiency leads to autophagy and systemic metabolic dysfunction. Clin Transl Med. 2022. Vol. 12(2). Р. e665. doi: 10.1002/ctm2.665.
- Heimann E., Nyman M., Degerman E. Propionic acid and butyric acid inhibit lipolysis and de novo lipogenesis and increase insulin-stimulated glucose uptake in primary rat adipocytes. Adipocytes. 2015. Vol. 4(2). Р. 81-88. doi: 10.4161/21623945.2014.960694.
- Natrus L.V., Osadchuk Y.S., Lisakovska O.O., Labudzinskyi D.O., Klys Y.G., Chaikovsky Y.B. Effect of Propionic Acid on Diabetes-Induced Impairment of Unfolded Protein Response Signaling and Astrocyte/Microglia Crosstalk in Rat Ventromedial Nucleus of the Hypothalamus. Neural Plast. 2022. Vol. 2022. Р. 6404964. doi: 10.1155/2022/6404964.
- Liu J.L., Segovia I., Yuan X.L., Gao Z.H. Controversial Roles of Gut Microbiota-Derived Short-Chain Fatty Acids (SCFAs) on Pancreatic β-Cell Growth and Insulin Secretion. Int J Mol Sci. 2020. Vol. 21(3). Р. 910. doi: 10.3390/ijms21030910.
- Musso G., Gambino R., Cassader M. Obesity, diabetes, and gut microbiota: the hygiene hypothesis expanded? Diabetes Care. 2010. Vol. 33(10). Р. 2277-2284.
- Eslick S., Thompson C., Berthon B., Wood L. Short-chain fatty acids as anti-inflammatory agents in overweight and obesity: a systematic review and meta-analysis. Nutr Rev. 2022. Vol. 80(4). Р. 838-856. doi:10.1093/nutrit/nuab059.
- Salazar J., Angarita L., Morillo V. et al. Microbiota and Diabetes Mellitus: Role of Lipid Mediators. Nutrients. 2020. Vol. 12(10). Р. 3039. doi: 10.3390/nu12103039.
- Mattace Raso G., Simeoli R., Russo R., et al. Effects of sodium butyrate and its synthetic amide derivative on liver inflammation and glucose tolerance in an animal model of steatosis induced by high fat diet. PLoS ONE. 2013. Vol. 8(7). Р. e68626.

/53_2.jpg)
/54.jpg)
/55.jpg)