Вступ
Грижа стравохідного отвору діафрагми (ГСОД) — хронічне рецидивуюче захворювання, яке виникає зі зміщенням в грудну порожнину через стравохідний отвір діафрагми абдомінального відділу стравоходу, кардії, верхнього відділу шлунка, рідше — петель кишечника. Згідно з клінічними рекомендаціями EAES (European Association of Endoscopic Surgery) 2014 року, ГСОД зустрічаються у 80–90 % хворих із гастроезофагеальною рефлюксною хворобою [1]. Хворим із ГСОД показане оперативне лікування, золотим стандартом якого є лапароскопічна крурорафія та фундоплікація за Ніссеном, нерідко із застосуванням сітчастих імплантатів [1–3]. У більшості пацієнтів із ГСОД показання до хірургічного лікування виникають через появу супутніх симптомів, які можуть призвести до серйозних ускладнень або навіть летального результату (задишка, аспірація, рецидивна анемія, підвищений ризик механічних ускладнень — заворот і защемлення шлунка) [4]. Загальна анестезія з ендотрахеальною інтубацією та керованою вентиляцією легенів найбільше відповідає загальним вимогам, закладеним в основних принципах ERAS (Enhanced Recovery After Surgery — прискорене відновлення після операції), а тому вона показана при лапароскопічних оперативних втручаннях при ГСОД [5]. Останніми роками стала очевидною перевага інгаляційних методів загальної анестезії над внутрішньовенними за рахунок оптимальної керованості глибини наркозу, позбавлення депресивного впливу на системи життєзабезпечення, низької токсичності та екологічної безпеки [6]. Враховуючи ще й упровадження нових анестезіологічних технологій («Low flow anesthesia» та «Minimal flow anesthesia»), вони виявилися найбільш ефективними та максимально прийнятними при таких оперативних втручаннях [7, 8]. Проте низка авторів вказує на відсутність клінічно значимих переваг використання внутрішньовенної чи інгаляційної анестезії при хірургічних втручаннях, про що дискусії ведуться до сьогодні [9]. Особливості лапароскопічних технологій, використання карбоксиперитонеуму, специфічні «круті» положення тіла пацієнта на операційному столі, нерідко тривалість операційних втручань висувають свої вимоги до їх анестезіологічного забезпечення та періопераційної інтенсивної терапії [1, 3, 4, 10]. При цьому низка авторів вказують на те, що рівень періопераційної енергопродукції та енергозабезпечення відіграє важливу роль у безпеці всіх періопераційних анестезіологічних та хірургічних технологій [11–13]. Раніше нами були отримані дані про позитивний вплив глюкокортикоїдів на метаболізм, зокрема в пацієнтів із вторинним гіперпаратиреозом, та необхідність проведення періопераційного енергомоніторингу, що підвищувало безпеку операційних втручань у таких пацієнтів [14].
Враховуючи вищевказане, анестезіологічне забезпечення та періопераційна інтенсивна терапія в пацієнтів із ГСОД потребують досконалого вивчення періопераційного метаболізму та можливості використання персоніфікованого енергомоніторингу в періопераційному менеджменті таких пацієнтів.
Мета дослідження — вивчити періопераційний метаболізм у пацієнтів із ГСОД та оцінити можливості використання персоніфікованого енергомоніторингу в періопераційному менеджменті таких пацієнтів.
Матеріали та методи
Дослідження виконане на базі хірургічного центру Державної наукової установи «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами м. Києва відповідно до стандартів належної клінічної практики (Good Clinical Practice) і принципів Гельсінської декларації, із використанням лабораторно-технічних можливостей установи. Усі пацієнти давали усну та письмову добровільну інформовану згоду на проведення обстеження, аналізів, лікування, виконання операції, знеболювання та обробку отриманих даних. Дозвіл на проведення дослідження та протокол дослідження був схвалений комісією з питань біоетики установи.
Дослідження було проспективним нерандомізованим. У групу дослідження увійшли 132 пацієнти із ГСОД, яким проводились лапароскопічні крурорафії з фундоплікацією за Ніссеном. Вік хворих — 32–77 років, функціональний клас за ASA — II–IІІ. Чоловіків було 64 (48,5 %) та 68 (51,5 %) жінок. У 45 (34,1 %) пацієнтів були супутні захворювання (переважно серця, судин та шлунково-кишкового тракту). У 19 (14,4 %) пацієнтів у процесі передопераційного обстеження були виявлені супутні захворювання, які потребовували додаткового хірургічного лікування. Так, у 12 (9,1 %) пацієнтів додатково була виконана лапароскопічна холецистектомія, у 7 (5,3 %) — протезуюча герніопластика з приводу пупкової і пахової грижі. Середня тривалість операції 169,5 хв. Безпосередньо перед операцією внутрішньовенно вводили цефтріаксон 2 г, фентаніл 0,1 мг. Крім того, внутрішньовенно краплинно здійснювали інфузію 1000 мг розчину парацетамолу. З метою запобігання нудоті та блюванню в ранньому післяопераційному періоді перед оперативним втручанням призначали селективний антагоніст 5НТ3-серотонінових рецепторів ондансетрон у загальній дозі 8 мг. Оперативні втручання проводилися під загальним знеболюванням із використанням інгаляційного анестетика севофлюрану та наркотичного анальгетика фентанілу (дозовано 3–5 мкг/кг/год) в умовах низькопотокової штучної вентиляції легенів наркозно-дихальним апаратом Dräger Fabius Tiro (Dräger, Німеччина) згідно з Міжнародними стандартами безпечної анестезіологічної практики WFSA (World Federation Of Societies of Anesthesiologists, 2010). Індукцію наркозу здійснювали пропофолом із розрахунку 1,5–2,5 мкг/кг. Як м’язовий релаксант використовувався атракуріуму бесилат у загальноприйнятих дозах. Під час штучної вентиляції легень дихальний об’єм (Tidal volume, TV) підтримувався на рівні 6–8 мл/кг ідеальної маси тіла. FiO2 = 60 %. Частота дихання коливалась у ме–жах 12–18 дих/хв, що разом із TV підтримувало цільові значення парціального тиску газової суміші на видиху (PetCO2) у межах 35–37 мм рт.ст. У випадку появи та зростання гіперкапнії додатково використовували позитивний тиск у кінці видиху та зміну співвідношення вдих/видих із 2 : 1 на 1 : 1. Протягом оперативного втручання інтраабдомінальний тиск становив ≤ 16 мм рт.ст. За 20 хвилин до пробудження внутрішньовенно вводили 50 мг декскетопрофену і далі, після закінчення операції, у тій же дозі через 8 годин.
Моніторинг температури тіла, показників вентиляції легенів, газового складу дихальної суміші, середнього артеріального тиску (Mean Blood Pressure, MBP), нервово-м’язової провідності та глибини наркозу виконували вбудованим монітором наркозно-дихального апарату та біомонітором Infinity Delta (Dräger, Німеччина). Серцевий індекс (Cardiac Index, CI) контролювали безперервним розрахунковим методом esCCO біомонітором «Life Scope» PVM-2701, NIHON KONDEN (Europe GmbH, Японія). Показники кисневого режиму та періопераційного енергомоніторингу визначали за комп’ютерним алгоритмом на спеціальному пристрої під «Anroid 5», використовуючи біомонітор Infinity Delta та дихальний контур наркозно-дихального апарата. Під час визначення вихідних значень перед оперативним втручанням додатково використовувалася герметична лицева маска разом із дихальним контуром наркозно-дихального апарата. При цьому визначалися доставка кисню (Oxygen Delivery, DO2), споживання кисню (Oxygen Uptake, VO2), коефіцієнт екстракції кисню (Oxygen Extraction Ratio, O2ER) та дихальний коефіцієнт (Respiratory quotient, RQ — відношення видаленого вуглекислого газу до спожитого кисню). Газовий склад та кислотно-лужний стан крові визначали аналізатором Cobas b 221 (Roche Diagnostics GmbH, Німеччина, Австрія). Усім пацієнтам разом із загальноприйнятим періопераційним моніторингом додатково проводився енергомоніторинг із використанням непрямої калориметрії та визначенням поточного метаболізму (Metabolic Rate, MR, кал × × хв–1 × м–2), який порівнювали з вихідними значеннями та базальним метаболізмом (BMR, кал × хв–1 × м–2) [15]. Пацієнти були розподілені на дві групи. Групу І (n = 66) становили пацієнти, у яких проводився неперсоніфікований енергомоніторинг (без визначення цільового метаболізму та порушень метаболізму) [15], а періопераційна інтенсивна терапія була спрямована на підтримку та корекцію основних показників життєво важливих функцій (WFSA, 2010) з урахуванням поточного метаболізму. Група ІІ (n = 66) відрізнялась тим, що у ній проводився персоніфікований енергомоніторинг із додатковим урахуванням цільового метаболізму (Target Metabolic Rate, TMR, кал × хв–1 × м–2) та тяжкості порушення метаболізму (Metabolic Disordes, MD, %) [14]. Основним напрямком періопераційної інтенсивної терапії в групі ІІ була корекція метаболізму за рахунок оптимізації показників вентиляції, газообміну, гемодинаміки, кислотно-лужного стану крові та використання глюкокортикоїдів з урахуванням динаміки метаболізму та визначення цільових його значень, тяжкості їх порушень у режимі реального часу. Із моменту зворотного положення Тренделенбурга, накладання пневмоперитонеуму, початку оперативного втручання і до завершення основного етапу оперативного втручання (крурорафія і фундоплікація) у хворих посилювалась інфузійна терапія збалансованими сольовими розчинами та в/в краплинно вводилося 125–250 мг преднізолону (солу-медрол) під контролем поточного, цільового метаболізму, із наступним визначенням та оцінкою рівня метаболічних порушень (MD). У випадках зниження MR та росту TMR відносно вихідних значень, особливо при значеннях поточного метаболізму, близьких до базального рівня та нижчих, додатково вводився в/в гідрокортизон (солу-кортеф) 125–250 мг.
Етапи дослідження включали вихідні дані перед операцією (1-й етап), індукцію в наркоз (2-й етап), зворотне положення Тренделенбурга тіла пацієнта на операційному столі, пневмоперитонеум та початок операції (3-й етап), крурорафію і фундоплікацію (4-й етап), відновлення горизонтального положення тіла та ушивання післяопераційної рани (5-й етап), кінець операції (6-й етап), пробудження та транспортування в палату (7-й етап). У післяопераційному періоді у всіх пацієнтів оцінювали швидкість пробудження після закінчення операції за часом (у хвилинах): початок спонтанного розплющування очей (СРО), відновлення свідомості (ВС), екстубація трахеї (ЕТ) та готовність до переведення у палату (ГПВП) при 10 балах за шкалою післяопераційного відновлення Aldrete, інцидентність післяопераційної нудоти та блювання (ПОНБ). Оцінку післяопераційного знеболювання проводили за візуально-аналоговою шкалою (ВАШ) оцінки болю відразу після пробудження (1-й етап), через 3 години (2-й етап), через 6 годин (3-й етап), через 12 годин (4-й етап) та через 24 години (5-й етап).
Статистичне опрацювання результатів здійснювали за допомогою пакета програм Statistica v.64 (ліцензійний номер 12334567). Використовуючи вказаний програмний пакет, отримані кількісні параметри перевірили та підтвердили їх відповідність закону нормального розподілу Гауса за критерієм Шапіро — Уїлка. Маючи нормальний розподіл значень параметрів, визначали середнє арифметичне значення (М) і його стандартну похибку (m). Оцінювали значущість відмінностей показників за допомогою критеріїв Стьюдента (t). Для всіх видів аналізу критичний рівень значущості (p) становив < 0,05.
Результати та обговорення
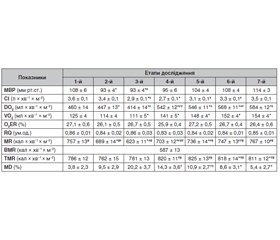
Результати дослідження наведені в табл. 1 і 2. Вихідні показники метаболізму в обох групах були без порушення і значно перевищували базальний рівень (у групі І — на 30 %, 755 ± 11 кал × хв–1 × м–2, у групі ІІ — на 29 %, 757 ± 13 кал × хв–1 × м–2). Вихідні показники метаболізму в обох групах значуще не відрізнялись один від одного (у групі І — 755 ± 11 кал × хв–1 × м–2 та у групі ІІ — 757 ± 13 кал × хв–1 × м–2), що свідчило про одинакові умови їх енергоутворення та енергозабезпечення, чому відповідає відсутність відмінностей рівня споживання кисню (123 ± 6 мл × хв–1 × м–2 у групі І і 125 ± 4 мл × хв–1 × м–2 у групі ІІ) та доставки кисню (468 ± 11 мл × хв–1 × м–2 у групі І та 460 ± 14 мл × хв–1 × м–2 у групі ІІ) при референтних значеннях коефіцієнта екстракції кисню (р < 0,05). При цьому рівень метаболізму в групі І перевищував базальний рівень на 174 (30 %) кал × хв–1 × м–2, а в групі ІІ — на 170 (29 %) кал × хв–1 × м–2 (р < 0,05). В обох групах на етапі індукції наркозу, зворотного положення Тренделенбурга тіла пацієнта на операційному столі, пневмоперитонеуму та початку операції спостерігалось зниження показників гемодинаміки та порушення кисневого режиму (табл. 1, 2).
/13.jpg)
Так, у групі І на момент індукції МВР знизився на 19 мм рт.ст. (17,9 %) і набув значення 87 мм рт.ст., продовжував знижуватися до закінчення етапу накладання пневмоперитонеуму та початку операції до 80 мм рт.ст., що було на 26 мм рт.ст. (24,5 %) нижче від вихідних значень (р < 0,05). При цьому СІ на момент індукції знизився на 25 %, при зворотному положенні Тренделенбурга тіла пацієнта та накладанні пневмоперитонеуму — на 41,7 %, на момент початку операції набув значення 2,1 ± 0,1 л × хв–1 × м–2 (р < 0,05). Що стосується доставки та споживання кисню, то при зворотному положенні Тренделенбурга та накладанні пневмоперитонеуму й початку операції вони знижувалися синхронно з показниками гемодинаміки. Так, порівняно з вихідними значеннями DO2 знизилась на 112 мл × хв–1 × м–2 (23,9 %), а VO2 — на 11 мл × хв–1 × м–2 (8,9 %) при, ймовірно, компенсаторному підвищенні показників екстракції кисню до 31,5 ± 0,4 %, що свідчить про незбалансованість енергокисневого забезпечення й рівня його потреби на даному етапі оперативного втручання (р < 0,05). Цьому відповідає і зниження RQ до 0,8 як показника збалансованості всіх процесів метаболізму, який залишався таким і на етапі крурорафії та фундоплікації. У групі ІІ зміни гемодинаміки на цих етапах були менш значними. Так, МВР на момент індукції порівняно з вихідними значеннями знизився на 15 мм рт.ст. (13,9 %) і залишався таким на етапі зворотного положення Тренделенбурга тіла, накладання пневмоперитонеуму та початку операції (р < 0,05). СІ на етапі індукції значуще не відрізнявся від вихідного значення, а на етапі зворотного положення Тренделенбурга тіла, накладання пневмоперитонеуму та початку операції знизився на 19,4 % та мав значення 2,9 л × хв–1 × м–2), що було вище, ніж у групі І (р < 0,05). Зміни доставки та споживання кисню на цих етапах теж були менш значними, ніж у групі І. Так, на етапі зворотного положення Тренделенбурга, накладання пневмоперитонеуму і початку операції порівняно з вихідними значеннями DO2 знизилась на 46 мл × хв–1 × м–2 (10 %), а VO2 — на 14 мл × хв–1 × м–2 (11,2 %) (р < 0,05) при збереженні референтних значень екстракції кисню (О2ER = 26,7 ± 0,5 %). Метаболізм в обох групах на цих етапах дослідження знижувався з перевагою змін у групі І. Так, у цій групі на етапі індукції він знизився на 101 кал × хв–1 × м–2 (13,4 %), а в групі ІІ — на 68 кал × хв–1 × м–2 (9 %) порівняно з вихідним значенням. На етапі зворотного положення Тренделенбурга, накладання пневмоперитонеуму і початку операції метаболізм в обох групах мав значення, близькі до базальних. Так, у групі І він знизився на 25,6 % та мав значення 562 ± 12 кал × хв–1 × м–2, а в групі ІІ — на 17,7 % та мав значення 623 ± 11 кал × хв–1 × м–2 (р < 0,05). У пацієнтів групи І спостерігалось повільне відновлення метаболізму, значення якого на момент пробудження лишалось на 8,2 % нижчим від вихідного (р < 0,05). Слід сказати, що у групі ІІ на етапі індукції спостерігалось синхронне зростання тяжкості метаболічних порушень із 3,8 ± 2,3 % до 9,5 ± 2,9 %. А на етапі зворотного положення Тренделенбурга, накладання пневмоперитонеуму й початку операції — уже суттєве порушення метаболізму (20,2 ± 3,7 %) на фоні зростання цільового його значення (781 ± 13 кал × хв–1 × м–2), що потребувало використання вищеописаних дій періопераційного менеджменту, включаючи і глюкокортикостероїди. З моменту виконання крурорафії та фундоплікації в обох групах спостерігались стабілізація та зростання показників гемодинаміки, із перевагою в групі ІІ. Так, у групі І відновлення всіх показників гемодинаміки до рівня вихідних значень настало лише на момент закінчення операції та повного пробудження. У групі ІІ з моменту відновлення горизонтального положення пацієнтів та ушивання рани спостерігалось стійке зростання СІ до 3,1 ± 0,1 л × хв–1 × м–2, а на етапі закінчення операції та пробудження відповідно набуло значення 3,3 ± 0,1 л × хв–1 × м–2 і 3,5 ± 0,1 л × хв–1 × м–2, що значуще не відрізнялось від вихідних (р < 0,05). Що стосується доставки та споживання кисню, то на цих етапах дослідження вони стійко зростали, із перевагою змін у групі ІІ, на момент пробудження перевищували вихідні значення відповідно DO2 у групі І — на 59 мл × хв–1 × м–2 (12,7 %), у групі ІІ — на 124 мл × хв–1 × м–2 (27 %), VO2 у групі І — на 21 мл × хв–1 × м–2 (17,2 %), у групі ІІ — на 29 мл × хв–1 × м–2 (23,2 %) (р < 0,05). При цьому коефіцієнт екстракції кисню в обох групах був у межах референтних значень, що свідчило про відновлення кисневого режиму. На етапі пробудження метаболізм у групі І на тлі поступового зростання наближався до вихідного значення, залишаючись на 62 кал × хв–1 × м–2 (8,2 %) нижчим від його значення (р < 0,05). У пацієнтів групи ІІ на фоні посиленої інфузійної терапії та введення глюкокортикоїдів відновлення поточного метаболізму було більш інтенсивним, зі зниженням метаболічних порушень до безпечного рівня (5,4 ± 2,7 %) та повного відновлення до вихідних значень (р < 0,05).
Стосовно пробудження пацієнтів варто звернути увагу на те, що в групі ІІ вони швидше пробуджувалися після наркозу та переводилися з операційної в палату після закінчення оперативного втручання (табл. 3).
/14.jpg)
Випадки післяопераційної нудоти та блювання в групі ІІ траплялися в 2,2 раза рідше: 5 (7,6 %) проти 11 (16,7 %) у групі І, що потребувало додаткового введення селективного антагоніста 5НТ3-серотонінових рецепторів ондансетрону в загальній дозі 8–16 мг (р < 0,05). Аналізуючи періопераційний перебіг пацієнтів, слід сказати, що в групі ІІ він був більш стабільний та прогнозований, ніж у групі І. Ми вважаємо, що це пов’язане з проведенням динамічного персоніфікованого періопераційного енергомоніторингу й контрольованою підтримкою оптимальних, максимально близьких до цільових значень метаболізму та мінімальними його порушеннями завдяки поліпшенню показників гемодинаміки і, відповідно, доставки кисню та оптимізації кисневого стану за рахунок своєчасного посилення інфузійної терапії, особливо на етапі зворотного положення Тренделенбурга, накладання пневмоперитонеуму і початку операції, коли венозне повернення крові до правих відділів серця знижувалось, а також використання глюкокортикоїдів.
Так, у пацієнтів групи II спонтанне розплющення очей, відновлення свідомості, екстубація трахеї та готовність до переводу в палату були швидшими, ніж у групі І, відповідно на 32,8; 35,4; 44,3 і 35,3 % (р < 0,05). При цьому післяопераційний біль, за даними ВАШ, у групі ІІ через 6 та 12 годин після пробудження був нижчим відповідно на 29 та 35,5 %, ніж в групі І (р < 0,05).
Висновки
1. Доведено, що пацієнти з грижею стравохідного отвору діафрагми під час лапароскопічних втручань мають суттєві порушення метаболізму, особливо на етапі зворотного положення Тренделенбурга, накладання пневмоперитонеуму та початку операції, коли метаболізм знижувався майже до базального рівня, що є обґрунтуванням необхідності цілеспрямованої його корекції з використанням персоніфікованого періопераційного енергомоніторингу.
2. Персоніфікований енергомоніторинг із додатковим урахуванням цільового метаболізму (Target Metabolic Rate, TMR, кал × хв–1 × м–2) та тяжкості порушення метаболізму (Metabolic Disordes, MD, %) дозволяє своєчасно коригувати порушення метаболізму за рахунок поліпшення показників гемодинаміки і, відповідно, доставки кисню та оптимізації кисневого стану за рахунок своєчасної корекції волемії та використання глюкокортикоїдів як адаптогену, особливо на найбільш стресорних етапах операції: етапі зворотного положення Тренделенбурга, накладання пневмоперитонеуму і початку операції.
3. Проведення динамічного періопераційного енергомоніторингу із своєчасною корекцією метаболізму дозволило пацієнтам швидше прокидатися після наркозу (спонтанне розплющення очей, відновлення свідомості, екстубація трахеї) та переводитися з операційної в палату після закінчення оперативного втручання. При цьому післяопераційний біль, за даними ВАШ, у групі ІІ через 6 та 12 годин після пробудження був нижчим, ніж у групі І.
Перспективи подальших досліджень. Необхідне подальше проведення досліджень рівня метаболізму, методів його корекції в пацієнтів із різноманітною хірургічною патологією при лапароскопічних хірургічних втручаннях із використанням пневмоперитонеуму, детальне вивчення предикативного значення рівня метаболізму, ступеня його порушень у періопераційному періоді, розвитку інтра- та післяопераційних ускладнень.
Інформація про фінансування. Дана науково-дослідна робота виконується в рамках комплексної НДР «Оптимізація надання спеціалізованої та високоспеціалізованої медичної допомоги хірургічного профілю на принципах «хірургії швидкого шляху» при окремих захворюваннях щитоподібної та прищитоподібних залоз, носоглотки, внутрішніх та репродуктивних органів, черевної стінки, судин і суглобів, зокрема, з використанням атомно-силової мікроскопії та із застосуванням методу преламінації для обробки імплантів». Номер держреєстрації 0119U001046. Джерело фінансування: Державний бюджет України.
Дотримання етичних норм. Автори дотримуються принципів, що містяться в Гельсінській декларації, а також в Міждисциплінарних принципах і керівних вказівках щодо використання тварин у дослідженнях, тестуванні та освіті, опублікованих Спеціальним комітетом з досліджень на тваринах при Нью-Йоркській академії наук. Робота з хворими людьми підготовлена і проведена відповідно до принципів етики.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 30.05.2022
Рецензовано/Revised 08.06.2022
Прийнято до друку/Accepted 15.06.2022

/13.jpg)
/14.jpg)