Журнал «Медицина неотложных состояний» Том 18, №5, 2022
Вернуться к номеру
Динаміка біохімічних маркерів рабдоміолізу при політравм
Авторы: Кріштафор Д.А., Клигуненко О.М., Кравець О.В., Єхалов В.В., Станін Д.М.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
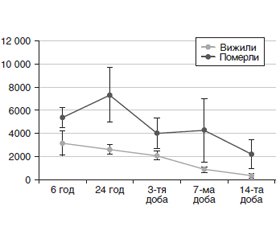
Актуальність. Травматичні ушкодження нерідко призводять до рабдоміолізу — руйнування м’язової тканини, що призводить до витоку внутрішньоклітинного вмісту міоцитів у кровоток. Окрім краш-синдрому, причинами травматичного рабдоміолізу можуть бути пряме пошкодження м’язів при масивних травмах кісток та м’яких тканин, м’язова гіпоксія на тлі краш-синдрому, синдрому системної запальної відповіді або гіповолемічного шоку, а також синдром позиційного стискання при тривалих операціях, агресивна та тривала ретракція м’яких тканин під час операцій, множинні та складні оперативні втручання та тривале використання турнікетів. Найбільш значущими біохімічними маркерами рабдоміолізу є креатинкіназа та міоглобін. Метою нашого дослідження було провести аналіз динаміки біохімічних маркерів рабдоміолізу у постраждалих із мирною та бойовою політравмою. Матеріали та методи. Обстежений 121 постраждалий із політравмою. Досліджувалися потреба в стимуляції діурезу та замісній нирковій терапії, рівні сечовини та креатиніну крові, рівні загальної креатинкінази (КК), КК-МВ та міоглобіну сироватки крові. Результати. Рівень загальної КК понад 5000 Од/л при надходженні корелював із летальністю. У постраждалих, які вижили, рівень загальної КК починав знижуватися через 24 години після травми та на 14-ту добу перевищував норму усього у 2 рази. У постраждалих, які померли, рівні КК залишалися на вихідному рівні або підвищувалися. Рівні КК-МВ не показали вірогідного зв’язку з летальністю, але у постраждалих із тяжкими бойовими травмами кінцівок, перенесеною масивною трансфузією та потребою в замісній нирковій терапії спостерігалося тривале та стійке підвищення цього показника. Вихідний рівень міоглобіну не мав кореляції з летальністю в подальшому, але в пацієнтів, які вижили, рівні сироваткового міоглобіну швидко знижувалися, тоді як у померлих залишалися на сталому рівні або підвищувалися повторно після деякого зниження. Рівні маркерів рабдоміолізу мали чіткий зв’язок із показниками функції нирок та потребою в стимуляції діурезу та/або замісній нирковій терапії, причому у КК та КК-МВ цей зв’язок формувався вже через 6 годин після надходження постраждалого до стаціонару, а в міоглобіну — із 3-ї доби. Склад поповнення травматичної крововтрати також впливав на показники маркерів рабдоміолізу. Об’єм введених у першу добу штучних колоїдів, СЗП та еритроцитів був прямо пов’язаний із рівнями КК, КК-МВ та міоглобіну на усіх етапах дослідження. Висновки. Таким чином, політравма з масивною крововтратою супроводжується рабдоміолізом, вираженість якого залежить від тяжкості травми, та є предиктором гострого пошкодження нирок та летальності. Відсутність зниження рівнів КК та міоглобіну на тлі інтенсивної терапії є несприятливим прогностичним критерієм. У постраждалих із тяжкою політравмою рівні КК, КК-МВ та міоглобіну доцільно досліджувати в динаміці.
Background. Traumatic injuries often lead to rhabdomyolysis — the destruction of muscle tissue, which causes a leakage of intracellular myocytes into the bloodstream. In addition to the crush syndrome, the causes of traumatic rhabdomyolysis may be direct muscle damage in massive bone and soft tissue injuries, muscle hypoxia in crush syndrome, systemic inflammatory response syndrome or hypovolemic shock, positional compression syndrome in long surgeries, aggressive and prolonged soft tissue retraction during surgeries, multiple and complex surgical interventions and prolonged use of tourniquets. The most important biochemical markers of rhabdomyolysis are creatine kinase and myoglobin. The purpose of our study was to analyze the dynamics of biochemical markers of rhabdomyolysis in victims of peacetime and combat polytrauma. Materials and methods. One hundred and twenty-one multiple trauma victims were examined. We studied the need for diuresis stimulation and renal replacement therapy, levels of urea and blood creatinine, total creatine kinase (CK), CK-MB and serum myoglobin. Results. The content of total CK over 5,000 IU/l on admission correlated with mortality. In survivors, total CK level began to decrease 24 hours after the injury and on day 14 exceeded the norm by only 2 times. In the non-survivors, CK levels remained at baseline or increased. CK-MB levels were not associated with mortality, but long-term and sustained increase was observed in victims with severe combat injuries, massive transfusions, and the need for renal replacement therapy. Baseline myoglobin levels did not correlate with subsequent mortality, but in survivors, serum myoglobin levels declined rapidly, while in the non-survivors, they remained steady or re-increased after some reduction. Levels of rhabdomyolysis markers were clearly associated with renal function and the need for diuresis stimulation and/or renal replacement therapy, and for CK and CK-MB, this correlation was formed within 6 hours after admission, for myoglobin — from day 3. The composition of blood replacement also affected the markers of rhabdomyolysis. The volume of synthetic colloids, fresh frozen plasma, and erythrocytes administered on the first day was directly related to the levels of CK, CK-MB, and myoglobin at all stages of the study. Conclusions. Thus, multiple trauma with massive blood loss is accompanied by rhabdomyolysis the severity of which depends on the injury severity and is a predictor of acute kidney injury and mortality. The absence of a decrease in the levels of CK and myoglobin despite intensive care is an unfavorable prognostic criterion. In patients with severe multiple trauma, the levels of CK, CK-MB and myoglobin should be studied in dynamics.
політравма; рабдоміоліз; креатинкіназа; міоглобін; гостре пошкодження нирок
multiple trauma; rhabdomyolysis; creatine kinase; myoglobine; acute kidney injury
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- World Health Organization Fact Sheet: Injuries and violence. 2021. URL: https://www.who.int/news-room/fact-sheets/detail/injuries-and-violence
- Bosch X., Poch E., Grau J.M. Rhabdomyolysis and acute kidney injury. N. Engl. J. Med. 2009. Vol. 361(1). P. 62-72. doi: 10.1056/NEJMra0801327.
- Malinoski D.J., Slater M.S., Mullins R.J. Crush injury and rhabdomyolysis. Crit. Care Clin. 2004. Vol. 20. P. 171-192. doi: 10.1016/s0749-0704(03)00091-5.
- Gonzlez D. Crush syndrome. Crit. Care Med. 2005. Vol. 33. P. 34-41. doi: 10.1097/01.ccm.0000151065.13564.6f.
- Sousa A., Paiva J.A., Fonseca S. et al. Rhabdomyolysis: risk factors and incidence in polytrauma patients in the absence of major disasters. Eur. J. Trauma Emerg. Surg. 2013. Vol. 39. P. 131-137. doi: 10.1007/s00068-012-0233-7.
- Aujla R.S., Patel R. Creatine Phosphokinase. Treasure Island (FL): StatPearls Publishing; 2022. URL: https://www.ncbi.nlm.nih.gov/books/NBK546624/
- Aydin S., Ugur K., Aydin S., Sahin İ., Yardim M. Biomarkers in acute myocardial infarction: current perspectives. Vasc. Health Risk Manag. 2019. Vol. 15. P. 1-10. doi: 10.2147/VHRM.S166157.
- Rawson E.S., Clarkson P.M., Tarnopolsky M.A. Perspectives on Exertional Rhabdomyolysis. Sports Med. 2017. Vol. 47(Suppl 1). P. 33-49. doi: 10.1007/s40279-017-0689-z.
- Chavez L.O., Leon M., Einav S., Varon J. Beyond muscle destruction: a systematic review of rhabdomyolysis for clinical practice. Crit. Care. 2016. Vol. 20(1). P. 135. doi: 10.1186/s13054-016-1314-5.
- Longo T., Shaines M. Case Report: Exertional rhabdomyolysis in a spin class participant with sickle cell trait. F1000Res. 2018. Vol. 7. P. 1742. doi: 10.12688/f1000research.16326.2.
- Moghadam-Kia S., Oddis C.V., Aggarwal R. Approach to asymptomatic creatine kinase elevation. Cleve Clin. J. Med. 2016. Vol. 83(1). P. 37-42. doi: 10.3949/ccjm.83a.14120.
- Ordway G.A., Garry D.J. Myoglobin: an essential hemoprotein in striated muscle. J. Exp. Biol. 2004. Vol. 207(Pt 20). P. 3441-3446. doi: 10.1242/jeb.01172.
- Koch J., Lüdemann J., Spies R., Last M., Amemiya C.T., Burmester T. Unusual Diversity of Myoglobin Genes in the Lungfish. Mol. Biol. Evol. 2016. Vol. 33(12). P. 3033-3041. doi: 10.1093/molbev/msw159.
- Russell T.A. Acute renal failure related to rhabdomyolysis: pathophysiology, diagnosis, and collaborative management. Nephrol. Nurs. J. 2005. Vol. 32(4). P. 409-417.
- Chernecky C.C., Berger B.J. Myoglobin — serum. In: Chernecky C.C., Berger B.J., eds. Laboratory Tests and Diagnostic Procedures. 6th ed. St Louis, MO: Elsevier Saunders; 2013. P. 808-809.
- Zafar Gondal A., Foris L.A., Richards J.R. Serum Myoglobin. Treasure Island (FL): StatPearls Publishing; 2022. URL: https://www.ncbi.nlm.nih.gov/books/NBK470441/
- Кобеляцкий Ю.Ю., Царев А.В., Йовенко И.А. и др. Рабдомиолиз при минно-взрывной травме: современные принципы и собственный опыт интенсивной терапии. Медицина неотложных состояний. 2017. № 2(81). С. 128-134. doi: 10.22141/2224-0586.2.81.2017.99704.
- Nilsson A., Alkner B., Wetterlöv P., Wetterstad S., Palm L., Schilcher J. Low compartment pressure and myoglobin levels in tibial fractures with suspected acute compartment syndrome. BMC Musculoskelet Disord. 2019. Vol. 20(1). P. 15. doi: 10.1186/s12891-018-2394-y.
- Про затвердження стандартів та клінічних протоколів надання медичної допомоги зі спеціальності «Хірургія»: Наказ МОЗ України № 297 від 02.04.2010 [Електронний ресурс]. URL: http://www.moz.gov.ua/ua/portal/dn_20100402_297.html.
- Усенко Л.В., Царев А.В., Петров В.В., Кобеляцкий Ю.Ю. Современные принципы инфузионно-трансфузионной терапии кровопотери при политравме и протокол массивной гемотрансфузии. Гематология. Трансфузиология. Восточная Европа. 2016. Т. 2. № 1. С. 64-75.
- Соколов В.А. Множественные и сочетанные травмы. М.: ГЭОТАР-Медиа, 2006. 512 с.
- Про затвердження методик виконання вимірювань медико-біологічних показників: Наказ МОЗ № 417 від 15.11.2002 [Електронний ресурс]. URL: http://mozdocs.kiev.ua/view.php?id=1960.
- Клінічний протокол «Геморагічний шок в акушерстві»: Наказ МОЗ України від 24.03.14 № 205 [Електронний ресурс]. URL: http://www.moz.gov.ua/ua/portal/dn_20140324_0205.html.
- Rodríguez E., Soler M.J., Rap O., Barrios C., Orfila M.A., Pascual J. Risk factors for acute kidney injury in severe rhabdomyolysis. PLoS One. 2013. Vol. 8(12). P. e82992. doi: 10.1371/journal.pone.0082992.
- Luckoor P., Salehi M., Kunadu A. Exceptionally High Creatine Kinase (CK) Levels in Multicausal and Complicated Rhabdomyolysis: A Case Report. Am. J. Case Rep. 2017. Vol. 18. P. 746-749. doi: 10.12659/ajcr.905089.

/19.jpg)