Актуальність
Муковісцидоз (МВ) — це хронічне захворювання з автосомно-рецесивним типом успадкування, яке вражає переважно дихальні шляхи, підшлункову залозу, шлунково-кишковий тракт і печінку [1]. Прогноз захворювання у пацієнтів з МВ у переважній більшості випадків визначається тяжкістю перебігу хронічного бронхолегеневого запалення, що часто супроводжується різним ступенем обструкції дихальних шляхів [2]. Симптоми обструкції дихальних шляхів у хворих на МВ подібні до симптомів інших обструктивних захворювань легень, хоча основні механізми їх розвитку відрізняються [3]. Основними механізмами бронхіальної обструкції при МВ є порушення мукоциліарного кліренсу за рахунок збільшення в’язкості бронхіального секрету та підвищення його осмолярності, а також змінена реактивність бронхіального дерева через пошкоджений епітелій дихальних шляхів [4]. Гіперреактивність бронхів (ГРБ) — це надмірне звуження бронхів у відповідь на різноманітні інгаляційні подразники, як хімічні, так і фізичні. Тривалий час ГРБ розглядалася як провідний патофізіологічний механізм розвитку бронхіальної астми (БА). На сьогодні ГРБ відводять важливу роль у виникненні синдрому бронхіальної обструкції у пацієнтів з різними хронічними бронхолегеневими захворюваннями, у тому числі і з МВ [5]. Повідомляють, що ГРБ спостерігається принаймні у 40 % пацієнтів із МВ і корелює зі зниженням функції легенів [6]. Але детермінанти ГРБ при МВ відрізняються від БА і ще не до кінця зрозумілі. Так, у декількох дослідженнях показано, що у пацієнтів з МВ ГРБ не була пов’язана з маркерами атопії, а тільки з активністю бактеріального запалення [7, 8]. Дискутується також первинність тривалого поточного інфекційного процесу і пов’язаного з ним пошкодження дихальних шляхів у розвитку ГРБ. На сьогодні є наукові докази порушення бронхіальної рецепторної активності за рахунок запалення та перебудови слизової оболонки бронхів, що стартує у дітей з МВ вже на перших місяцях життя, ще до виникнення хронічної бронхіальної інфекції [9]. Продовжується вивчення впливу алергічного бронхолегеневого аспергільозу (АБЛА) на ці процеси. Частота розвитку АБЛА у пацієнтів із МВ варіює від 3 до 25 % [10]. Отже, хоча всі ці дані підлягають різним інтерпретаціям, вони узгоджуються з гіпотезою про те, що у пацієнтів із МВ ГРБ виникає внаслідок пошкодження бронхів, пов’язана з більш швидким погіршенням стану легень і є несприятливим прогностичним фактором перебігу захворювання. Крім того, ГРБ може заважати адекватному проведенню базисної терапії МВ (антибіотики, муколітики) інгаляційним методом. Бронхоспазм, як прояв ГРБ, може бути спровокований будь-яким інгаляційним засобом, але ризик його виникнення вищий при використанні розчинів, що істотно відрізняються осмолярністю від бронхіального секрету [4]. Гіпертонічний розчин хлориду натрію (ГРХН) входить у перелік обов’язкових призначень у лікуванні хворих на МВ згідно з чинним уніфікованим клінічним протоколом [11]. Основний механізм його дії у хворих на МВ — осмотична активність розчину, яка виводить рідину на апікальну поверхню епітелію дихальних шляхів і таким чином компенсує підвищену абсорбцію натрію, хлоридів і води, яка виникає за відсутності нормальної функції гена МВ CFTR [12]. Доведено, що у хворих на МВ під впливом ГРХН поліпшується мукоциліарний кліренс та простежується протимікробний ефект щодо Pseudomonas aeruginosa [13], однак питання про ефективність і безпеку його застосування у дітей залишається ще не до кінця вирішеним. Під час лікування ГРХН може спостерігатися висока варіабельність результатів залежно від віку пацієнтів і вагома частота побічних ефектів у вигляді кашлю та бронхоспазму, що може потребувати використання бронхолітичних препаратів [14]. За даними закордонних авторів, приблизно 30 % хворих на МВ демонструють значне звуження дихальних шляхів у відповідь на інгаляції ГРХН [4, 15]. Імовірно, що такі суперечливі дані щодо ефективності використання ГРХН у дітей пов’язані з тим, що на практиці не враховується і не прогнозується можливість синдрому ГРБ, що може бути причиною порушення протоколу лікування.
Отже, виявлення та вивчення механізмів формування ГРБ на ГРХН у дітей з МВ мають велике практичне значення.
Мета дослідження: вивчити стан реактивності бронхів на інгаляційні сольові гіпертонічні розчини та її залежність від клінічних, функціональних та мікробіологічних особливостей перебігу МВ у дітей.
Матеріали та методи
Для досягнення поставленої мети обстежено 40 дітей з МВ, які знаходились на лікуванні у міському дитячому пульмонологічному центрі м. Дніпра. Серед обстежених дітей було 17 хлопчиків (42,5 %) та 23 дівчинки (57,5 %). Середній вік дівчаток становив 11,3 ± 0,9 року, хлопчиків — 12,4 ± 0,7 року. Середній вік у загальній групі становив 12,0 ± 0,6 року.
Критеріями включення в дослідження були: діти від 6 до 18 років з підтвердженим діагнозом МВ, які здатні були виконати спірометрію, згода пацієнта та його батьків на участь у дослідженні.
Критеріями виключення з дослідження були: загострення бронхолегеневого процесу, наявність епізоду кровохаркання/легеневої кровотечі в анамнезі, об’єм форсованого видиху за 1-шу секунду (ОФВ1) < 50 % від належного, неможливість виконання спірометрії та раніше виявлена непереносимість гіпертонічного розчину NaCl.
Верифікацію діагнозу МВ проводили на підставі його діагностичних критеріїв згідно з «Уніфікованим клінічним протоколом первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Муковісцидоз» (наказ МОЗ України № 723 від 15.07.2016 р.). Ступінь тяжкості стану хворих визначали за оціночною шкалою Швахмана — Кульчицького. При цьому підсумовувалися бали за 4 основними параметрами: загальна активність хворого, клінічні прояви MB, показники фізичного розвитку дитини, рентгенологічні зміни в легенях. Кожну ознаку оцінювали за шкалою від 5 до 25 балів. Стан оцінювався як відмінний у разі наявності суми 86–100 балів, хороший — 71–85, задовільний — 56–70, середньої тяжкості — 41–55 та тяжкий — 40 балів і менше.
Молекулярно-генетичне дослідження проводилося в ДУ «Інститут спадкової патології НАМН України». Дослідження проводили, використовуючи метод полімеразної ланцюгової реакції. Матеріалом для дослідження була ДНК, виділена з лейкоцитів периферичної крові пацієнтів. Діагностика мутацій гена CFTR проводилася за допомогою панелі ДНК-діагностики МВ: F508del, CFTRdele2,3, 2143delT, W1282X, N1303K, IVS12+2T^C, 3849+10kbC>T, 2184insA, G542X, G551D, G551S, 1677delTA, 3821delT, R334W, R117C, R334W, R347H, R347L, R347C, R347P, D1270N, I336K, R560T, S549I, R553X, 17171G-A, Y122X, 621+1G-T. Відповідно до сучасних класифікацій мутацій гена CFTR ідентифікували «ступінь тяжкості» генотипу: для «тяжкого» генотипу обов’язковим є наявність мутацій І–ІІІ класу, які призводять до повного чи майже повного припинення функції хлорного каналу; для «м’якого» — наявність хоча б однієї мутації ІV–VI класу, коли зберігається залишкова функція хлорного каналу.
Дослідження мікробіоти дихальних шляхів проводилось у рамках сумісної НДР кафедри пропедевтики дитячих хвороб і кафедри мікробіології, вірусології, імунології та епідеміології ДДМУ «Бронхіти у дітей з коморбідними станами: клінічний перебіг та їх сучасна етіологія», номер держреєстрації 0116U004962.
Для визначення індивідуальної переносимості інгаляцій ГРХН використовували протокол дослідження, запропонований E.P. Dellon et al. (рис. 1) [16]. Для інгаляцій використовували офіцинальні розчини хлориду натрію різних концентрацій: стерильний 0,9% розчин NaCl, стерильний 3% розчин NaCl та стерильний 7% розчин NaCl. Перед проведенням дослідження пацієнтам відміняли інгаляції ГРХН за 48 годин до дослідження та бронхолітиків залежно від тривалості їх дії: від 6–8 годин для інгаляційних β2-агоністів короткої дії до 48 годин для інгаляційних β2-агоністів тривалої дії.
/26.jpg)
На початку дослідження пацієнтам проводили вихідну спірометрію за загальноприйнятою методикою з визначенням загальновідомих швидкісних та об’ємних показників, зокрема ОФВ1, форсованої життєвої ємності легень (ФЖЄЛ), співвідношення ОФВ1/ФЖЄЛ, максимальних об’ємних швидкостей на рівнях 25, 50 та 75 % ФЖЄЛ (МОШ 25, 50, 75) за допомогою сучасного спірографа MicroLab. Для інгаляцій пацієнти використовували персональні ультразвукові небулайзери Pari. Для першої інгаляції як контроль використовували стерильний 0,9% розчин NaCl, для другої та третьої — 3% розчин NaCl та 7% розчин NaCl відповідно. Після кожної інгаляції аналізували клінічні зміни (характер кашлю, поява індукованого мокротиння та аускультативні зміни в легенях) та зміни показників функції зовнішнього дихання. При появі таких побічних явищ, як утруднення дихання, спастичний кашель, аускультативні симптоми бронхоспазму та зниження ОФВ1 на ≥ 20 %, інгаляції припиняли. Для усунення побічних явищ та відновлення бронхіальної прохідності проводили бронходилатаційний тест з β2-агоністами короткої дії згідно з чинними рекомендаціями, ГРБ діагностували при збільшенні ОФВ1 ≥ 12 %.
Для оцінки вираженості запалення в дихальних шляхах вимірювали концентрацію монооксиду азоту в конденсаті повітря, що видихається (FeNO), за допомогою апарата NIOX VERO (Aerocrine, Швеція), який здатний визначити концентрацію FeNO в межах від 5 до 300 ppb (partperbillion — молекул NO на один мільярд молекул води) при швидкості потоку повітря, що видихається, у 50 мл/с та часі видиху, що дорівнює 10 секундам.
Статистична обробка отриманих результатів здійснювалася за допомогою пакета прикладних програм Statistica 6.1 (серійний номер — AGAR909E415822FA). Оцінювалися кількісні й якісні показники. Для кількісних параметрів було виконано перевірку на відповідність закону Гауса за критерієм Колмогорова — Смірнова з виправленням Ліллєфорса та Шапіро — Уїлка. З урахуванням того, що кількісні показники мали непараметричний тип розподілу, їх опис проводився з використанням медіани та інтерквартильного розмаху (Ме [25 %; 75 %]). Якісні дані описували як n (%). Порівняння кількісних даних проводилося за допомогою непараметричного критерію Манна — Уїтні (U), якісних даних — з використанням теста хі-квадрат Пірсона з поправкою Єйтса на безперервність. При перевірці статистичних гіпотез критичним значенням було вибрано р < 0,05.
Для оцінювання діагностичної ефективності показників використовували ROC-аналіз із визначенням площі під ROC-кривою (AUC), за результатом визначали якість діагностичної моделі. За допомогою порогового значення розраховували чутливість, специфічність, позитивну та негативну прогностичну цінність. Під час ROC-аналізу показників визначили оптимальні порогові значення для максимальної суми чутливості та специфічності.
Дослідження проводилося з дозволу локальної Комісії з питань біомедичної етики відповідно до основоположних морально-етичних принципів, вимог дотримання прав, інтересів та особистої гідності учасників дослідження, що забезпечуються наступними нормативними документами: Гельсінською декларацією, Конвенцією Ради Європи про права людини і біомедицину, Якісною клінічною практикою (GCP), Загальною декларацією про біоетику і права людини ЮНЕСКО, Конституцією України (ст. 3, 21, 24, 28, 32), Основами законодавства України про охорону здоров’я (ст. 43.1, 44.1).
Результати
Аналіз клінічних даних показав, що 62,5 % хворих на МВ мали тяжкий перебіг захворювання та 37,5 % хворих — перебіг середнього ступеня тяжкості. У результаті проведеного молекулярно-генетичного дослідження у 26 (65,0 %) хворих було ідентифіковано «тяжкий» генотип, у 7 (17,5 %) хворих — «м’який» генотип. У решти хворих (17,5 %) мутації не були ідентифіковані, проте діагноз встановлено на підставі типової клінічної картини та двох позитивних потових проб, що відповідає сучасним критеріям діагностики МВ. Відомо, що у зв’язку з великою кількістю можливих мутацій у гені CFTR не можна виключити присутності невстановлених мутацій в обстежених хворих. Ураження бронхолегеневої системи у вигляді хронічного бронхіту було діагностовано у 72,5 % обстежених хворих.
За результатами протоколу дослідження, ГРБ до ГРХН мали 17 (42,5 %) хворих на МВ, серед яких було 9 (52,9 %) хлопчиків та 8 (47,1 %) дівчаток (p > 0,05). Клінічними ознаками ГРБ у дітей були: спастичний кашель під час інгаляцій ГРХН, утруднення дихання та аускультативні симптоми бронхоспазму. Так, скарги на спастичний кашель під час інгаляцій 3% розчином NaCl мали 10 дітей (58,9 %), під час інгаляцій 7% розчином NaCl — 15 (88,2 %) дітей. Утруднене дихання виникало у 3 (17,7 %) дітей після інгаляцій 3% розчину NaCl та у 9 (52,9 %) дітей після інгаляцій 7% розчину NaCl (p < 0,05). Аускультативні симптоми бронхоспазму вірогідно частіше реєструвалися у дітей після інгаляцій 7% розчину NaCl порівняно з 3% розчином NaCl (58,9 проти 35,3 %; p < 0,05).
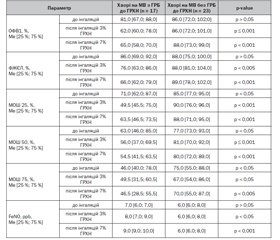
Проведено порівняльний аналіз клініко-параклінічної характеристики дітей з МВ залежно від стану бронхіальної реактивності (табл. 1).
/27.jpg)
Як видно з табл. 1, за віком групи дітей з ГРБ до ГРХН та без неї вірогідно не відрізнялись (p > 0,05). За результатами молекулярно-генетичного дослідження діти з ГРБ до ГРХН частіше мали «тяжкий» генотип (88,2 проти 47,8 %; p < 0,01), у той час як діти без ГРБ до ГРХН частіше мали «м’який» генотип (30,4 проти 0,0 %, p < 0,05). Встановлено, що пацієнти з ГРБ до ГРХН мали більш ранню маніфестацію захворювання та більш несприятливий перебіг захворювання, ніж пацієнти без ГРБ до ГРХН. Так, у групі хворих з ГРБ до ГРХН медіана віку встановлення діагнозу була значно нижчою, ніж у групі без неї, та становила 6,0 [5,0; 10,0] міс. проти 24,0 [7,0; 60,0] міс. (p < 0,01). Відповідно тяжкий перебіг захворювання мали 15 (88,2 %) дітей з ГРБ до ГРХН та 10 (43,5 %) дітей без ГРБ до ГРХН (p < 0,01). Ураження бронхолегеневої системи у вигляді вторинного хронічного бронхіту було зареєстровано у 16 (94,1 %) хворих з ГРБ до ГРХН та 13 (56,5 %) хворих без ГРБ до ГРХН (p < 0,01). При цьому у 3 (17,6 %) хворих з ГРБ до ГРХН було діагностовано вторинний хронічний обструктивний бронхіт. За даними рентгенографії та комп’ютерної томографії легень також були виявлені вірогідні відмінності. Так, у хворих з ГРБ до ГРХН порівняно з хворими без ГРБ частіше реєструвалися циліндричні, мішотчасті або змішані бронхоектази (94,1 проти 56,5 %, p < 0,01). Кількість загострень на рік хронічного бронхолегеневого процесу у хворих з ГРБ до ГРХН була вищою в 2 рази та становила 4,0 [2,0; 4,0] проти 2,0 [0,0; 4,0] у хворих без ГРБ (p < 0,01). При цьому дихальна недостатність (ДН) у періоді загострення вірогідно частіше реєструвалася у хворих з ГРБ до ГРХН порівняно з хворими без неї (52,9 проти 26,1 %; p < 0,1).
За результатами мікробіологічного дослідження, у хворих з ГРБ до ГРХН значно частіше, ніж у хворих без ГРБ, виявлялися хронічна колонізація дихальних шляхів Pseudomonas aeruginosa (70,6 проти 39,1 %; p < 0,05) та алергічний бронхолегеневий аспергільоз (82,4 проти 0,0 %, p < 0,001).
Проведений кореляційний аналіз виявив наявність вірогідних взаємозв’язків між колонізацією дихальних шляхів Pseudomonas aeruginosa та тяжкістю перебігу захворювання (r = 0,71; p < 0,001), наявністю бронхоектазів (r = 0,65; p < 0,001), кількістю загострень на рік (r = 0,44; p < 0,01), ДН у періоді загострення (r = 0,32; p < 0,05), наявністю АБЛА (r = 0,38; p < 0,05) та ГРБ до ГРХН (r = 0,31; p ≤ 0,05). Не виявлено залежності гіперреактивності бронхів у хворих на МВ від алергопатології (r = –0,17; p > 0,05) та обтяженого алергоанамнезу (r = –0,27; p > 0,05). Проте у дітей з ГРБ до ГРХН рівень загального IgE був вірогідно вищим, ніж у дітей без ГРБ до ГРХН (38,0 [27,0; 51,0] проти 10,0 [6,0; 17,0] МО/мл; p < 0,05), хоча й не перевищував референтні значення.
Результати спірометричного дослідження (табл. 2) показали, що у хворих з ГРБ до ГРХН порівняно з хворими без ГРБ до ГРХН вірогідно не відрізнялися вихідні середні значення ОФВ1 (81,0 [67,0; 88,0] % проти 86,0 [72,0; 102;0] % відповідно; p > 0,05) та ФЖЄЛ (86,0 [69,0; 92,0] % проти 88,0 [75,0; 100,0] % відповідно; p > 0,05). Проте після інгаляцій ГРХН їх значення значно знижувалися у хворих з ГРБ та практично не змінювалися у хворих без ГРБ. Так, після інгаляцій 3% розчину NaCl ОФВ1 становила 62,0 [60,0; 78,0] % у хворих з ГРБ проти 86,0 [72,0; 101,0] % — без ГРБ (p ≤ 0,001), після інгаляцій 7% розчину NaCl — 65,0 [58,0; 70,0] % проти 88,0 [73,0; 99,0] % відповідно (p < 0,001). ФЖЄЛ після інгаляцій 3% розчину NaCl становила 76,0 [63,0; 86,0] % проти 88,0 [81,0; 104,0] % (p < 0,005), після інгаляцій 7% розчину NaCl — 66,0 [62,0; 79,0] % проти 89,0 [78,0; 102,0] % відповідно (p < 0,001).
/28.jpg)
За допомогою ROC-аналізу визначили оптимальне порогове значення ОФВ1 та МОШ 25 для діагностики ГРБ. Так, при використанні 3% розчину NaCl ГРБ діагностується при зниженні ОФВ1 на 7 % (чутливість — 88,2 %, специфічність — 100,0 %, AUC — 0,980 (95% ДІ 0,876–1,000)) та МОШ 25 на 6 % (чутливість — 76,5 %, специфічність — 91,3 %, AUC — 0,839 (95% ДІ 0,688–0,936)) (рис. 2, 3). При використанні 7% розчину NaCl ГРБ діагностується при зниженні ОФВ1 на 10 % (чутливість — 100,0 %, специфічність — 100,0 %, AUC — 1,000 (95% ДІ 0,912–1,000)) та МОШ 25 на 17,0 % (чутливість — 64,7 %, специфічність — 100,0 %, AUC — 0,867 (95% ДІ 0,722–0,953)).
/29.jpg)
Вірогідно відрізнялися і показники швидкості проходження повітря на рівні дрібних (МОШ 25), середніх (МОШ 50) та крупних (МОШ 75) бронхів. Так, хворі з ГРБ до ГРХН порівняно з хворими без ГРБ мали вірогідно нижчі вихідні середні значення показників МОШ 25 (71,0 [62,0; 87,0] % проти 85,0 [77,0; 95,0] % відповідно; p < 0,05), МОШ 50 (63,0 [46,0; 85,0] % проти 77,0 [73,0; 93,0] % відповідно; p < 0,05) та MOШ 75 (46,0 [40,0; 78,0] % проти 75,0 [55,0; 88,0] % відповідно; p < 0,05). Після інгаляцій 3% та 7% розчину NaCl у хворих з ГРБ спостерігалося вірогідне зниження показників МОШ 25 та МОШ 50, що свідчить про звуження дрібних та середніх бронхів.
Дослідження рівня FeNO не виявило вірогідної різниці його вихідного середнього значення у хворих з ГРБ та без неї. Так, у хворих з ГРБ рівень FeNO становив 7,0 [6,0; 7,0] ppb, у хворих без ГРБ — 6,0 [6,0; 8,0] ppb (p > 0,05). Проте після інгаляцій ГРХН його середнє значення підвищувалося у хворих з ГРБ та було вірогідно вищим, ніж у хворих без ГРБ. Так, після інгаляцій 3% розчину NaCl медіана рівня FeNO становила 8,0 [7,0; 9,0] ppb у хворих з ГРБ та 6,0 [6,0; 8,0] ppb у хворих без неї (p < 0,05), після інгаляцій 7% розчину NaCl — 9,0 [9,0; 10,0] ppb проти 6,0 [6,0; 8,0] ppb відповідно (p < 0,001).
Обговорення
Результати проведеного дослідження показали, що майже половина хворих (42,5 %) на МВ мають ГРБ до ГРХН. Згідно з зарубіжними даними, поширеність ГРБ у хворих на МВ, пов’язаної з інгаляціями муколітиків та антибіотиків, коливається від 2 до 66 % залежно від типу препарату, його властивостей і різних способів виявлення ГРБ. Так, за даними H. Eyns et al., ГРБ на ГРХН виявляється приблизно у 30 % хворих на МВ [4].
У результаті проведеного нами дослідження встановлена чітка залежність між клінічними особливостями перебігу МВ та формуванням ГРБ на ГРХН. Найбільша частота ГРБ виявляється у хворих з тяжким перебігом МВ, що характеризується наявністю «тяжких» мутацій у гені трансмембранного регуляторного білка МВ, більш ранньою маніфестацією захворювання, наявністю хронічного інфекційного запального процесу у легенях, обумовленого хронічною колонізацією дихальних шляхів Pseudomonas aeruginosa та АБЛА. Не виявлено залежності ГРБ у хворих на МВ з алергопатологією та обтяженим алергоанамнезом. Це підтверджує той факт, що ГРБ при МВ виникає вторинно щодо основного захворювання та пов’язана з пошкодженням епітелію дихальних шляхів [4]. Наявність бактеріальної інфекції, зокрема Pseudomonas aeruginosa, сприяє секреції IL-8 і TNF-альфа, що призводить до ремоделювання бронхів. Крім того, CFTR-дефіцитні Т-клітини спрямовані до Т-хелперів 2-го типу, що спричиняє алергічну відповідь [16].
Встановлено також, що хворі на МВ з ГРБ мають більш несприятливий перебіг захворювання, ніж пацієнти без ГРБ. Так, у хворих з ГРБ частіше виникають загострення хронічного бронхолегеневого процесу та ДН під час загострень. Таким чином, пацієнти з МВ із підтвердженою ГРБ мають гірший прогноз, ніж пацієнти без ГРБ аналогічного віку.
Крім того, ГРБ у хворих на МВ може бути причиною низького комплаєнсу та обов’язкового припинення інгаляційного лікування і, отже, є важливим побічним ефектом інгаляційної терапії, який потребує значної уваги, оскільки може обмежити терапевтичні можливості. Таким чином, на початку лікування хворих на МВ завжди слід проводити дослідження на виявлення ГРБ до інгаляційних препаратів, особливо ГРХН.
Незважаючи на суперечливі знання про механізми розвитку ГРБ при МВ, хворим рекомендовано призначати інгаляційні бронходилататори, оскільки вони можуть запобігти виникненню ГРБ при вдиханні ГРХН [2, 3]. Бронходилататори можуть збільшити мукоциліарний транспорт, зменшити запальне пошкодження дихальних шляхів, підвищити толерантність до фізичного навантаження та зменшити задишку [4]. На підставі кокранівського огляду зроблено висновок, що бета-агоністи як короткої, так і тривалої дії можуть бути корисними для пацієнтів з МВ, які мають ГРБ [2].
Висновки
1. Гіперреактивність бронхів на інгаляційні сольові гіпертонічні розчини досить часто (42,5 %) зустрічається у хворих на муковісцидоз та може заважати адекватному проведенню базисної терапії інгаляційним методом.
2. Наявність гіперреактивності бронхів у хворих на муковісцидоз залежить від тяжкості перебігу захворювання, ураження бронхолегеневої системи, хронічної колонізації дихальних шляхів Pseudomonas aeruginosa та АБЛА. Не виявлено залежності гіперреактивності бронхів у хворих на муковісцидоз від обтяженого алергологічного анамнезу.
3. Клінічними ознаками гіперреактивності бронхів у дітей з муковісцидозом є: спастичний кашель під час інгаляцій ГРХН, утруднення дихання, аускультативні симптоми бронхоспазму. При цьому частота їх вища під час використання 7% розчину NaCl.
4. Ранніми функціональними ознаками гіперреактивності бронхів, що можуть потребувати превентивного призначення β2-агоністів короткої дії на період лікування ГРХН у дітей з муковісцидозом, є: зниження ОФВ1 на 7 % та МОШ 25 на 6 % при тестуванні на переносимість 3% розчину NaCl.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 09.08.2022
Рецензовано/Revised 18.08.2022
Прийнято до друку/Accepted 27.08.2022

/26.jpg)
/27.jpg)
/28.jpg)
/29.jpg)