Вступ
Поширеність інфекції H.pylori (HP) є серйозною епідеміологічною проблемою [1–4]. У консенсусному звіті (Maastricht V/Florence) зазначено, що поширеність HP серед дорослих становить від 30 % (Північна Європа) до 84 % (Південна і Східна Європа) та асоціюється із захворюваннями травної системи [5]. Встановлено, що найбільша поширеність інфекції виявлена в дітей віком від 13 до 18 років (75,8 %) [6]. У дітей віком 5 років і старших імовірність повторного інфікування H.pylori низька й становить 2,0–2,4 % на рік. У структурі гастроентерологічної патології в підлітків за останні десять років переважають ураження верхніх відділів травного тракту: функціональні розлади шлунка, хронічний гастрит і дуоденіт, виразкова хвороба [7]. Медична значущість проблеми полягає в тому, що ці запально-деструктивні захворювання погіршують якість життя, а їх рецидиви й ускладнення знижують загальний рівень здоров’я осіб підліткового віку, що має соціальне значення. Серед Н.pylori-залежних захворювань органів травлення в підлітків першість утримує виразка дванадцятипалої кишки (ДПК). У Європейському багатоцентровому дослідженні [8] було проаналізовано роль відомих факторів ризику в популяції 694 дітей, включених до 19 європейських центрів. Незважаючи на обмеженість короткостроковою тривалістю й гетерогенністю популяції, дане дослідження виявило високу частоту виразок і/або ерозій у дітей — 8,1 %, які виникають переважно в підлітковому віці. У 57 % дітей виявлено понад один фактор ризику: у 27 % цих дітей була інфекція НP, у 14 % застосовувалися нестероїдні протизапальні препарати, у 10 % — Н2-блокатори, у 10 % — антибіотики, у 9 % — стероїди, імунодепресанти й інгібітори протонної помпи. У 43 % дітей, включених у дослідження, факторів ризику не виявлено.
У м. Кіото (Японія) була скликана нарада для досягнення глобального консенсусу щодо класифікації хронічного гастриту й дуоденіту і диференціації HP з використанням анонімної електронної системи — методу Дельфі [9]. Запропоновано нову класифікацію гастритів і дуоденітів для Міжнародної класифікації хвороб (МКХ) 11-го перегляду і нову категорію H.pylori-асоційованої диспепсії разом із діагностичним алгоритмом, який потребує обговорення щодо застосування в педіатричній практиці.
Певному віку й статі властиві якісно різні етіологічні, провокуючі й підтримуючі чинники формування уражень верхніх відділів травного тракту. Іншими словами, у патогенезі цих захворювань існують важливі, але поки що не вивчені патогенетичні механізми, які не дозволяють зрозуміти цю хворобу зі всією повнотою і стримують розробку нових патогенетично обґрунтованих методів лікування й профілактики. Клінічна картина й перебіг Н.pylori-залежних захворювань гастродуоденальної зони в підлітків має свої особливості, що створюють труднощі в діагностиці й лікуванні [10]. Це пояснюють нейрогуморальною адаптацією організму підлітків, оскільки на цей період припадає пік нервових перенапружень [11], зокрема, пов’язаних із вибором професії і підготовкою до вступних іспитів. Вивчення й уточнення патофізіологічних механізмів формування гастродуоденальної патології в дітей підліткового віку і на сьогодні залишаються актуальними [12–14].
Мета: дослідити рівень кортизолу в плазмі крові підлітків із Н.pylori-залежними захворюваннями гастродуоденальної зони.
Матеріали та методи
Дослідження проводилося на базі ОНП «Чернівецька обласна дитяча клінічна лікарня» методом простої рандомізації. Сформовано групу із 96 дітей підліткового віку (15–18 років), яка була розподілена на підгрупи залежно від нозологічної форми (хронічний гастродуоденіт (ХГД), хронічний ерозивний гастродуоденіт, дуоденальна виразка (ДВ)) і статі, і групу порівняння з осіб відповідного віку (9 дівчат і 10 хлопців). Усередині підгруп розподіл відбувався залежно від інфікування НР. Діагноз встановлювався відповідно до МКХ 10-го перегляду: виразка дванадцятипалої кишки або дуоденальна виразка (K26), зокрема ерозія (гостра) дванадцятипалої кишки, виразка (пептична), хронічний поверхневий гастрит (K29.3), хронічний гастрит неуточнений (K29.5), зокрема aнтрaльний, фундaльний; дуоденіт (K29.8), гастродуоденіт неуточнений (K29.9). Верифікація діагнозу була проведена на підставі клініко-анамнестичних і додаткових інструментальних і лабораторних методів дослідження. Для верифікації виразок слизової оболонки, виявлення рефлюксів і супутньої патології використовували фіброезофагогастродуоденоскопію (ФЕГДС) за допомогою фіброгастродуоденоскопа Pentax FG-24P з визначенням ендоскопічних критеріїв HР і проведення щіткової біопсії слизової оболонки шлунка (антрум і тіло шлунка) і ДПК за загальноприйнятими правилами забору з наступним приготуванням мазка-відбитка, забарвленням і бактеріоскопією з метою діагностики НР. Інфікування HР підтверджували твердофазним імуноферментним тестом шляхом якісного й кількісного визначення IgG-антитіл до HР у сироватці крові (UBI MAYIWELL™, США). Позитивним вважали рівень понад 40 Eu/мл. Одночасно з ФЕГДС проводили інтрагастральну рН-метрію апаратом ІКШ-2 (Чернобровий В.М., 1990). Визначення рівня кортизолу в плазмі крові проводили за допомогою стандартної тест-системи (Immunotech, Чехія).
Критерії включення в дослідження: вік 15–18 років; однотипність клінічного діагнозу, характеру порушень функції шлунка, єдина діагностична програма, позитивний тест на HP. Критерії виключення з дослідження: наявність декомпенсованої супутньої патології; вік до 15 років, обстеження в інших лікувально-профілактичних закладах; вживання седативних препаратів, антибактеріальної терапії, біопрепаратів, пробіотиків упродовж одного місяця й антисекреторних препаратів за 4 доби до дослідження. Дослідження проведене з урахуванням основних положень GCР ІCH і Гельсінської декларації з біомедичних досліджень. Дизайн дослідження передбачав дотримання принципів конфіденційності й поваги до особистості дитини та інших етичних принципів стосовно людей, які виступають суб’єктами дослідження.
Одержані результати аналізували за допомогою комп’ютерних пакетів програм Statistica 6.0 (StatSoft Inc.) і Excel XP для Windows з використанням параметричних і непараметричних методів обчислення.
Результати та обговорення
У табл. 1 подано розподіл дітей на підгрупи залежно від нозології і статі. Найчастіше хронічний гастродуоденіт виявлявся серед дівчат, тоді як хронічний ерозивний гастродуоденіт і дуоденальна виразка дещо частіше діагностувалися в хлопців.
Із 96 обстежених нами дітей неодноразово перебували на стаціонарному лікуванні з приводу захворювання гастродуоденальної ділянки 34 дитини підліткового віку (35,4 %), уперше госпіталізовані 62 підлітки (64,5 %), із них в ургентному порядку 14: з підозрою на гострий апендицит — 5 дітей (35,7 %), ниркову кольку — 5 (35,7 %), гострий холецистит — 2 (14,2 %), ДВ — 2 (14,2 %) особи підліткового віку.
Функціональні панкреатичні розлади сфінктера Одді дещо частіше діагностувалися в дітей із ХГД (37 ± 3,6 % у дівчат і 27,7 ± 3,5 % у хлопців, р > 0,05). Хронічний холецистит був діагностований у третини пацієнтів із ХЕГД. Відмінностей за статтю в характері поєднаної патології при ХГД і ХЕГД не було. Серед поєднаної патології травної системи в підлітків із ДВ найчастіше траплявся хронічний холецистит — у 5 хлопців і 4 дівчат.
Загальна частота виявлення НР становила 54,2 %. Інфікованість НР залежно від нозологічної форми подана в табл. 2.
Наші дослідження виявили відносно високу сімейну поширеність НР. Так, серед підлітків, інфікованих НР, 53,8 ± 8,2 % мають інфікованого одного з батьків, а 30,7 ± 5,1 % — двох. Крім того, при дослідженні на носійство братів і сестер інфікованого НР підлітка у 34,8 ± 3,4 % виявлено НР. Найбільш висока сімейна інфікованість серед підлітків, хворих на ДВ, — у 8 із 10 випадків (80 %), дещо нижча — серед підлітків, хворих на ХЕГД, — у 14 із 24 випадків (58,3 %) і вірогідно нижча серед підлітків, хворих на ХГД, — у 7 із 18 випадків (38,8 %), р < 0,05.
Варто зауважити, що серед підлітків, хворих на Н.pylori-асоційовані ХГД, тільки в 33,3 % встановлені токсичні CagA-штами мікроорганізму, тоді як серед пацієнтів із Н.pylori-асоційованими ХЕГД такі штами були встановлені в 70,8 % випадків. Найбільш високим числом виявлення штамів НР у біоптатах слизової оболонки характеризуються підлітки, хворі на ДВ як у цілому (10 із 12 осіб, 83,3 %), так і за кількістю виявлених токсигенних CagA-штамів НР (8 із 10 осіб, 80 %). Тобто ДВ майже вдвічі частіше перебігає на фоні інфікування НР і у 2,4 раза частіше — з CagA-штамом мікроорганізму.
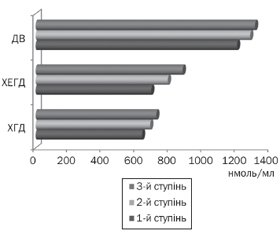
Середній рівень кортизолу в плазмі крові підлітків становив 835,44 ± 56,72 нмоль/мл, при цьому в підлітків із патологією верхніх відділів шлунково-кишкового тракту він був вірогідно вищий за такий у підлітків групи порівняння (906,33 ± 43,56 нмоль/мл і 666,21 ± 33,42 нмоль/мл відповідно, p < 0,05). Найвищий рівень кортизолу в плазмі крові зареєстрований у підлітків із ДВ (рис. 1) із переважанням більш високих показників серед хлопців.
Аналіз показників кортизолу в підлітків із ДВ встановив вірогідно вищі рівні в стадії загострення, ніж у стадії ремісії захворювання (1233,51 ± 98,11 нмоль/л і 864,6 ± 35,21 нмоль/л відповідно, p < 0,05). Встановлено також залежність рівня кортизолу в плазмі крові підлітків від активності запального процесу в слизовій оболонці шлунка й дванадцятипалої кишки: чим вища активність, тим вищі рівні кортизолу (рис. 2).
Нами встановлено вищий рівень кортизолу в плазмі крові підлітків із Н.pylori-асоційованими захворюваннями гастродуоденальної ділянки, зокрема, у хлопців із ДВ і позитивним CagA-штамом НР рівень кортизолу був найвищим і становив 1365,45 ± 65,32 нмоль/мл (n = 8).
Отже, сучасний перебіг деструктивних і запальних уражень гастродуоденальної ділянки в підлітків супроводжується поєднаним ушкодженням інших органів травлення, що вимагає включення до комплексу обстеження підлітків методів дослідження жовчовивідної системи, печінки і підшлункової залози і корекції виявлених розладів.
За результатами дослідження [15] встановлено, що в молодих хворих із виразковою хворобою дванадцятипалої кишки спостерігається підвищена чутливість парієтальних клітин і симпатоадреналової системи до стресових ситуацій, а стимуляція кислотоутворюючої функції шлунка відбувається під дією як катехоламінів, так і гастрину.
Підвищений рівень кортизолу, особливо в підлітків із ДВ, можна розглядати як фактор, що призводить до зниження бактерицидної активності макрофагів і нейтрофілів і сприяє підвищенню сприйнятливості до бактерійних інфекцій, зокрема НР [16]. Також підвищений рівень кортизолу в підлітків із хронічним ерозивним гастродуоденітом дозволяє розглядати останній як передвиразковий стан, особливо в хлопців. Психологічний стрес, який часто реєструється в підлітковому віці, може підвищувати рівень кортизолу в плазмі, змінювати процес запалення і впливати на активність HP [17, 18]. Етіологічний маятник пептичної виразки хитнувся від «усіх стресів» до «всіх бактерій», після чого було усвідомлення того, що обидва фактори можуть відігравати роль в ульцерогенезі. Інші дослідження [19, 20] містять дані, які підтверджують думку про те, що глюкокортикоїди, які вивільняються при гострому стресі, є гастропротекторними факторами.
Висновки
У підлітковому віці запальні й деструктивні зміни в слизовій оболонці дванадцятипалої кишки потенціюються високим рівнем кортизолу в плазмі крові, рівень якого вищий у хлопців, при високому ступені активності запалення й асоціації з інфекцією Helicobacter pylori.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 19.08.2022
Рецензовано/Revised 01.09.2022
Прийнято до друку/Accepted 09.09.2022
Список литературы
1. FitzGerald R., Smith S.M. An Overview of Helicobacter pylori Infection. Methods Mol. Biol. 2021. 2283. 1-14. doi:10.1007/978-1-0716-1302-3_1.
2. Ansari S., Yamaoka Y. Role of vacuolating cytotoxin A in Helicobacter pylori infection and its impact on gastric pathogenesis. Expert Rev. Anti-Infect. Ther. 2020. 18(10). 987-996. doi:10.1080/14787210.2020.1782739.
3. Seo J.H., Bortolin K., Jones N.L. Review: Helicobacter pylori infection in children. Helicobacter. 2020. 25 Suppl. 1. e12742. doi:10.1111/hel.12742.
4. Wang Z.J., Li Z.L. Characteristics of gastric microbiota in children with Helicobacter pylori infection family history. Beijing Da Xue Xue Bao Yi Xue Ban. 2021. 53(6). 1115-1121. doi:10.19723/j.issn.1671-167X.2021.06.018.
5. Malfertheiner P., Megraud F., O’Morain C.A. et al. Management of Helicobacter pylori infection — the Maastricht V/Florence Consensus Report. Gut. 2017. 66(1). 6-30. doi:10.1136/gutjnl-2016-312288.
6. Ozbey G., Dogan Y., Demiroren K., Ozercan I.H. Prevalence of Helicobacter pylori in children in eastern Turkey and molecular typing of isolates. Braz. J. Microbiol. 2015. 46(2). 505-511. doi:10.1590/S1517-838246220140234.
7. Mladenova I. Clinical Relevance of Helicobacter pylori Infection. J. Clin. Med. 2021. 10(16). 3473. doi: 10.3390/jcm10163473.
8. Kalach N., Bontems P., Koletzko S. et al. Frequency and risk factors of gastric and duodenal ulcers or erosions in children: a prospective 1-month European multicenter study. Eur. J. Gastroenterol. Hepatol. 2010. 22(10). 1174-1181. doi:10.1097/MEG.0b013e32833d36de.
9. Sugano K., Tack J., Kuipers E.J. et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015. 64(9). 1353-67. doi: 10.1136/gutjnl-2015-309252.
10. Su D.J., Chang M.H., Yang J.C., Ni Y.H., Hsu H.Y., Wu J.F. Fourteen-day sequential therapy is superior to 7-day triple therapy as first-line regimen for Helicobacter pylori infected children. J. Formos Med. Assoc. 2022. 121(1 Pt 1). 202-209. doi:10.1016/j.jfma.2021.03.001.
11. Melinder C., Udumyan R., Hiyoshi A., Brummer R.J., Montgomery S. Decreased stress resilience in young men significantly increases the risk of subsequent peptic ulcer disease — a prospective study of 233 093 men in Sweden. Aliment. Pharmacol. Ther. 2015. 41(10). 1005-1015. doi:10.1111/apt.13168.
12. Okuda M., Lin Y., Kikuchi S. Helicobacter pylori Infection in Children and Adolescents. Adv. Exp. Med. Biol. 2019. 1149. 107-120. doi:10.1007/5584_2019_361.
13. Kato S., Shimizu T., Toyoda S. et al. The updated JSPGHAN guidelines for the management of Helicobacter pylori infection in childhood. Pediatr. Int. 2020. 62(12). 1315-1331. doi:10.1111/ped.14388.
14. Korona-Glowniak I., Cichoz-Lach H., Siwiec R. et al. Antibiotic Resistance and Genotypes of Helicobacter pylori Strains in Patients with Gastroduodenal Disease in Southeast Poland. J. Clin. Med. 2019. 8(7). 1071. doi:10.3390/jcm8071071.
15. Murni A.W., Darwin E., Zubir N., Nurdin A.E. Analyzing Determinant Factors for Pathophysiology of Functional Dyspepsia Based on Plasma Cortisol Levels, IL-6 and IL-8 Expressions and H.pylori Activity. Acta Med. Indones. 2018. 50(1). 38-45.
16. Woźniak D., Cichy W., Przysławski J., Drzymała-Czyż S. The role of microbiota and enteroendocrine cells in maintaining homeostasis in the human digestive tract. Adv. Med. Sci. 2021. 66(2). 284-292. doi:10.1016/j.advms.2021.05.003.
17. Tache Y., Larauche M., Yuan P.Q., Million M. Brain and Gut CRF Signaling: Biological Actions and Role in the Gastrointestinal Tract. Curr. Mol. Pharmacol. 2018. 11(1). 51-71. doi: 10.2174/1874467210666170224095741.
18. Fink G. Stress controversies: post-traumatic stress disorder, hippocampal volume, gastroduodenal ulceration. J. Neuroendocrinol. 2011. 23(2). 107-117. doi:10.1111/j.1365-2826.2010.02089.x.
19. Filaretova L. Gastroprotective Effect of Stress Preconditioning: Involvement of Glucocorticoids. Curr. Pharm. Des. 2017. 23(27). 3923-3927. doi:10.2174/1381612823666170215145125.
20. Filaretova L.P., Morozova O.Y., Yarushkina N.I. Peripheral corticotropin-releasing hormone may protect the gastric musosa against indometacin-induced injury through involvement of glucocorticoids. J. Physiol. Pharmacol. 2021. 72(5). 10.26402/jpp.2021.5.06. doi:10.26402/jpp.2021.5.06.
/34.jpg)
/35.jpg)

/34_2.jpg)