Журнал «Здоровье ребенка» Том 17, №6, 2022
Вернуться к номеру
Особливості використання індивідуального безперервного моніторингу глюкози у дітей і підлітків
Авторы: Величко В.І. (1), Лагода Д.О. (1), Амірова Г.Ю. (1), Бажора Я.І. (1), Шаповалов О.О. (2), Шпак О.А. (2), Сідор О.М. (2)
(1) — Одеський національний медичний університет, м. Одеса, Україна
(2) — КНП «Дитячий консультативно-діагностичний центр імені академіка Б.Я. Резніка» Одеської міської ради, м. Одеса, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
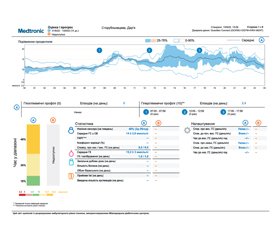
Актуальність. Нещодавні дані Міжнародної діабетичної федерації вказали на те, що щонайменше 500 000 дітей віком від 14 до 18 років у світі мають цукровий діабет 1-го типу (ЦД1). На сьогодні не існує лікування ЦД1, тому метою терапії є досягнення та підтримка оптимального рівня глюкози, зокрема, за допомогою інсулінотерапії, фізичної активності та дієти. Дослідження більше ніж 20 000 дітей з ЦД1 доводять перевагу самоконтролю рівня глюкози в контексті контролю епізодичної глікемії та довгострокового зниження глікованого гемоглобіну (HbA1c). Метою нашого дослідження було вивчити особливості використання індивідуального безперервного моніторингу глюкози у підлітків. Матеріали та методи. За дизайном у дослідження увійшли 22 пацієнти (12 підлітків та 10 дітей) віком від 8 до 16 років, які мали встановлений діагноз ЦД1. Із опитувальників були використані: загальна базова шкала Pediatric Quality of Life Inventory, модуль діабету PedsQL, опитувальник з гіпоглікемії для дорослих II (HFS-II) та опитувальник з оцінки задоволеності лікуванням діабету (DTSQ). Результати. Пацієнти до встановлення системи індивідуального безперервного моніторингу глюкози (ІБМГ) мали середні показники щодо емоційного, соціального та рольового функціонування. Було відмічено, що дані показники вірогідно підвищилися у відповідь на використання ІБМГ (р < 0,05; р < 0,05; р < 0,05 відповідно), тоді як показник фізичного функціонування не набув вірогідних змін у відповідь на використання ІБМГ (р > 0,05). Нами не було встановлено суттєвої кореляції між рівнем HbA1c та загальною оцінкою за DTSQ (ρ = 0,13; р > 0,05). Це вказує на те, що задоволеність лікуванням не обов’язково пов’язана з контролем глікемії. Було встановлено, що діти, які раніше використовували ІБМГ, були більш комплаєнтні щодо подальшого використання системи ІБМГ (р < 0,05). Із найбільш частих недоліків щодо використання системи ІБМГ діти та їхні батьки зазначили: дискомфорт від сенсора (62,19 %), необхідність калібровки, тобто вимірювання рівня глюкози за допомогою портативного глюкометра (58,61 %), стигматизацію дитини, яка носить сенсор, з боку оточуючих (47,83 %). Висновки. На нашу думку, використання ІБМГ є доцільним та може бути рекомендованим пацієнтам як із уперше встановленим діагнозом ЦД1, так і зі стажем захворювання для оптимізації терапії, покращення обізнаності пацієнта щодо контролю захворювання та підвищення комплаєнсу як у спілкуванні із лікарем, так і щодо лікування взагалі.
Recent data from the International Diabetes Federation indicated that at least 500,000 children aged 14 to 18 years worldwide have type 1 diabetes mellitus (T1DM). Currently, there is no cure for T1DM, so the goal of therapy is to achieve and maintain optimal glucose levels, in particular, using insulin therapy, physical activity, and diet. Studies of more than 20,000 children with T1DM have shown the benefits of self-monitoring of glucose levels for episodic glycemic control and long-term reduction of glycated hemoglobin (HbA1c). The purpose of our study was to investigate the specifics of using personal continuous glucose monitoring (CGM) in adolescents. Materials and methods. According to the design, the study included 22 patients (12 adolescents and 10 children) aged 8 to 16 years who were diagnosed with T1DM. Questionnaires offered included the Pediatric Quality of Life Inventory, the PedsQL Diabetes Module, the Hypoglycemia Fear Survey-II, and the Diabetes Treatment Satisfaction Questionnaire (DTSQ). Results. Before the installation of personal CGM systems, patients had average indicators of emotional, social and role functioning. It was noted that these indicators significantly increased in response to the use of personal CGM (p < 0.05 each), while the parameter of physical functioning did not change significantly (р > 0.05). We did not find a significant correlation between the level of HbA1c and the total score on the DTSQ (ρ = 0.13; p > 0.05). This indicates that satisfaction with treatment is not necessarily related to glycemic control. It was found that children who previously used personal CGM were more compliant with further use of personal CGM (p < 0.05). Among the most frequent drawbacks related to the use of personal CGM, children and their parents mentioned: discomfort from the sensor (62.19 %), the need for calibration, i.e. measuring the glucose level using a portable glucometer (58.61 %), stigmatization of the child who wears the sensor by the surrounding society (47.83 %). Conclusions. In our opinion, the use of personal CGM is appropriate and can be recommended for patients with a newly diagnosed T1DM and with a history of the disease in order to optimize therapy, improve the patient’s awareness of disease control, and increase compliance both in terms of communication with the doctor and general treatment.
глюкоза; моніторинг; цукровий діабет; підлітки
glucose; monitoring; diabetes mellitus; adolescents
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Mayer-Davis E.J., Kahkoska A.R., Jefferies C., et al. ISPAD clinical practice consensus guidelines 2018: definition, epidemiology and classification of diabetes in children and adolescents. Pediatric Diabetes. 2018. Vol. 19 (Suppl. 27). P. 7-19. DOI: 10.1111/pedi.12773.
- Ogurtsova K., da Rocha Fernandes J., Huang Y., et al. IDF diabetes atlas: global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Research аnd Clinical Practice. 2017. Vol. 128. P. 40-50. DOI: 10.1016/j.diabres.2017.03.024.
- Campbell-Stokes P., Taylor B. Prospective incidence study of diabetes mellitus in New Zealand children aged 0 to 14 years. Diabetologia. 2005. Vol. 48. № 4. P. 643-648. DOI: 10.1007/s00125-005-1697-3.
- Fox D.A., Islam N., Sutherland J., Reimer K., Amed S. Type 1 diabetes incidence and prevalence trends in a cohort of Canadian children and youth. Pediatric Diabetes. 2018. Vol. 19. № 3. P. 501-505. DOI: 10.1111/pedi.12566.
- Bendas A., Rothe U., Kiess W., et al. Trends in incidence rates during 1999–2008 and prevalence in 2008 of childhood type 1 diabetes mellitus in Germany — model-based National Estimates. PLoS One. 2015. Vol. 10. № 7. P. e0123716. DOI: 10.1371/journal.pone.0132716.
- Fazeli Farsani S., Souverein P.C., van der Vorst M.M., Knibbe C.A., Herings R.M., de Boer A., Mantel-Teeuwisse A.K. Increasing trends in the incidence and prevalence rates of type 1 diabetes among children and adolescents in the Netherlands. Pediatric Diabetes. 2016. Vol. 17. № 1. P. 44-52. DOI: 10.1111/pedi.12232.
- Dabelea D., Mayer-Davis E.J., Saydah S., et al. Prevalence of type 1 and type 2 diabetes among children and adolescents from 2001 to 2009. JAMA. 2014. Vol. 311. № 17. P. 1778-86. DOI: 10.1001/jama.2014.3201.
- Reynolds K.A., Helgeson V. Children with diabetes compared to peers: depressed? Distressed? A meta-analytic review. Annals of behavioral medicine. 2011. Vol. 42. № 1. P. 29-41. DOI: 10.1007/s12160-011-9262-4.
- Hood K.K., Peterson C.M., Rohan J.M., Drotar D. Association between adherence and glycemic control in pediatric type 1 diabetes: a meta-analysis. Pediatrics. 2009. Vol. 124. № 6. P. e1171-e1179. DOI: 10.1542/peds.2009-0207.
- Rewers M., Pihoker C., Donaghue K., Hanas R., Swift P., Klingensmith G.J. Assessment and monitoring of glycemic control in children and adolescents with diabetes. Pediatric Diabetes. 2009. Vol. 10 (Suppl. 12). P. 71-81. DOI: 10.1111/j.1399-5448.2009.00582.x.
- Miller K.M., Beck R.W., Bergenstal R.M., et al. Evidence of a strong association between frequency of self-monitoring of blood glucose and hemoglobin A1c levels in T1D exchange clinic registry participants. Diabetes Care. 2013. Vol. 36. № 7. P. 2009-2014. DOI: 10.2337/dc12-1770.
- Ziegler R., Heidtmann B., Hilgard D., Hofer S., Rosenbauer J., Holl R. Frequency of SMBG correlates with HbA1c and acute complications in children and adolescents with type 1 diabetes. Pediatric Diabetes. 2011. Vol. 12. № 1. P. 11-17. DOI: 10.1111/j.1399-5448.2010.00650.x.
- Davidson M., Penney E.D., Muller B., Grey M. Stressors and self-care challenges faced by adolescents living with type 1 diabetes. Applied Nursing Research. 2004. Vol. 17. № 2. P. 72-80. DOI: 10.1016/j.apnr.2004.02.006.
- Hains A.A., Berlin K.S., Davies W.H., Parton E.A., Alemzadeh R. Attributions of adolescents with type 1 diabetes in social situations: relationship with expected adherence, diabetes stress, and metabolic control. Diabetes Care. 2006. Vol. 29. № 4. P. 818-822.
- Borus J.S., Laffel L. Adherence challenges in the management of type 1 diabetes in adolescents: prevention and intervention. Curr. Opin. Pediatr. 2010. Vol. 22. № 4. P. 405-411. DOI: 10.1097/MOP.0b013e32833a46a7.
- Carroll A.E., Downs S.M., Marrero D.G. What adolescents with type I diabetes and their parents want from testing technology: a qualitative study. Comput. Inform. Nurs. 2007. Vol. 25. № 1. P. 23-29. DOI: 10.1097/00024665-200701000-00009.
- Dickinson J.K., O’Reilly M.M. The lived experience of adolescent females with type 1 diabetes. Diabetes Educ. 2004. Vol. 30. № 1. P. 99-107. DOI: 10.1177/014572170403000117.
- Miller K.M., Foster N.C., Beck R.W., et al. Current state of type 1 diabetes treatment in the US: updated data from the T1D exchange clinic registry. Diabetes Care. 2015. Vol. 38. № 6. P. 971-978. DOI: 10.2337/dc15-0078.
- Westen S.C., Warnick J.L., Albanese-O’Neill A., et al. Objectively measured adherence in adolescents with type 1 diabetes on multiple daily injections and insulin pump therapy. J. Pediatr. Psychol. 2019 . Vol. 44. № 1. P. 21-31. DOI: 10.1093/jpepsy/jsy064.
- Saoji N., Palta M., Young H., et al. The relationship of type 1 diabetes self-management barriers to child and parent quality of life: a US cross-sectional study. Diabet. Med. 2018. Vol. 35. № 11. P. 1523-1530. DOI: 10.1111/dme.13760.
- Foster N.C., Beck R.W., Miller K.M., et al. State of type 1 diabetes management and outcomes from the T1D Exchange in 2016–2018. Diabetes Technol. Ther. 2019. Vol. 21. № 2. P. 66-72. DOI: 10.1089/dia.2018.0384.
- Datye K.A., Moore D.J., Russell W.E., Jaser S.S. A review of adolescent adherence in type 1 diabetes and the untapped potential of diabetes providers to improve outcomes. Curr. Diab. Rep. 2015. Vol. 15. № 8. P. 621. DOI: 10.1007/s11892-015-0621-6.
- Blackwell M., Tomlinson P.A., Rayns J., et al. Exploring the motivations behind misreporting self-measured blood glucose in adolescents with type 1 diabetes — a qualitative study. J Diab. Metab Disord. 2016. Vol. 15, № 1. P. 16. DOI: 10.1186/s40200-016-0238-6.
- Blackwell M., Wheeler B.J. Clinical review: the misreporting of logbook, download, and verbal self-measured blood glucose in adults and children with type I diabetes. Acta Diabetol. 2017. Vol. 54. № 1. P. 1-8. DOI: 10.1007/s00592-016-0907-4.
- Edge J., Acerini C., Campbell F., et al. An alternative sensor-based method for glucose monitoring in children and young people with diabetes. Arch. Dis. Child. 2017. Vol. 102. № 6. P. 543-549. DOI: 10.1136/archdischild-2016-311530.
- Bailey T., Bode B.W., Christiansen M.P., et al. The performance and usability of a factory-calibrated flash glucose monitoring system. Diabetes Technol. Ther. 2015. Vol. 17. № 11. P. 787-794. DOI: 10.1089/dia.2014.0378.
- Campbell F., Bolinder J. FreeStyle Libre™ use for self-management of diabetes in teenagers and young adults. Diabetes. 2018. Vol. 67 (Suppl. 1). P. 158-LB.
- Campbell F.M., Murphy N.P., Stewart C., et al. Outcomes of using flash glucose monitoring technology by children and young people with type 1 diabetes in a single arm study. Pediatr. Diabetes. 2018. Vol. 19. № 7. P. 1294-1301.
- Bolinder J., Antuna R., Geelhoed-Duijvestijn P., Kröger J., Weitgasser R. Novel glucose-sensing technology and hypoglycaemia in type 1 diabetes: a multicentre, non-masked, randomised controlled trial. Lancet. 2016. Vol. 388. № 10057. P. 2254-2263. DOI: 10.1016/S0140-6736(16)31535-5.
- de Bock M., Rossborough J., Siafarikas A., et al. Insulin pump therapy in adolescents with very poor glycemic control during a 12-month cohort trial. J. Diabetes Sci. Technol. 2018. Vol. 12. № 5. P. 1080-1081. DOI: 10.1177/1932296818769338.
- Varni J.W., Seid M., Rode C.A. The PedsQL™: measurement model for the pediatric quality of life inventory. Med. Care. 1999. Vol. 37. № 2. P. 126-139. DOI: 10.1097/00005650-199902000-00003.
- Varni J.W., Seid M., Kurtin P.S. PedsQL™ 4.0: reliability and validity of the pediatric quality of life inventory™ version 4.0 generic Core scales in healthy and patient populations. Med. Care. 2001. Vol. 39. № 8. P. 800-812. DOI: 10.1097/00005650-200108000-00006.
- Cox D.J., Irvine A., Gonder-Frederick L., et al. Fear of hypoglycemia: quantification, validation, and utilization. Diabetes Care. 1987. Vol. 10. № 5. P. 617-621. DOI: 10.2337/diacare.10.5.617.
- Gonder-Frederick L., Nyer M., Shepard J.A., Vajda K., Clarke W. Assessing fear of hypoglycemia in children with type 1 diabetes and their parents. Diabetes Manag. 2011. Vol. 1. № 6. P. 627-639. DOI: 10.2217/DMT.11.60.
- Bradley C. Diabetes treatment satisfaction questionnaire. Handbook of psychology and diabetes: a guide to psychological measurement in diabetes research and practice. Еd. C. Bradley. Chur: Harwood Academic Publishers, 1994. P. 111-132.

/8.jpg)
/9.jpg)