Актуальність
Гострі діареї належать до частих причин звернень за медичною допомогою дітей раннього віку. За даними ВООЗ, у світі кожного року загальна кількість хворих на кишкові інфекції сягає 1–1,2 млрд випадків. Гострі кишкові інфекції є одними з найчастіших інфекційних хвороб дитячого віку та займають третє місце за частотою смертності дітей віком до 5 років [1]. Збудниками інфекційних діарей на початку ХХI століття найчастіше виступають ентеропатогенні мікроорганізми Escherichia coli, Campylobacter jejuni, Yersinia enterocolitica, Salmonella enteritidis, рідше Shigella dysenteriae [2]. Cеред вірусних агентів діарей превалюють рота-, адено- та норовіруси [3]. Giardia lamblia та Endamoeba histolitica залишаються найчастішими паразитарними збудниками [4]. Усі ці патогени мають спільні, але й деякі особливі механізми пошкодження кишечника. Так, ураження ентеро- та колоноцитів, що притаманне бактеріальним збудникам, може призвести до секреторної діареї, коли в кишковому вмісті накопичуються іони натрію і хлору. Це призводить до значної втрати електролітів і рідини з діарейними випорожненнями. Ці ж самі інфекційні збудники можуть викликати глибоку альтерацію слизової оболонки з виникненням кровотеч. Таким чином формується так звана інвазивна діарея. Пошкодження функції гідролізу вуглеводів, яке відбувається насамперед за умов дії вірусів на війчасту поверхню ентероцитів, призводить до мальдигестії та мальабcорбції вуглеводів з розвитком гіперосмолярності кишкового вмісту, що значно збільшує кількість хімусу у зв’язку з накопиченням води, і виникає діарея.
Прийнято вважати, що групу гострих діарей також становлять і так звані неорганічні, тобто функціональні, порушення травлення [5]. З одного боку, їх виникненню може сприяти токсемія під час інфекційно-запальних позакишкових захворювань, таких як інфекції сечовивідної та бронхолегеневої систем. Це так звані парентеральні діареї [6]. При таких діареях зазвичай інфекційні збудники в кишечнику не виявляються. З іншого боку, певну діагностичну проблему становлять діареї неінфекційної природи. У їх виникненні відіграють важливу роль фактори порушень догляду, виховання і харчування маленьких дітей. Класичним прикладом є так звана Toddler’s diarrhea, яка виникає у дітей при надлишковому надходженні вуглеводів з їжею в поєднанні з дефіцитом жирів [7].
При всіх видах гострих діарей порушується стан мікробіому кишечника, зміни якого залежать від різноманітних факторів патогенезу діарей. Порушення метаболічної активності природної мікробіоти призводить до підвищення моторної активності кишечника. Водночас виникають складні порушення стану ЦНС, які не тільки сприяють погіршенню перебігу діареї, але й можуть формувати персистуючі розлади функціонування шлунково-кишкового тракту (ШКТ) у майбутньому [8]. Функціональні розлади кишечника кваліфіковані за Римськими критеріями IV [9, 10] як рецидивуючий доброякісний абдомінальний біль (Abdominal Pain-related FGiDs, H2) та функціональна діарея (Functional Diarrhea, G5). Висловлюються думки, що ці стани у дітей раннього віку часто мають зв’язок з перенесеною гострою діареєю [11, 12]. Патогенез цих патологічних станів досі недостатньо з’ясований та продовжує вивчатись [11, 13]. Діагноз «функціональна діарея» можна встановлювати вже за 2 тижні після гострої діареї [14], з обов’язковим виключенням органічних причин розладів. Суттєвою проблемою функціональних розладів травлення є те, що від початку їх розвитку до встановлення діагнозу зазвичай проходить певний час, дітей госпіталізують до стаціонару, де проводять емпіричну терапію, часто із застосуванням антибіотиків. На сьогодні не знайдено достатньо специфічних маркерів, які б із високою ймовірністю вказували на загрозу формування функціональних кишкових розладів у дітей перших років життя. Саме тому існує загроза негативного впливу пізньої діагностики функціональних розладів кишечника на якість життя не тільки дитини, але й її родини. Ми вважаємо за доцільне подальше дослідження механізмів та пошук предикторів розвитку функціональних порушень функції кишечника після перенесеної гострої діареї різної етіології у дітей раннього віку для оптимізації їх лікування.
Мета дослідження — оцінити частоту та характер порушень з боку кишечника у дітей молодшої вікової групи протягом 6 місяців після перебування в лікувально-діагностичному стаціонарі з приводу гострої діареї інфекційного або неінфекційного походження та встановити їх зв’язки із копрологічними лабораторними показниками — фекальним кальпротектином (ФКП), умістом вуглеводів (редукуючих субстанцій, РС), молочної кислоти (МК) та коротколанцюгових жирних кислот (КЛЖК), одержаними на висоті захворювання.
Матеріали та методи
Дослідження проведене на базі інфекційно-боксованого діагностичного відділення КНП «Міська дитяча лікарня № 5» м. Запоріжжя (головний лікар — А.Г. Запорожченко). У ньому взяли участь 47 дітей віком від 6 до 24 місяців. З них було 19 дівчаток та 28 хлопчиків. Критеріями включення були вік дітей, гостра діарея з оцінкою випорожнень у 5–7 балів за Бристольською шкалою, що потребувала госпіталізації до стаціонару не пізніше третьої доби від початку захворювання, письмова згода батьків на участь у дослідженні. До захворювання всі діти знаходились на грудному вигодовуванні з вчасним введенням прикорму згідно зі стандартами ВООЗ. Критеріями виключення були відмова батьків від участі у дослідженні, гостра хірургічна патологія ШКТ, інвазивні форми гострої інфекційної діареї, стан гематохезії, вроджені аномалії ШКТ та імунодефіцитні стани, хронічні захворювання, які супроводжуються мальабсорбцією та мальдигестією, які передували виникненню діареї.
Усім дітям проводився забір калу в перші години госпіталізації для проведення мікроскопічних, мікробіологічних, імунохроматографічних та біохімічних досліджень. Вони включали посіви калу на селективні субстрати для верифікації збудників кишкової групи мікробних патогенів. Досліджували наявність у фекаліях токсинів А/В Clostridium difficile (Vegal Farmaceutica S. L., Іспанія), проводили імунохроматографічні тести для виявлення ротавірусу (Cito Test Rota, Pharmasco, Україна) та аденовірусу (Adenovirus, Vegal Farmaceutica S. L., Іспанія). Мікроскопічне дослідження нативних зразків калу проводили для виявлення цист або вегетативних форм лямблій. Імунохроматографічним напівкількісним методом досліджували наявність гемоглобіну людини в калі в концентрації ≥ 50 нг/мл (Fecal Occult Blood, Vegal Farmaceutica S. L., Іспанія), що характерно для гематохезії при інвазивній діареї.
Для визначення загального відсоткового вмісту вуглеводів у випорожненнях (редукуючих субстанцій) було використано пробу Бенедикта. Фекальний кальпротектин як загальний маркер запального процесу у слизовій оболонці кишечника вимірювали імуноферментним методом (Buhlmann fеcal ELISA Calprotectin, Швейцарія).
Кількісний вміст молочної кислоти та коротколанцюгових жирних кислот — оцтової (ОК), масляної (бутирової, БК) та пропіонової (ПК) визначали за допомогою мас-хроматоспектрометричного дослідження на апаратурі LC MS Agilent 1260 Infinity HPLC System, США (Degasser, Bynary Pump, Autosampler, ColumnsC18, Thermostat Column Compartment, single-quadrupole mass spectrometer 6120 with electrospray ion-source), з комп`ютерною підтримкою програм OpenLAB CDS Software.
Статистична обробка отриманих даних проводилась за допомогою програми Statistica 13 for Windows (StatSoft Inc., номер реєстрації JPZ8041382130ARCN10-J) з розрахунком значень копрологічних тестів (M ± m), коефіцієнтів парної кореляції Спірмена для аналізу зв’язку між ранговими оцінками показників катамнезу та статистичним варіюванням ФКП, РС, КЛЖК, МК. Розрахунки відношення шансів (Odd Ratio) використані для визначення дихотомічних порівнянь частот у досліджуваних групах.
За результатами спостережень, у досліджених групах хворих не було виявлено ознак гематохезії, наявності кишкових паразитів, токсинів Clostridium difficilе або аденовірусів. За діагностичними ознаками, з огляду на наявність або відсутність збудника інфекційної діареї бактеріальної або вірусної етіології, з урахуванням клінічного стану хворих (супутніх захворювань, лихоманки, анемії, підвищення ШОЕ) та додаткових методів обстеження (ФКП, РС), дітей було розподілено на 4 групи.
У I групу дослідження увійшли 18 пацієнтів з гострим бактеріальним гастроентеритом (МКХ-10: А02, А04.6, А04.0, А04.5), викликаним у 12 хворих Kampilobacter jejuni, у 2 — Escherichia coli О-18, в 1 — Escherichia coli О-44, у 2 — Salmonella enteritidis, в 1 пацієнта — Yersinia enterocolitica. Стан хворих клінічно був оцінений як середньої тяжкості або тяжкий та характеризувався підвищенням температури тіла понад 37,2 °С у 72 % дітей, блюванням у 50 %, зниженим апетитом у 100 %. Анемія з Hb ≤ 100 г/л виявлена у 22,2 %. Підвищення ФКП більше нормальних значень 500 мкг/г було у всіх хворих, ознаки мальдигестії вуглеводів (РС > 0,25 %) виявлялись у 94 % випадків. МК у випорожненнях у середньому (М ± m) дорівнювала 0,15 ± 0,07 ммоль/л, КЛЖК становили: ОК — 245,58 ± 51,88 ммоль/л, ПК — 6,35 ± 3,24 ммоль/л, БК — 4,22 ± 2,73 ммоль/л.
ІІ групу становили 11 дітей з вірусним гастроентеритом ротавірусної етіології (МКХ-10: А08.0). Майже всі хворі клінічно характеризувались тяжким станом, лихоманкою, блюванням, зниженим апетитом. Анемія виявлялась у 10 % хворих. Підвищені показники ФКП були у 80 %, а РС — у 100 % хворих. Показники КЛЖК становили: ОК — 395,41 ± 53,10 ммоль/л, ПК — 16,10 ± 7,30 ммоль/л, БК — 2,01 ± 0,77 ммоль/л. МК дорівнювала 0,100 ± 0,063 ммоль/л.
У III групу ввійшли 11 дітей з парентеральною діареєю (МКХ-10: K52.9), яка виникла на тлі запальних позакишкових захворювань: гострого середнього отиту — у 5 хворих, негоспітальної пневмонії — у 5 дітей, пієлонефриту — в 1 дитини. Саме ці стани значною мірою порушували загальний стан дітей. Водночас вже на початку захворювання у хворих виявлено часті та рідкі випорожнення, які відповідали 5–6-й градаціям Бристольскої шкали. Бактеріологічні, вірусологічні, токсикологічні, імунохроматографічні та мікроскопічні засоби обстеження не виявили збудників кишкової інфекції, включно з токсинами Clostridium difficile A/B. Цим дітям також не були притаманні підвищені показники ФКП та РС та анемія. Середні показники МК у випорожненнях становили 0,15 ± 0,06 ммоль/л, ОК — 550,52 ± 198,52 ммоль/л, ПК — 5,87 ± 3,28 ммоль/л, БК — 3,65 ± 2,89 ммоль/л.
До IV групи увійшли 7 дітей із встановленим у стаціонарі клінічним діагнозом «функціональне порушення травлення» (МКХ-10: К59), які також мали негативні результати бактеріологічних, вірусологічних, імунохроматографічних та мікроскопічних досліджень. Клінічний стан дітей був середньотяжким, характеризувався виключно діарейним синдромом, без блювання та анемії. ФКП був у межах норми (> 500 мкг/г), але рівень РС був підвищений у 6 із 7 хворих — 0,43 ± 0,13 %. Середні показники МК становили 0,07 ± 0,03 ммоль/л, ОК — 315,78 ± 129,46 ммоль/л, ПК — 1,87 ± 0,66 ммоль/л, БК — 1,32 ± 0,71 ммоль/л.
Діти перебували в стаціонарі від 3 до 11 діб і були виписані після нормалізації загального стану і покращення випорожнень. За 3 та 6 місяців після виписки зі стаціонару проведено пряме інтерв’ювання батьків щодо наявності у дітей скарг на порушення стану кишкового здоров’я. Завдяки одержаному катамнезу стало можливим виявити дітей, відновлення стану кишечника у яких було неповним, і вони навіть підпадали під Римські діагностичні критерії функціональних порушень травлення. Ключовими ознаками були рідкі випорожнення (функціональна діарея, G5) та абдомінальний біль (H2). Біль у животі спостерігався у дітей у денний період, найчастіше після годування, від одного до декількох випадків на тиждень, та не супроводжувався лихоманкою, блюванням. Біль зникав так само раптово, як і з’являвся. Рідкі випорожнення, які відповідали 5–6-му ступеням Бристольскої шкали, мали непостійний характер, також без лихоманки, блювання або домішок крові в фекальних масах. Тести на токсини Clostridium difficile для виключення антибіотикоасоційованої діареї були негативними. За весь період катамнестичного спостереження батьки лише 2 дітей були змушені знову звернутись за стаціонарною допомогою. Частіше діти отримували лікування у дільничного лікаря. У більшості пацієнтів загальний стан не був порушений, незважаючи навіть на рідкі випорожнення, і темпи зростання маси тіла відповідали віковим нормам.
Під час збору катамнезу вираженість кишкових розладів оцінювали у балах — від 1 до 4, які в подальшому використовували в кореляційному аналізі. Якщо діарея або абдомінальний біль турбували пацієнтів два та більше рази на тиждень та довше ніж 14 діб, такі скарги оцінювали в 4 бали. Коли епізоди спостерігались 1–2 рази на місяць або один епізод продовжувався більше 14 діб, то такий стан оцінювали в 2 та 3 бали відповідно, і нарешті, якщо скарги не відмічались, такий стан оцінювався в 1 бал.
Результати
За результатами дослідження встановлено, що у 27 із 47 дітей (57 %) протягом першого півріччя спостереження після виписки зі стаціонару відзначалися скарги на кишкові розлади. Найчастіше порушення стану кишечника виникали у дітей, які перенесли бактеріальний гастроентерит. Так, лише у 4 з 18 дітей І групи встановлено повне відновлення кишкового здоров’я після виписки зі стаціонару, і діти не демонстрували ніяких скарг з боку шлунково-кишкового тракту. На відміну від них у інших дітей спостерігали епізоди рідких випорожнень тривалістю від 1 до 3 діб з періодичністю від 1 раза на місяць до майже щотижневої діареї. Частіше такі скарги виникали в перші 3 місяці після перенесеної бактеріальної діареї, а далі ставали менш частими. Проте 2 дітей з І групи дослідження, незважаючи на отримання низьколактозної дієти та пробіотичних препаратів після виписки зі стаціонару, мали майже постійні прояви хронічної діареї протягом півроку катамнестичного спостереження, хоча раніше їх не мали.
Так само часто у дітей І групи виникали скарги на раптовий абдомінальний біль — у 13 з 18 обстежених у катамнезі.
Таким чином, клінічний стан, який відповідав функціональним порушенням кишечника, спостерігався майже у 78 % дітей І групи.
У ІІ групі після перенесеного ротавірусного гастроентериту скарги на кишкові розлади були менш частими. Повне відновлення випорожнень після хвороби та відсутність скарг спостерігались у 5 з 11 дітей. У 6 інших дітей епізоди рідких випорожнень були рідкими і мінливими та найчастіше зникали в перші 3 місяці після лікування. Ще у 3 з 11 дітей розлади з боку кишечника відповідали Н2. У той час, коли абдомінальний біль не хвилював дитину, вона почувала себе задовільно. Часто полегшення болю збігалося з дефекацією.
У III та IV групах у катамнезі взагалі майже не спостерігалось розвитку функціональних розладів травлення. Під час двохразового прямого інтерв’ювання батьки не відмічали у дітей суттєвих скарг з боку ШКТ, ані рідких випорожнень, ані раптового абдомінального болю, або ці скарги були мінливими і не порушували самопочуття та активності дітей. Результати опитування батьків наведені в табл. 1.
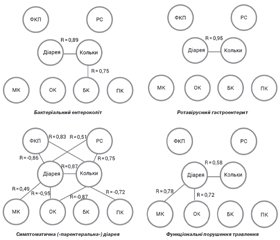
Система статистично значущих (р < 0,05) кореляційних зв’язків між бальними оцінками скарг щодо кишкових порушень, які турбували дітей після виписки зі стаціонару, та варіабельністю копрологічних тестів, що відповідають інтенсивності запалення кишечника, порушенням дигестії та абсорбції вуглеводів і метаболічної активності мікробіому за вмістом жирних кислот під час перебування в стаціонарі наведена на рис. 1.
/29.jpg)
При аналізі катамнезу визначено існування статистично значущих кореляцій між частотою виникнення діареї та/або абдомінального болю протягом 6 місяців у періоді відновлення дітей після перенесеної діареї та значеннями обраних копрологічних показників під час гострої діареї (рис. 1). Кореляційні «плеяди» бактеріального ентероколіту та вірусного гастроентериту схожі за обмеженою кількістю зв’язків. Проте найбільшу кількість кореляційних зв’язків демонструють показники хворих на симптоматичну («парентеральну») діарею. У цій системі присутні як прямі кореляції інтенсивності кишкових розладів з підвищенням рівня ФКП, РС та МК, так і зворотні кореляції із вмістом жирних кислот, коли їх низькі концентрації у випорожненнях відповідали появі порушень кишечника. Важливою особливістю дітей IV групи з функціональними порушеннями травлення є наявність прямих кореляцій між виникненням рецидивів рідких випорожнень та рівнем оцтової й молочної кислот.
Підбиваючи підсумки щодо характеристики кореляційних плеяд, треба відзначити наявність сталих прямих зв’язків між частотою та інтенсивністю виникнення діареї та абдомінального болю у всіх досліджуваних групах.
Обговорення
Катамнез дітей раннього віку, досліджений протягом 6 місяців після перенесеної гострої діареї інфекційної або неінфекційної етіології, свідчить, що майже в половині випадків після гострої діареї, яка потребувала госпіталізації в стаціонар, спостерігається розвиток функціональних порушень кишечника. У 55,3 % пацієнтів були періодично рідкі випорожнення, а в 42,6 % — абдомінальний біль. Ці порушення були пов’язані з етіологією перенесеної гострої діареї. Так, діти, які перенесли гострий бактеріальний ентероколіт (І група), частіше (13 із 18) мали скарги на рецидивуючий абдомінальний біль порівняно з дітьми II групи (3 із 11; OR = 5,3, DI 1,02–27,80, p = 0,05), а також ІІІ групи (2 із 11; OR = 9,0, DI 1,46–55,50, p = 0,02) та ІV групи (2 із 7; OR = 5,0, DI 0,74–9,37, p = 0,1). Також часто у дітей І групи виникали скарги на рідкі випорожнення (14 із 18) порівняно з меншою частотою розладів у дітей ІІ групи (6 із 11; OR = 5,3, DI 1,02–27,80, p = 0,05), ІІІ групи (4 із 11; OR = 5,3, DI 1,02–27,80, p = 0,05) та IV групи (2 із 7; OR = 5,3, DI 1,02–27,80, p = 0,05).
Виникнення порушень випорожнень та періодичного абдомінального болю в періоді відновлення кишечника у дітей після гострих діарей, ймовірно, об’єднане єдиними патогенетичними механізмами, тому що найчастіше вони виникають разом. Проте у кожному конкретному випадку, як показало дослідження кореляцій, залежно від перенесеного захворювання кишкові розлади формуються дещо різними факторами. За даними кореляційного аналізу, постінфекційні розлади як після бактеріальних, так і після вірусних діарей (I та II групи) формуються незалежно від порушень гідролізу вуглеводів і розладів метаболічної активності мікробіому кишечника за показниками КЛЖК. Натомість функціональні порушення у дітей, які виникли після симптоматичної («парентеральної») діареї (ІІІ група), пов’язані численними прямими зв’язками із ступенем запалення та мальабсорбції. Водночас у цих дітей мають значення перенесена гіпоксія кишечника (прямі кореляції з рівнем МК) та значні відхилення метаболічної активності мікроорганізмів кишечника з розвитком дефіциту оцтової та пропіонової кислот як важливих компонентів енергетичного забезпечення ентеро- та колоноцитів [15]. Діарейний синдром, який залишався у дітей з функціональними порушеннями травлення (ІV група), пояснювався перенесеним гіпоксичним станом і накопиченням оцтової кислоти, яка в цьому разі виступала як стимулятор перистальтики [16]. Отримані результати свідчать про розвиток насамперед складних порушень моторики кишечника після інфекційних (вірусних або бактеріальних) діарей. На противагу цьому можливими провідними механізмами постдіарейних розладів у хворих на симптоматичну діарею та функціональні розлади травлення були інтенсивність запалення за даними ФКП, мальдигестія вуглеводів з накопиченням РС, гіпоксичний стан слизової кишечника та порушення функціонування кишкового мікробіому за показниками МК та КЛЖК.
Таким чином, інформація щодо етіології гострої діареї (інфекційна або неінфекційна) та досліджених копрологічних маркерів може бути використана для прогнозу стану відновлення здоров’я дітей після перенесеної гострої діареї.
Висновки
1. Після перенесеної гострої діареї, яка потребувала госпіталізації, у дітей віком 6–24 місяці за даними піврічного катамнезу повне відновлення функції кишечника відбулось лише у половині випадків.
2. Скарги батьків на періодичні або майже постійні рідкі випорожнення та/або періодичний доброякісний абдомінальний біль у дітей найчастіше виникали після перенесеного бактеріального ентероколіту (відповідно у 78 та 55 %) порівняно з ротавірусним ентероколітом (у 55 та 27 %), симптоматичною («парентеральною») діареєю (у 36 та 18 %) або функціональними порушеннями травлення (29 %).
3. Між частотою розвитку та інтенсивністю функціональних порушень кишечника як наслідків перенесеного бактеріального ентероколіту, так само як і після ротавірусного гастроентериту, та рівнями ФКП, РС, МК та КЛЖК не виявлено суттєвих асоціацій.
4. На противагу цьому у дітей, які були госпіталізовані з симптоматичною («парентеральною») діареєю, що виникла на тлі позакишкових інфекційно-запальних захворювань, залишкові явища з боку кишечника (діарея та абдомінальний біль) були асоційовані із ступенем підвищення ФКП (відповідно R = 0,83 та 0,86, р < 0,05), РС (R = 0,75 та 0,87, р < 0,05), МК (R = 0,49, р = 0,05) та зниженням ОК (R = –0,87 та –0,90, р < 0,01) та ПК (R = –0,72, р < 0,05) під час госпіталізації.
5. Діарея як прояв функціонального порушення травлення у віддаленому періоді спостереження характеризувалась найбільш сприятливим перебігом. Нечисленні випадки скарг на персистенцію рідких випорожнень були асоційовані з порушеннями метаболічної активності кишкової мікрофлори, насамперед з накопиченням у кишковому вмісті ОК.
Перспективи подальших досліджень. Одержані дані дозволяють використати обрані копрологічні показники для розробки методів прогнозування стану здоров’я дітей у найближчому періоді після перенесеної діареї, а також диференційовано обирати терапію залежно від переважання несприятливих механізмів розвитку порушень функції кишечника.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 17.08.2022
Рецензовано/Revised 26.08.2022
Прийнято до друку/Accepted 05.09.2022

/28.jpg)
/29.jpg)