Международный эндокринологический журнал Том 18, №7, 2022
Вернуться к номеру
Дослідження альфа-дефензину при ішемічній хворобі серця і цукровому діабеті 2-го типу на ґрунті метаболічного синдрому
Авторы: Чмир Н.В., Дутка Р.Я., Абрагамович Х.Я., Федечко Й.М., Курбан М.М.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
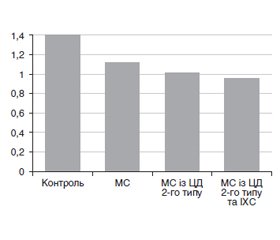
Актуальність. Поширеність метаболічного синдрому (МС), кластера факторів ризику виникнення цукрового діабету (ЦД) та ішемічної хвороби серця (ІХС), щорічно зростає. МС пов’язаний із зростанням практично вдвічі ризику виникнення серцево-судинних ускладнень і збільшенням у півтора раза смертності від усіх причин. Однією з патогенетичних ланок розвитку метаболічного синдрому є системне запалення. Зростає поширеність досліджень у хворих з метаболічним синдромом альфа-дефензинів — індукторів запалення з антимікробними властивостями. Однак зміни рівня альфа-дефензину в сироватці крові при метаболічному синдромі за наявності й відсутності ЦД 2-го типу й синтропічної ішемічної хвороби серця залишаються вивченими недостатньо, що й зумовлює доцільність проведення цього дослідження. Мета роботи: дослідити рівні альфа-дефензину в сироватці крові осіб з метаболічним синдромом, цукровим діабетом 2-го типу та ішемічною хворобою серця. Матеріали та методи. Обстежено 54 пацієнтів (27 жінок, 27 чоловіків) з МС, ЦД 2-го типу та ІХС. Дослідження проводили в Львівському обласному державному клінічному лікувально-діагностичному ендокринологічному центрі та КНП «Львівське територіальне медичне об’єднання «Клінічна лікарня планового лікування, реабілітації та паліативної допомоги», КНП «5-та міська клінічна лікарня м. Львова». Хворих із МС поділено на 3 підгрупи залежно від наявності ЦД 2-го типу та ІХС. До першої підгрупи (2а) увійшло 18 пацієнтів з МС без ЦД 2-го типу та без ІХС, до другої (2b) — 18 осіб з МС із ЦД 2-го типу, до третьої (2c) — 18 осіб з МС, ЦД 2-го типу та ІХС. Контрольну групу становили 16 здорових осіб (чоловіків — 8, жінок — 8) із числа працівників КНП «Львівське територіальне медичне об’єднання «Клінічна лікарня планового лікування, реабілітації та паліативної допомоги», КНП «5-та міська клінічна лікарня м. Львова». Пацієнтам визначали рівень альфа-дефензину, а також показники ліпідного спектра (рівень ліпопротеїнів високої щільності (ЛПВЩ), ліпопротеїнів дуже низької щільності (ЛПДНЩ)), досліджували кореляційні взаємозв’язки між вищевказаними величинами. Результати. У роботі досліджено рівень альфа-дефензину й показники ліпідного спектра у хворих на МС, ІХС і ЦД 2-го типу. Рівень альфа-дефензину в усіх досліджуваних пацієнтів з МС, як без ЦД 2-го типу та ІХС, так і з ЦД 2-го типу та ІХС (18,4 ± 0,89 нг/мл; 24,4 ± 1,2 нг/мл і 29,1 ± 1,1 нг/мл), був вірогідно підвищений і перевищував контрольні показники (3,72 ± 0,36 нг/мл) у 4,95; 6,56 і 7,82 раза (р < 0,05). Найвищими параметрами альфа-дефензину характеризувалась синтропічна патологія МС, ЦД 2-го типу та ІХС (29,1 ± 1,1 нг/мл), що вірогідно перевищувало показники групи МС із ЦД 2-го типу (24,4 ± 1,2 нг/мл) і групи МС без ЦД та ІХС (18,40 ± 0,89 нг/мл) (р < 0,05). Величини ХС ЛПВЩ у пацієнтів групи з МС (1,12 ± 0,08 нг/ мл), групи з МС і ЦД 2-го типу (1,01 ± 0,07 нг/ мл), з МС, ЦД 2-го типу та ІХС (0,95 ± 0,05 нг/мл) вірогідно знижені порівняно з параметрами групи здорових осіб (1,40 ± 0,14 нг/мл) (р < 0,5), проте вірогідної різниці між окремими підгрупами не виявлено (р > 0,5). Параметри ХС ЛПДНЩ були найвищими в пацієнтів із синтропічною патологією МС, ЦД 2-го типу та ІХС (1,32 ± 0,05 нг/мл) і вірогідно перевищували рівні ХС ЛПДНЩ як в осіб із МС із ЦД 2-го типу (0,87 ± 0,10 нг/мл), так і в пацієнтів із МС (0,73 ± 0,06 нг/мл) (р > 0,05). Проведено кореляційний аналіз між альфа-дефензином і показниками ліпідного обміну. Виявлено прямий сильний кореляційний зв’язок (r = 0,72; р < 0,5) між альфа-дефензином і ХС ЛПДНЩ у пацієнтів з МС. У хворих з МС із ЦД 2-го типу та ІХС також виявлено прямий сильний кореляційний зв’язок між альфа-дефензином і ХС ЛПДНЩ (r = 0,65; р < 0,5). У пацієнтів з МС і ЦД 2-го типу виявлено слабкий кореляційний зв’язок (r = 0,1; р < 0,5). Кореляційний аналіз між рівнями альфа-дефензину і ХС ЛПВЩ виявив лише наявність слабких кореляційних зв’язків (r = –0,15; r = –0,11; r = –0,16; р < 0,5). Висновки. Виявлено вірогідне підвищення рівня альфа-дефензину в пацієнтів за наявності МС, ЦД 2-го типу та ІХС. Величини ХС ЛПВЩ вірогідно знижені в усіх пацієнтів з МС незалежно від наявності чи відсутності ЦД 2-го типу та ІХС. Параметри ХС ЛПДНЩ залежно від наявності синтропічної патології були найвищими у пацієнтів з МС, ЦД 2-го типу та ІХС, вірогідно перевищували рівні ХС ЛПДНЩ як в осіб з МС із ЦД 2-го типу, так і в пацієнтів з МС. Встановлено кореляційні зв’язки між показниками альфа-дефензину і ХС ЛПДНЩ, особливо виражені за наявності ІХС і МС.
Background. The prevalence of metabolic syndrome (MS), a cluster of risk factors for type 2 diabetes mellitus (DM) and coronary artery disease (CAD), is increasing annually. MS is associated with an almost 2-fold increase in the risk of cardiovascular complications and 1.5-fold increase in all-cause mortality. Systemic inflammation is considered to be one of the pathogenetic links in the development of MS. The study of alpha defensins as inducers of inflammation with antimicrobial properties in patients with MS is increasing. However, changes in the serum level of alpha defensin in MS, with or without type 2 DM and CAD, remain insufficiently studied that determines the feasibility of conducting this study. The objective: to evaluate serum levels of alpha defensin in individuals with metabolic syndrome, type 2 diabetes mellitus and coronary artery disease. Materials and methods. Fifty-four patients (27 women, 27 men) with MS, type 2 DM and CAD were examined. The research was carried out at the Lviv Regional State Clinical Medical and Diagnostic Endocrinology Center and Lviv Territorial Medical Association “Clinical Hospital of Planned Treatment, Rehabilitation and Palliative Care”, Lviv City Clinical Hospital 5. Patients with MS were divided into 3 subgroups, depending on the presence of type 2 DM and CAD. The first subgroup included 18 individuals with MS without type 2 DM and CAD, the second — 18 people with MS and type 2 DM, the third — 18 patients with MS, type 2 DM and CAD. The control group consisted of 16 healthy people (8 men, 8 women), the employees of the Lviv Territorial Medical Association “Clinical Hospital of Planned Treatment, Rehabilitation and Palliative Care”, Lviv City Clinical Hospital 5. In patients, the level of alpha defensin was determined, as well as blood lipids (high-density lipoproteins (HDL), very low-density lipoproteins (VLDL)), and the correlations between the above values were investigated. Results. The level of alpha defensin and blood lipids were examined in patients with MS, type 2 DM and CAD. The content of alpha defensin in all participants with MS, both with and without type 2 DM and CAD (18.40 ± 0.89, 24.4 ± 1.2, and 29.1 ± 1.1 ng/ml), was significantly increased and exceeded the control indicators (3.72 ± 0.36 ng/ml) by 4.95, 6.56, 7.82 times (p < 0.05). The highest parameters of alpha defensin were detected in MS combined with type 2 DM and CAD — 29.1 ± 1.1 ng/ml that significantly exceeded the parameters in patients with MS and type 2 DM (24.4 ± 1.2 ng/ml) and group of MS without type 2 DM and CAD (18.40 ± 0.89 ng/ml; p < 0.05). Values of HDL cholesterol in patients with MS (1.12 ± 0.08 ng/ml), MS and type 2 DM (1.01 ± 0.07 ng/ml), MS, type 2 DM and CAD (0.95 ± 0.05 ng/ml) significantly reduced compared to those in the group of healthy individuals (1.40 ± 0.14 ng/ml; р < 0.05), but no significant difference was found between individual subgroups (p > 0.5). The parameters of VLDL cholesterol were highest in patients with combination of MS, type 2 DM and CAD (1.32 ± 0.05 ng/ml), and significantly exceeded those in patients both with MS and type 2 DM (0.87 ± 0.10 ng/ml), and with MS (0.73 ± 0.06 ng/ml; p > 0.05). Comparative analysis was carried out for alpha defensin and blood lipids. A direct strong correlation (r = 0.72; р < 0.5) was found between alpha defensin and VLDL cholesterol in MS patients. In people with MS, type 2 DM and CAD, a direct strong correlation was also found between alpha defensin and VLDL cholesterol (r = 0.65; р < 0.5). In the group of MS and type 2 DM, a weak correlation was revealed (r = 0.1; р < 0.5). Only weak correlations were found between the levels of alpha defensin and HDL cholesterol (r = –0.15, r = –0.11, r = –0.16; р < 0.5). Conclusions. A significant increase in the level of alpha defensin was detected in patients with metabolic syndrome, type 2 diabetes mellitus and coronary artery disease. HDL cholesterol values are significantly reduced in all patients with metabolic syndrome, regardless of the presence or absence of type 2 diabetes mellitus and coronary artery disease. VLDL cholesterol parameters, depending on combined pathology, were highest in patients with metabolic syndrome, type 2 diabetes mellitus, and coronary artery disease, and significantly exceeded the levels of VLDL cholesterol in patients with both MS and type 2 diabetes mellitus, and with metabolic syndrome. Correlations were found between alpha defensin indicators and VLDL cholesterol, they were especially expressed in the presence of coronary artery disease and metabolic syndrome.
альфа-дефензин; ішемічна хвороба серця; цукровий діабет 2-го типу
alpha defensin; coronary artery disease; type 2 diabetes mellitus
Вступ
Матеріали та методи
Результати
/14_2.jpg)
Обговорення
Висновки
- Bovolini A., Garcia J., Andrade M.A., Duarte J.A. Metabolic Syndrome Pathophysiology and Predisposing Factors. Int. J. Sports Med. 2021. 42(3). 199-214. doi: 10.1055/a-1263-0898.
- Rochlani Y., Pothineni N.V., Kovelamudi S., Mehta J.L. Metabolic syndrome: pathophysiology, management, and modulation by natural compounds. Ther. Adv. Cardiovasc. Dis. 2017. 11(8). 215-225. doi: 10.1177/1753944717711379.
- Fahed G., Aoun L., Bou Zerdan M., Allam S., Bou Zerdan M., Bouferraa Y., Assi H.I. Metabolic Syndrome: Updates on Pathophysiology and Management in 2021. Int. J. Mol. Sci. 2022. 23(2). 786. doi: 10.3390/ijms23020786. PMID: 35054972; PMCID: PMC8775991.
- Bochar O.M., Sklyarova H.Y., Abrahamovych K.Y., Hromnatska N.M., Bochar V.T., Sklyarov E.Y. Metabolic syndrome, overweight, hyperleptinemia in children and adults. Wiad. Lek. 2021. 74(2). 313-316. DOI: 10.36740/WLek202102126.
- Claret M., Nogueiras R. Human defensin 5-based compounds: a new approach to fight obesity? Gut. 2022 Aug 12. gutjnl-2022-328158. doi: 10.1136/gutjnl-2022-328158. Epub ahead of print. PMID: 35961769.
- Taylor J.Y., Kraja A.T., de Las Fuentes L., Stanfill A.G., Clark A., Cashion A. An overview of the genomics of metabolic syndrome. J. Nurs. Scholarsh. 2013. 45(1). 52-9. doi: 10.1111/j.1547-5069.2012.01484.x.
- El-Mowafy M., Elgaml A., Abass N., Mousa A.A., Amin M.N. The antimicrobial peptide alpha defensin correlates to type 2 diabetes via the advanced glycation end products pathway. Afr. Health Sci. 2022. 22(1). 303-311. doi: 10.4314/ahs.v22i1.37. PMID: 36032426; PMCID: PMC9382481.
- Cai D., Khor S. “Hypothalamic Microinflammation” Paradigm in Aging and Metabolic Diseases. Cell. Metab. 2019. 30(1). 19-35. doi: 10.1016/j.cmet.2019.05.021. PMID: 31269425.
- Li B., Leung J.C.K., Chan L.Y.Y., Yiu W.H., Tang S.C.W. A global perspective on the crosstalk between saturated fatty acids and Toll-like receptor 4 in the etiology of inflammation and insulin resistance. Prog. Lipid. Res. 2020. 77. 101020. doi: 10.1016/j.plipres.2019.101020.
- Tsai S.S., Lin Y.S., Chen S.T., Chu P.H. Metabolic syndrome positively correlates with the risks of atherosclerosis and diabetes in a Chinese population. Eur. J. Intern. Med. 2018. 54. 40-45. doi: 10.1016/j.ejim.2018.04.009.
- Xia X., Xie Y., Gong Y., Zhan M., He Y., Liang X. et al. Electroacupuncture promoted intestinal defensins and rescued the dysbiotic cecal microbiota of high-fat diet-induced obese mice. Life Sci. 2022. 120961. doi: 10.1016/j.lfs.2022.120961. Epub ahead of print. PMID: 36116529.
- Dutheil F., Gordon B.A., Naughton G., Crendal E., Courteix D., Chaplais E. et al. Cardiovascular risk of adipokines: a review. J. Int. Med. Res. 2018 Jun. 46(6). 2082-2095. doi: 10.1177/0300060517706578. Epub 2017 Sep 25. PMID: 28974138; PMCID: PMC6023062.
- Maneerat Y., Prasongsukarn K., Benjathummarak S., Dechkhajorn W., Chaisri U. Increased alpha-defensin expression is associated with risk of coronary heart disease: a feasible predictive inflammatory biomarker of coronary heart disease in hyperlipidemia patients. Lipids Health Dis. 2016. 15. 117. doi: 10.1186/s12944-016-0285-5. PMID: 27430968; PMCID: PMC4949746.
- Russo M.F., Lembo E., Mari A., Angelini G., Verrastro O., Nanni G. et al. Insulin Resistance Is Central to Long-Term Reversal of Histologic Nonalcoholic Steatohepatitis After Metabolic Surgery. J. Clin. Endocrinol. Metab. 2021. 106(3). 750-761. doi: 10.1210/clinem/dgaa892. PMID: 33248441.
- Alberti K.G., Eckel R.H., Grundy S.M., Zimmet P.Z., Cleeman J.I., Donato K.A. et al.; International Diabetes Federation Task Force on Epidemiology and Prevention; Hational Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; International Association for the Study of Obesity. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. 2009. 120(16). 1640-5. doi: 10.1161/CIRCULATIONAHA.109.192644.
- Wong S.K., Chin K.Y., Ima-Nirwana S. Toll-like Receptor as a Molecular Link between Metabolic Syndrome and Inflammation: A Review. Curr. Drug Targets. 2019. 20(12). 1264-1280. doi: 10.2174/1389450120666190405172524. PMID: 30961493.
- Chiou W.C., Lai W.H., Cai Y.L., Du M.L., Lai H.M., Chen J.C. et al. Gut microbiota-directed intervention with high-amylose maize ameliorates metabolic dysfunction in diet-induced obese mice. Food Funct. 2022. 13(18). 9481-9495. doi: 10.1039/d2fo01211a. PMID: 35993118.
- Di Daniele N. Association of Dietary Patterns with Metabolic Syndrome. Nutrients. 2020 Sep 17. 12(9). 2840. doi: 10.3390/nu12092840. PMID: 32957427; PMCID: PMC7551145.

/14.jpg)
/15.jpg)
/15_2.jpg)