Международный эндокринологический журнал Том 18, №7, 2022
Вернуться к номеру
Взаємозв’язок недостатності вітаміну D з інсулінорезистентністю під час вагітності
Авторы: Бойчук А.В., Буднік Т.О.
Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України, м. Тернопіль, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
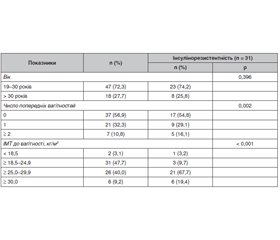
Недостатність вітаміну D пов’язана з метаболічними ускладненнями під час вагітності, включно з інсулінорезистентністю. Фізіологічні процеси під час вагітності сприяють посиленню резистентності до інсуліну, що, у свою чергу, є основною ознакою гестаційного діабету. Наявні відомості про те, що надмірне збільшення маси тіла під час вагітності негативно впливає на концентрацію 25-гідроксивітаміну D (25(OH)D). Мета: встановлення впливу недостатності й дефіциту вітаміну D під час вагітності на виникнення інсулінорезистентності в третьому триместрі на тлі надмірного збільшення маси тіла. Матеріали та методи. До проспективного дослідження включено 65 вагітних з терміном гестації до 20 тижнів (у середньому 17 тижнів). На початковому етапі було проведено анкетування (маса тіла до настання вагітності), клінічний огляд. Наступні обстеження проводили в другому (20 тижнів) і третьому (28 тижнів) триместрах вагітності. Приріст маси тіла під час вагітності розраховували як різницю у масі тіла (між третім і другим триместром), поділену на кількість тижнів вагітності в цьому інтервалі, дотримуючись рекомендацій Інституту медицини. Приріст гестаційної маси тіла класифікували як надмірний, враховуючи показники індексу маси тіла до вагітності. Прогнозування ймовірності виникнення інсулінорезистентності (за індексом HOMA-IR) здійснювали за динамікою збільшення маси тіла. Результати. Медіана 25(OH)D у другому і третьому триместрах вагітності становила 23 і 24 нг/мл відповідно. Недостатність вітаміну D (25(OH)D < 30 нг/мл) спостерігалася принаймні в одному з триместрів у 47 (72,3 %) вагітних, при цьому постійний характер недостатності вітаміну D відзначався у 36 (55,4 %) обстежених. Дефіцит вітаміну D був встановлений у 8 (12,3 %) вагітних у другому триместрі. У 34 (52,3 %) жінок спостерігалося надмірне збільшення маси тіла під час вагітності. Інсулінорезистентність визначена в 31 (47,7 %) вагітної в третьому триместрі. Медіана концентрації ІРІ та показника HOMA-IR була вищою серед жінок з недостатністю вітаміну D. Висновок. Недостатність вітаміну D пов’язана з інсулінорезистентністю в третьому триместрі вагітності, що залежить від надмірного гестаційного збільшення маси тіла.
Background. Vitamin D insufficiency is associated with metabolic complications during pregnancy, including insulin resistance. Physiological processes during pregnancy contribute to increased insulin resistance, which, in turn, is the main symptom of gestational diabetes. There is evidence that excessive weight gain during pregnancy negatively affects the concentration of 25-hydroxyvitamin D (25(OH)D). The aim of the study was to determine the effect of vitamin D insufficiency and deficiency during pregnancy on the occurrence of insulin resistance in the third trimester against the background of excessive weight gain. Materials and methods. The prospective study included 65 pregnant women with a gestation period of up to 20 weeks (on average 17 weeks). At the initial stage, a survey (body weight before pregnancy), and a clinical examination were conducted. Subsequent examinations were carried out in the second (20 weeks) and third (28 weeks) trimesters. Weight gain during pregnancy was calculated as the difference in body weight (between the third and second trimester) divided by the number of gestational weeks in that interval, following the Institute of Medicine guidelines. Gestational weight gain was classified as excessive, taking into account pre-pregnancy body mass index. Predicting the probability of insulin resistance (according to the HOMA-IR) was assessed by the dynamics of body weight gain. Results. Median 25(OH)D in the second and third trimesters of pregnancy was 23 and 24 ng/ml, respectively. Vitamin D insufficiency (25(OH)D < 30 ng/ml) was observed in at least one of the trimesters in 47 (72.3 %) pregnant women, while the permanent nature of vitamin D insufficiency was noted in 36 (55.4 %) cases. Vitamin D deficiency was established in 8 (12.3 %) pregnant women in the second trimester. Excessive weight gain during pregnancy was observed in 34 (52.3 %) women. Insulin resistance was determined in 31 (47.7 %) pregnant women in the third trimester. The median of immunoreactive insulin concentration and HOMA-IR was higher among women with vitamin D deficiency. Conclusion. Vitamin D insufficiency is associated with insulin resistance in the third trimester of pregnancy, which depends on excessive gestational weight gain.
25-гідроксивітамін D; гестаційне збільшення маси тіла; інсулінорезистентність; вагітність
25-hydroxyvitamin D; gestational weight gain; insulin resistance; pregnancy
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Aghajafari F., Nagulesapillai T., Ronksley P.E., Tough S.C., O’Beirne M., Rabi D.M. et al. Association between maternal serum 25-hydroxyvitamin D level and pregnancy and neonatal outcomes: systematic review and meta-analysis of observational studies. BMJ. 2013. 346. f1169. https://doi.org/10.1136/bmj.f1169.
- Agha-Jaffar R., Oliver N., Johnston D., Robinson S. Gestational diabetes mellitus: does an effective prevention strategy exist? Nat. Rev. Endocrinol. 2016. 12. 533e46. https://doi.org/10.1038/nrendo.2016.88.
- Rasouli N., Brodsky I.G., Chatterjee R., Kim S.H., Pratley R.E., Staten M.A., Pittas A.G.; D2d Research Group. Effects of Vitamin D Supplementation on Insulin Sensitivity and Secretion in Prediabetes. J. Clin. Endocrinol. Metab. 2022. 107(1). 230-240. doi: 10.1210/clinem/dgab649. PMID: 34473295; PMCID: PMC8684490.
- Liu Z., Meng T., Liu J., Xu X., Luo S., Jin C. et al. The individual and joint effects of maternal 25(OH)D deficiency and gestational diabetes on infant birth size. Nutr. Metabol. Cardiovasc. Dis. 2020. 30(12). 2398e405. https://doi.org/10.1016/j.numecd.2020.07.046.
- Saraf R., Morton S.M.B., Camargo C.A., Grant C.C. Global summary of maternal and newborn vitamin D status — a systematic review. Matern. Child Nutr. 2016. 12. 647e68. https://doi.org/10.1111/ mcn.12210.
- Pena H.R., de Lima M.C., Brandt K.G., de Antunes M.M., da Silva G.A. Influence of preeclampsia and gestational obesity in maternal and newborn levels of vitamin D. BMC Pregnancy Childbirth. 2015. 15. 112. https://doi.org/10.1186/s12884-015-0547-7.
- Afzal S., Brøndum-Jacobsen P., Bojesen S.E., Nordestgaard B.G. Vitamin D concentration, obesity, and risk of diabetes: a mendelian randomisation study. Lancet Diabetes Endocrinol. 2014. 2. 298e306. https://doi.org/10.1016/S2213-8587(13)70200-6.
- Benhalima K., Van Crombrugge P., Moyson C., Verhaeghe J., Vandeginste S., Verlaenen H. et al. Characteristics and pregnancy outcomes across gestational diabetes mellitus subtypes based on insulin resistance. Diabetologia. 2019. 62. 2118e28. https://doi.org/10.1007/s00125-019-4961-7.
- Rasmussen K.M., Catalano P.M., Yaktine A.L. New guidelines for weight gain during pregnancy: what obstetrician/gynecologists should know. Curr. Opin. Obstet. Gynecol. 2009. 21(6). 521-6. doi: 10.1097/GCO.0b013e328332d24e. PMID: 19809317; PMCID: PMC2847829.
- McDowell M., Cain M.A., Brumley J. Excessive Gestational Weight Gain. J. Midwifery Womens Health. 2019. 64(1). 46-54. doi: 10.1111/jmwh.12927.
- Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., Gordon C.M., Hanley D.A., Heaney R.P. et al. Guidelines for preventing and treating vitamin D deficiency and insufficiency revisited. J. Clin. Endocrinol. Metab. 2012. 97(4). 1153-8. doi: 10.1210/jc.2011-2601.
- Pludowski P., Takacs I., Boyanov M., Belaya Z., Diaconu C.C., Mokhort T., Zherdova N. et al. Clinical Practice in the Prevention, Diagnosis and Treatment of Vitamin D Deficiency: A Central and Eastern Euro–pean Expert Consensus Statement. Nutrients. 2022. 14(7). 1483. doi: 10.3390/nu14071483. PMID: 35406098; PMCID: PMC9002638.
- Simonson G.D., Kendall D.M. Diagnosis of insulin resistance and associated syndromes: the spectrum from the metabolic syndrome to type 2 diabetes mellitus. Coron. Artery Dis. 2005. 16(8). 465-72. doi: 10.1097/00019501-200512000-00002. PMID: 16319655.
- Farcomeni A., Geraci M. Multistate quantile regression models. Stat. Med. 2020. 39(1). 45-56. doi: 10.1002/sim.8393.
- Kaminskyi O.V., Pankiv V.I., Pankiv I.V., Afanasyev D.E. Vitamin D content in population of radiologically contaminated areas in Chernivtsi oblast (pilot project). Probl. Radiac. Med. Radiobiol. 2018. 23. 442-451. doi: 10.33145/2304-8336-2018-23-442-451. PMID: 30582861.
- Al-Khalidi B., Kimball S.M., Rotondi M.A., Ardern C.I. Standardized serum 25-hydroxyvitamin D concentrations are inversely associated with cardiometabolic disease in U.S. adults: a cross-sectional analysis of NHANES, 2001–2010. Nutr. J. 2017. 16. 16. https://doi.org/10.1186/s12937-017-0237-6.
- Lacroix M., Battista M.C., Doyon M., Houde G., Ménard J., Ardilouze J.L. et al. Lower vitamin D levels at first trimester are associated with higher risk of developing gestational diabetes mellitus. Acta Diabetol. 2014. 51. 609e16. https://doi.org/10.1007/s00592-014-0564-4.
- Shao B., Mo M., Xin X., Jiang W., Wu J., Huang M. et al. The interaction between prepregnancy BMI and gestational vitamin D deficiency on the risk of gestational diabetes mellitus subtypes with ele–vated fasting blood glucose. Clin. Nutr. 2020. 39. 2265e73. https://doi.org/10.1016/j.clnu.2019.10.015.
- Benaim C., Cocate P.G., de Barros E.G., Alves-Santos N.H., Figueiredo A.C.C., Franco-Sena A.B. et al. Longitudinal association of 25-hydroxyvitamin D with adipokines and markers of glucose metabolism among Brazilian pregnant women. Br. J. Nutr. 2019. 121. 42e54. https://doi.org/10.1017/S0007114518003057.
- Palacios C., Kostiuk L.K., Peña-Rosas J.P. Vitamin D supplementation for women during pregnancy. Cochrane Database Syst. Rev. 2019. 7. CD008873. https://doi.org/10.1002/14651858.CD008873.pub4.
- Migliaccio S., Di Nisio A., Mele C., Scappaticcio L., Savastano S., Colao A. Obesity programs of nutrition, education, research and assessment (OPERA) group. Obesity and hypovitaminosis D: causality or casualty? Int. J. Obes. Suppl. 2019. 9. 20e31. https://doi.org/10.1038/s41367-019-0010-8.
- Vimaleswaran K.S., Berry D.J., Lu C., Tikkanen E., Pilz S., Hiraki L.T. et al. Causal relationship between obesity and vitamin D status: bi-directional Mendelian randomization analysis of multiple cohorts. PLoS Med. 2013. 10. e1001383. https://doi.org/10. 1371/journal.pmed.1001383.
- Martínez-Hortelano J.A., Cavero-Redondo I., Álvarez-Bueno C., Garrido-Miguel M., Soriano-Cano A., Martínez-Vizcaíno V. Monitoring gestational weight gain and prepregnancy BMI using the 2009 IOM guidelines in the global population: a systematic review and meta-analysis. BMC Pregnancy Childbirth. 2020. 20. 649. https://doi.org/10.1186/s12884-020-03335-7.

/27.jpg)