Червоний дріжджовий, або ферментований, рис (RYR) виготовляється шляхом ферментації пропареного рису (Oryza sativa) їстівним грибом (Monascus purpureus Went, M.pilosus, M.floridanus, M.ruber і нещодавно — Pleurotus ostreatus). Типове червоне забарвлення зумовлене наявністю пігментів, утворених вторинним бродінням [1–5]. Червоний дріжджовий рис містить від 25 до 73 % цукрів (зокрема, крохмалю), від 14 до 31 % білків, від 2 до 7 % води, від 1 до 5 % жирних кислот, стерини, ізофлавони, пігменти, такі як рубропунктамін і монаскорубрамін, і полікетиди. У процесі бродіння дріжджів і рису утворюється комплекс речовин — монаколіни (МК), які мають гіполіпідемічні властивості. Концентрація МК у найбільш часто використовуваних нутрицевтиках RYR зазвичай досягає 1,9 %. На основі використовуваного штаму дріжджів і умов бродіння було ідентифіковано кілька типів МК. Одним із цих підтипів є монаколін К, який структурно ідентичний ловастатину і вживається як альтернатива статинам [5, 6]. У Східній Азії RYR є широко використовуваною харчовою добавкою. Він також використовується для виробництва алкогольних напоїв і ферментованих продуктів у Китаї, Кореї та Японії. У рамках азіатської дієти RYR використовується як харчова добавка для покращання кольору м’яса, риби, якості яєць і продуктів із сої. Його також визнають народним засобом для омолодження організму, сприяння кровообігу й відновлення балансу шлунка [7, 8]. Крім того, RYR також вважається здоровою їжею. Згідно зі статистичними даними, у Китаї існує понад 100 видів здорової їжі, що містить червоний дріжджовий рис [7]. Сучасні фармакологічні дослідження довели, що RYR здійснює захисну дію щодо печінки, підшлункової залози, кровоносних судин та інших органів. Основними інгредієнтами RYR є пігменти і монаколіни [9], а монаколін K, основний компонент монаколінів, використовується як гіполіпідемічний агент [10]. У дослідженні in vivo було показано, що з RYR були виділені некрохмальні полісахариди 3,49 кДа і він здійснює протективний вплив на шлунково-кишковий тракт [4]. Більшість сучасних досліджень RYR зосереджено на малих молекулярних речовинах, таких як статини й пігменти; однак було доведено, що олігосахариди, екстраговані з лікувальної їжі, мають багато корисних ефектів, що дає більше доказів для подальшого вивчення і застосування цих речовин.
Зараз RYR наявний на ринку у двох формах. Звичайний RYR використовується як джерело природних пігментів для фарбування в харчовій і текстильній промисловості. Умови бродіння звичайного RYR відносно швидкі й прості. Якість RYR оцінюють за кольором. Інший тип називається функціональним RYR, який має ліпідознижуючий ефект. Умови бродіння функціонального RYR необхідно оптимізувати науково, у тому числі шляхом скринінгу штамів Monascus і визначення оптимальних умов бродіння (температура, вміст вологи, час тощо). Якість функціонального RYR оцінюють за вмістом монаколіну К, який є одним із вторинних метаболітів Monascus. Завдяки добре відомій гіполіпідемічній ефективності функціонального RYR на ринку є багато запатентованих китайських ліків, що містять функціональний RYR для зниження вмісту ліпідів в крові, таких як Zhibituo, Xuezhikang і Lezhiping [5, 11, 12].
Хімічний склад
До складу RYR входять різні хімічні компоненти, що включають монаколіни, пігменти, органічні кислоти, амінокислоти, стерини, похідні декаліну, флавоноїди, лігнани, кумарин, терпеноїди та інші. Крім того, з RYR були виділені полісахариди, такі як EPS-1, EPS-2, EPS-3, EPS-4, EPS-5, MPS-1, MPS-2, MPS-3 і монаскан. Монаколіни й пігменти є найбільш поширеними й біологічно активними складовими RYR. Серед них монаколіни (наприклад, монаколін К, також відомий як ловастатин) і пігменти (наприклад, монасцин, рубропунктатин і рубропунктамін) були ретельно досліджені та вважаються потенційно корисними [7].
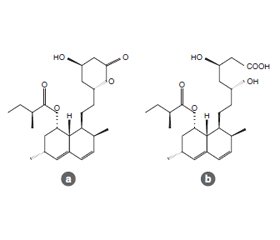
Монаколіни. Монаколіни є одними з основних діючих інгредієнтів RYR. Загалом із RYR було виділено 23 монаколіни: MK1, МК L2, МК Q3, МК R4, МК S5, мегідромонаколін J6, дегідромонаколін K7, дегідромонаколін L8, дегідромонаколін N9, дигідромонаколін K10, дигідромонаколін L11, дигідромонаколін-MV12, дегідромонаколін-MV2, етиловий ефір MK14, метиловий ефір у формі гідроксильної кислоти MK15, метиловий ефір гідроксикислотної форми МК L, α,β-дегідромонаколін S17, α,β-гідромонаколін Q18, 3α-гідрокси-3,5-дигідромонаколін L19, 3β-гідрокси-3,5-дигідромонаколін L20, α,β-дегідродигідромонаколін K21, α,β-дегідродигідромонаколін L22 і (1S,2S,4aR,6S,8-S,8aS,3’S, 5’R,2’’S)-метил 1,2,4a,5,6,7,8,8a-октагідро-3’,5’-дигідрокси-2,6-диметил-8-[(2-метил-1-оксобутил)окси]-1-нафталінгептаноат [7, 13]. Було показано, що монаколіни, особливо монаколіни, отримані з RYR, мають чудові гіполіпідемічні ефекти, а також антиостеопоротичну дію і протидію втомлюваності [7]. Хімічні структури цих монаколінів показано на рис. 1 і 2.
/33.jpg)
Пігменти. Пігменти також є важливими активними сполуками, знайденими в RYR. Двадцять п’ять пігментів було виділено з RYR: рубропунктамін, рубропунктатин, монаскорубрамін, монаскорубрин, монасцин, анкафлавін, ксантомоназини, монанкарин, монасфлуори, монапурони, монаскопіридини, монапурфлюори, 4-[2,4-дигідрокси-6-(3-гідроксибутанетіоілокси)-3-метилфеніл]-3,4-дигідрокси-3,6-диметилгептанова кислота, 9-гексаноїл-3-(2-гідроксипропіл)-6a-метил-9,9a-дигідро-6H-фуро[2,3-h]ізохромен-6,8(6aH)-діон і монапілосусазафілон. Пігменти, отримані з RYR, характеризуються гіполіпідемічним ефектом [14], а також дією проти раку [15], втоми й запальних процесів. Крім того, пігменти RYR використовують для забарвлення йогурту в червоний колір [7].
/33_2.jpg)
Органічні кислоти та амінокислоти. Сім органічних кислот: лінолеву кислоту, α-ліноленову кислоту [16], цитринін, 1-гептадеканкарбонову кислоту, 1-пентадеканкарбонову кислоту, 2-гідроксіоктадеканову кислоту і 5-(2’-гідрокси-6’-метилфеніл)-3-метилфуран-2-карбонову кислоту, а також (+)-монаскумову і (–)-монаскумову кислоту і дві амінокислоти було виділено з RYR. Цитринін, отриманий з RYR, у високих концентраціях може мати летальний вплив на нирки, він також може діяти як тератоген (шкідливий для ембріона або плода) і генотоксин у культивованих лімфоцитах людини [17]. Крім того, було показано, що дві амінокислоти мають сильний інгібуючий вплив на активацію раннього антигену вірусу Епштейна — Барр [7].
Стероли. Дев’ять стеролів: ергостерин, стигмастерол, β-ситостерин, 3β-гідроксистигмаст-5-ен-7-он, 3β-гідроксистигмаста-5,22-дієн-7-он, 6β-гідроксистигмаст-4-ен-3-он, 6β-гідроксистигмаста-4,22-дієн-3-он, даукостерол і β-ситостерилпальмітат були виділені з RYR [18]. Серед них стигмастерол має гіполіпідемічний ефект [7].
Похідні декаліну. Сім похідних, у тому числі монаскузові кислоти A-Е, монаскузинова кислота A і гептакетид, були виділені з RYR [13]. Ці похідні декаліну можуть пригнічувати проліферацію Т-клітин людини залежно від дози в межах від 10 до 100 мкмоль/л [7].
Флавоноїди, лігнани, кумарин і терпеноїди. Два флавоноїди, у тому числі дайдзеїн і геністеїн, два лігнани — 5,5’-диметоксиларицирезинол і ларицирезинол, один кумарин (скополетин) [18], а також п’ять терпеноїдів, а саме 3-епі-бетулінова кислота, ацетат 3-епі-бетулінова кислота, фриделан-3-он, α-кадинол і антикопалол, були виділені з RYR. На даний момент фармакологічна активність цих сполук досліджується.
Полісахариди. Дев’ять полісахаридів були виділені з RYR: EPS-1–5, MPS-1–3 і монаскан. Усі ці полісахариди складаються з манози, глюкози й галактози. EPS-1–5 складаються з манози, глюкози й галактози в молярному співвідношенні 0,364 : 0,415 : 0,221, тоді як MPS-1–3 складаються з манози, глюкози й галактози в молярному співвідношенні 0,500 : 0,318 : 0,192. Монакан, однорідний полісахарид з молекулярною масою ~400 кДа, складається з манози, глюкози й галактози в молярному співвідношенні 1 : 2 : 4. Крім того, є дані, що полісахариди, отримані з RYR, мають протиракову й імуномодулюючу дії [7].
Інші складові. З RYR були виділені ще дев’ять сполук: пероксимонаскуспірон, α-токоспіро A, спатуленол, монаскодилон, монаскустин [19], N-цис-ферулоїлметокситирамін [18], монаспурпурон, п-нітрофенол і 1-дотріаконтанол.
Фізичні та хімічні властивості монаколіну К
Монаколін К є першим ліпідознижуючим компонентом, виділеним з Monascus purpureus. МK має вигляд безбарвних кристалів, він розчинний у метанолі, етанолі, ацетоні, хлороформі й бензолі, але нерозчинний у н-гексані чи петролейному ефірі. Температура кипіння становить 157–159 °C, а значення [α]25D у метанолі становить 307,6 °C. Молекулярна формула — C24H36O5 (Mw 404), а співвідношення C : H : O становить 71,31 : 8,91 : 19,78, отримане за допомогою елементного аналізу і мас-спектроскопії високої роздільної здатності. Значення Rf у тонкошаровій хроматографії становить 0,47 у дихлорметані : ацетоні (4 : 1, об/об). Ультрафіолетовий спектр (метанол) показав максимуми при 229, 237 і 246 нм. Інфрачервоний спектр (KBr) показав смуги поглинання при 3550, 2970, 1696 і 1220 см–1. Спектр 13C-ЯМР (CD3OD) вказав на присутність двох карбонільних атомів ефіру, чотирьох атомів метилу й атомів метилену й метину. Піки мас-спектра (m/e) знаходяться при 404 (M+), 302 (M — 102), 284 (M — 120) і 224 (M — 180), а в мас-спектрі монаколіну K спостерігаються помітні піки на 198 (М — 206), 172 (М — 232), 159 (М — 245) і 157 (М — 247) [11]. Є дві хімічні структури функціонального RYR — кислотна й лактонна форми монаколіну К (рис. 1).
Монаколіни інгібують ГMГ-КoA (3-гідрокси-3-метил-глутарил-коензим А-редуктазу), яка бере участь в утворенні мевалонової кислоти, — реакція, що обмежує швидкість синтезу холестерину (ХС) та інших ізопреноїдів. Цей фермент є мішенню ліків, що знижують рівень холестерину (статинів). ГMГ-КoA-редуктаза заякорена в мембранах ендоплазматичного ретикулуму і має сім (за деякими даними — вісім) трансмембранних доменів. Активний центр розташовується на довгому С-кінцевому домені з боку цитозоля. Механізм зниження рівня ліпідів монаколіном К показано на рис. 2. Крім зниження синтезу холестерину в клітині, він стимулює кількість і активність рецепторів ліпопротеїнів низької щільності (ЛПНЩ) на поверхні клітинної мембрани й виводить холестерин із сироватки крові. RYR також може пригнічувати всмоктування холестерину, а активним інгредієнтом можуть бути стероли [20]. Під час лікування середній рівень загального холестерину (ЗХС) і тригліцеридів (ТГ) у сироватці знижується, а рівень ліпопротеїнів низької щільності («погані» ліпопротеїни) значно знижується, але рівень ліпопротеїну високої щільності (ЛПВЩ, «добрі» ліпопротеїни) не змінюється або навіть зростає. Ефективною є кислотна форма, оскільки її структура подібна до структури ГМГ-КoA (рис. 1) і може безпосередньо інгібувати синтез холестерину. Лактонова форма повинна бути гідролізована в кислотну структуру під дією гідроксилестерази в організмі [11].
Біосинтез і джерела монаколіну К
Шляхи біосинтезу монаколіну К, який генерується Monascus purpureus, досліджені недостатньо. Припускають, що цей шлях може бути подібним до синтезу монаколіну К у Aspergillus terreus, який виглядає наступним чином: 1) ловастатин нонакетидсинтаза (LNKS) каталізує синтез однієї молекули малоніл-КоА в реакції конденсації з дев’ятьма молекулами ацетил-КоА, утворюючи дигідромонаколін L (нонакетидна сполука), який є основною структурою монаколіну K, потім він утворює монаколін L шляхом окиснення, дегідратації та інших етапів, і, нарешті, монаколін J утворюється за допомогою однієї оксигеназної реакції каталітичного гідроксилювання; 2) ловастатин дикетидсинтаза (LDKS) каталізує конденсацію однієї молекули малоніл-КоА з двома молекулами ацетил-КоА з утворенням метилбутирил-КоА; 3) під дією трансестерази метилбутирил-КоА з’єднується з монаколіном J ефірним зв’язком, завершуючи синтез монаколіну К [11].
Комерційний ловастатин (за рішенням FDA (Управління з контролю за продуктами й ліками)) з’явився на фармацевтичному ринку як гіполіпідемічний препарат у 1986 році. Ловастатин одержують за допомогою двох способів синтезу. Перший полягає в тому, що використовується глибинне бродіння Monascus purpureus і Aspergillus terreus, додавання джерел вуглецю й азоту (таких як глюкоза, вівсяне борошно) до середовища після відповідної ферментації, а потім отримання ловастатину шляхом сепарації та очищення. Другий — це хімічний синтез, який замінює декалінове кільце грибних сполук на ароматичне кільце. Ранні дослідження показали, що структура монаколіну К хімічно ідентична структурі комерційного ловастатину [21].
У звичайному RYR внаслідок короткого й простого процесу бродіння монаколіну K виробляється дуже мало. Нещодавно було повідомлення, що комерційний ловастатин додається до звичайного RYR для імітації функціонального RYR з метою отримання більшого прибутку [17, 22]. Це явище гальмує застосування функціонального RYR, і, що більш важливо, тривале вживання ловастатину може спричинити виснаження, шлунково-кишкові реакції, міалгію тощо. Близько 10–15 % пацієнтів із дисліпідемією, які приймають статини, мають проблеми зі скелетними м’язами [11, 23].
Фармакологічна активність
RYR був предметом кількох фармакологічних досліджень через різноманітність його етномедичного використання. Дослідження показали, що RYR демонструє широкий спектр біологічних властивостей, зокрема гіполіпідемічні, антиатеросклеротичні, протиракові, нейроцитопротекторні, гепатопротекторні, антиостеопоротичні, імуномодулюючі, протизапальні, антигіпертензивні, антидіабетичні та антиадипогенні ефекти. Серед них гіполіпідемічна й антиатеросклеротична активність є найбільш вираженою з урахуванням того, що RYR, як вважають, впливає на турбідність, активує кровообіг та усуває застійні процеси у крові [7].
Гіполіпідемічний ефект
Гіперліпідемія є наслідком сучасних моделей харчування і досить млявого способу життя. У результаті пошук добавок, які можуть знизити рівень тригліцеридів і холестерину, значно активізувався. Статини використовуються для усунення закупорки судин, але у зв’язку зі збільшенням кількості повідомлень про їхні побічні ефекти проводиться пошук альтернативних засобів [17]. Гіполіпідемічний потенціал RYR був послідовно доведений надійними експериментальними результатами. Екстракт червоного дріжджового рису (RYR) є найефективнішим нутрицевтиком на ринку для зниження рівня холестерину. Його ефективність безпосередньо залежить від кількості монаколіну К в екстракті та дози (до 10 мг/день) [2, 24].
Для перевірки ефективності RYR було проведено кілька клінічних випробувань. Так, у 2015 році метааналіз 20 рандомізованих досліджень, що включали 6663 пацієнтів, продемонстрував зниження холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) при порівнянні групи RYR з групами плацебо [25].
У пацієнтів з дисліпідемією RYR, який застосовували як дієтичну добавку (4–48 мг/кг), значно знижував рівень TГ, загального холестерину і ХС ЛПНЩ, а також підвищував рівень холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) [2, 24, 26]. Щоденне споживання монаколіну К знижує рівень ХС ЛПНЩ у плазмі на 15–25 % протягом 6–8 тижнів. Звичайно, зниження ХС ЛПНЩ супроводжується зниженням ЗХC, аполіпопротеїну В плазми, матриксних металопротеїназ 2 і 9 і високочутливого С-реактивного білка. Крім того, гіполіпідемічний ефект RYR пов’язаний зі значним покращанням швидкості пульсової хвилі та ендотеліальної функції, які є перевіреними й надійними біомаркерами старіння судин [2]. Однак для вивчення впливу RYR на фактори ризику й лікування різних хронічних захворювань необхідні подальші дослідження з більш тривалим періодом спостереження за пацієнтами. У тварин, яких годували дієтою з високим вмістом жирів, введення RYR у вигляді капсул або водних екстрактів RYR значно знижувало рівні ТГ, холестерину та ЛПНЩ. Ця гіполіпідемічна активність RYR була принаймні частково опосередкована посиленою екскрецією кислих стеролів і зниженою експресією факторів транскрипції, пов’язаних із запаленням, таких як фактор некрозу пухлини альфа (TNF-α) та інтерлейкін-6 (IL-6) [27]. Однак механізми дії ще належить визначити. Гіполіпідемічні ефекти RYR пояснюються високим вмістом МК і пігментів [14]. У перехресному подвійному сліпому плацебо-контрольованому рандомізованому клінічному дослідженні короткочасне лікування (4 тижні) монаколінами (10 мг) суттєво знижувало рівні ЗХС, ХС ЛПНЩ, але не ХС ЛПВЩ [2].
В іншому дослідженні, у якому використовувалася модель щурів на високожировій дієті, введення МК (5–30 мг/кг) знижувало рівні ЗХC, TГ і ЛПНЩ у сироватці крові шляхом посилення експресії в печінці ліпопротеїнліпази та мРНК рецепторів ЛПНЩ. Пероральний прийом жовтого, червоного і помаранчевого пігментів RYR також помітно пом’якшував порушення ліпідного обміну, покращував стан ліпідів у сироватці крові; пригнічував накопичення ліпідів у печінці та стеатоз і сприяв екскреції фекального холестерину, TГ і жовчних кислот. Механізми дії включають підвищення рівня мРНК фарнезоїдного X-рецептора і PPARγ (peroxisome-proliferator-activated receptor-gamma), основних рецепторів, що беруть участь у метаболізмі холестерину й гомеостазі жовчних кислот [7, 14].
Незважаючи на те, що МК має механізм дії, подібний до статинів, щоденне споживання від 3 до 10 мг монаколіну К пов’язане з мінімальними ризиками, а легкі міалгії спостерігаються лише в пацієнтів, які також не можуть переносити мінімальні дози статину. Монаколін K, що міститься в RYR, є безпечною та ефективною добавкою для лікування легкої і помірної гіперхолестеринемії в людей без додаткових факторів ризику серцево-судинних захворювань (ССЗ) [2].
Вплив препаратів RYR на метаболічний синдром (МС)
Спеціальна серія комплексних досліджень була присвячена впливу препаратів RYR на МС, який включає атерогенну дисліпідемію, гіпертензію, ожиріння й інсулінорезистентність [9] і пов’язаний із підвищеним ризиком цукрового діабету 2-го типу, неалкогольної жирової хвороби печінки (NAFLD), інфаркту міокарда й інсульту [28]. МС стає все більш поширеним із покращанням життя людей, що пов’язано з підвищеним ризиком ССЗ і смертності [29]. На сьогодні МС є актуальною глобальною проблемою охорони здоров’я, яка ще далека від вирішення, і поки що не існує єдиного препарату, який би одночасно лікував декілька захворювань або регулював складні механізми МС [9]. Тому важливо визначити терапію, яка перешкоджає розвитку метаболічних захворювань з профілактичної точки зору [5].
Кілька метааналізів показали, що RYR є ефективним і досить безпечним препаратом для терапії дисліпідемії [30, 31]. Зростає кількість доказів, які свідчать про антидисліпідемічний, протидіабетичний, антиатеросклеротичний, антиадипогенний і антигіпертензивний ефект RYR [7]. У результаті зростає інтерес до гіпотези, що RYR позитивно впливає на здоров’я при МС і його несприятливих клінічних проявах.
Вплив препаратів RYR на смертність і MACE. Дві роботи, що включали 3297 учасників, свідчать про позитивний вплив RYR щодо смертності, а три дослідження з 3360 учасників повідомили про його терапевтичний вплив на MACE (major adverse cardiovascular events — серйозні побічні серцево-судинні події). Препарати RYR вірогідно знижували смертність порівняно з контрольною групою [5].
Вплив препаратів RYR на фактори ризику МС (FPG, HbA1c, HOMA-IR та ISI). У десяти дослідженнях (646 учасників) повідомляли про терапевтичні ефекти RYR на FPG (fasting plasma glucose — глюкоза плазми натще). Препарати RYR значно знижували рівень FPG порівняно з контрольною групою. Серед досліджень була висока гетерогенність, тому проводився аналіз підгруп. Препарати RYR суттєво знижували рівень FPG у пацієнтів віком від 40 до 50 років з більш помітними ефектами й низькою гетерогенністю, тоді як інші підгрупи мали вищу гетерогенність. П’ять досліджень, що включали 392 учасників, показали терапевтичний вплив RYR на рівень глікованого гемоглобіну (HbA1c) — зниження рівня HbA1c порівняно з контрольною групою. Два дослідження за участю 102 учасників свідчать про терапевтичні ефекти щодо HOMA-IR (homeostasis model of assessment insulin resistance — гомеостазна модель оцінки інсулінорезистентності), а в інших двох дослідженнях за участю 114 учасників продемонстрували терапевтичні ефекти щодо ISI (insulin sensitivity index — індекс чутливості до інсуліну). Препарати RYR знижували HOMA-IR, але не збільшували ISI порівняно з контрольною групою [5].
Параметри ліпідного профілю (ЗХC, TГ, ХС ЛПНЩ і ХС ЛПВЩ). Двадцять три дослідження, що включали 5084 учасників, свідчать про терапевтичні ефекти RYR щодо ЗХC, 26 досліджень, що включали 5234 учасників, — щодо TГ, 16 досліджень, що включали 4391 учасника, — щодо ЛПНЩ, і 19 випробувань, що включають 4653 учасників, — щодо ЛПВЩ. Препарати RYR знижували рівні ЗХC, TГ і ХС ЛПНЩ і підвищували рівень ХС ЛПВЩ порівняно з контрольною групою. Серед досліджень ЗХC, TГ, ХС ЛПНЩ і ХС ЛПВЩ була відмічена гетерогенність, тому було проведено аналіз підгруп. Препарати RYR вірогідно знижували рівні ЗХС у пацієнтів 40–50-річного віку з більш помітними ефектами й низькою гетерогенністю, тоді як інші підгрупи мали високу гетерогенність. Метарегресійний аналіз показав, що вік був значним модератором ЗХC. Також суттєво знижувався рівень тригліцеридів з більшою часткою жінок (чоловіки : жінки = 1 : 1,5). Крім того, препарати RYR суттєво знижували рівні ЗХC, TГ, ЛПНЩ і підвищували рівень ЛПВЩ при тривалості лікування понад 12 місяців з помірними ефектами й низькою гетерогенністю [5].
Параметри артеріального тиску. Два випробування, що включали невелику за розміром вибірку (208 учасників), свідчать про терапевтичні ефекти RYR на MAP (mean arterial pressure — середній артеріальний тиск). Препарати RYR знижували рівень MAP порівняно з контрольною групою. У чотирьох дослідженнях, що включали 2952 учасників, повідомляли про його терапевтичний вплив на SBP (systolic blood pressure — систолічний артеріальний тиск) і DBP (diastolic blood pressure — діастолічний артеріальний тиск). Препарати RYR суттєво знижували рівень SBP і рівень DBP у пацієнтів віком від 60 до 70 років. Також RYR знижував рівень SBP і DBP протягом лікування до 3 місяців. Відмічається, що порівняно з іншими гіполіпідемічними препаратами RYR більш помітно знижував рівень SBP і DBP [32, 33].
Клінічні переваги та механізм покращання біохімічних показників при МС. Параметри рівня глюкози в крові пов’язані з діабетом. Нещодавні загальнонаціональні епідеміологічні дані показали, що підвищений рівень глюкози в крові підвищує ризик ССЗ [34]; кожне підвищення HbA1c на 1 %, незалежно від статусу діабету, пов’язане із збільшенням ризику інфаркту міокарда на 18 % [35]; HOMA-IR позитивно корелює з ризиком ССЗ [36]. У цих метааналізах виявлено, що препарати RYR значно знижують рівні FPG, HbA1c і HOMA-IR, що вказує на перспективу їх застосування для лікування діабету і ССЗ. Попередні дослідження показали, що RYR може стимулювати мускаринові рецептори М3 у клітинах підшлункової залози й посилювати вивільнення інсуліну, знижуючи рівень глюкози в плазмі, а також пригнічують сенесценцію проангіогенних клітин і окиснювальний стрес, спричинені високим вмістом глюкози, тим самим зменшуючи судинні ускладнення діабету [37]. Це може частково пояснюватися покращанням показників глюкози в крові після лікування препаратами RYR.
Профілі ліпідів крові відіграють вирішальну роль у атеросклеротичних ССЗ. Перехресне дослідження діабету 2-го типу виявило, що нижчий рівень ТГ пов’язаний зі зниженням ризику ССЗ у короткостроковій перспективі [38]. Смертність і захворюваність від ССЗ знижувались завдяки первинній і вторинній профілактиці через ліпідознижувальну терапію, яка впливає на ХС ЛПНЩ. Антидіабетичні функції ЛПВЩ реалізуються шляхом підвищення чутливості до інсуліну і функції β-клітин [39]. Згідно з результатами досліджень, зниження ЗХC, TГ, ХС ЛПНЩ і підвищення ХС ЛПВЩ, імовірно, є клінічно значущими для покращання метаболізму глюкози та ліпідів, а потім і для зниження ризику ішемічної хвороби серця (ІХС).
Високий кров’яний тиск може призвести до серцевої недостатності, інфаркту, інсульту й захворювання нирок [40], а MAP є предиктором смертності від усіх причин і ССЗ серед людей середнього й літнього віку [41]. Препарати RYR вірогідно знижували рівень MAP до 3,79 мм рт.ст., а також знижували рівень SBP і DBP у пацієнтів віком 60–70 років і при тривалості лікування до 3 місяців. Крім того, попередні дослідження показали, що RYR може зменшити жорсткість артерій, ендотеліальну дисфункцію і запалення шляхом сприяння і стабілізації експресії ендотеліальної синтази оксиду азоту (eNOS) [1, 9]. Механізм дії RYR щодо зниження артеріального тиску може бути зумовлений покращанням ендотеліальної дисфункції і зниженням запалення.
До цього часу нутрицевтики використовувалися для профілактики ССЗ. Як зазначено в документах, підготовлених Міжнародною групою експертів з ліпідів (ILEP), головним чином дослідники зосереджувались на зниженні рівня ліпідів. Як гіполіпідемічні нутрицевтики, препарати RYR відіграють важливу роль у зниженні ризику ССЗ, пов’язаних із запаленням [42]. Нещодавні дослідження показали, що RYR можуть використовувати пацієнти із серцево-судинним ризиком, які не досягли цільового рівня холестерину ЛПНЩ, але ще не приймають або не переносять статини [43]. Було доведено, що RYR знижує в крові рівні цукру, холестерину, контролює високий кров’яний тиск і пригнічує запалення [17]. Отже, ці результати вказують на те, що RYR може застосовуватись для лікування МС і покращувати прогноз ССЗ. Останні дані виявили низьку поширеність передбачуваних побічних ефектів, пов’язаних із RYR [44], підтвердили його безпеку для пацієнтів з гіперхолестеринемією, навіть у пацієнтів з непереносимістю статинів [1, 45].
Попередні дослідження показали, що гіполіпідемічний ефект RYR не залежав від віку чи статі пацієнтів. Проте аналіз підгруп показав, що препарати RYR суттєво знижували рівні FPG, ЗХC і TГ у пацієнтів віком 40–50 років, SBP і DBP у пацієнтів віком 60–70 років і TГ у жінок із більш помітним ефектом. Це свідчить, що препарати RYR можуть мати терапевтичні переваги в цих популяціях. Різні результати щодо віку й статі можуть бути пов’язані з базальним метаболізмом, судинною дисфункцією і статевими відмінностями в метаболізмі TГ. Попередні роботи показали, що базальний метаболізм був значно вищим у середньому віці (40–50 років) порівняно з групою 60–70 років. Артеріальний тиск має зростаючий позитивний зв’язок із судинною дисфункцією і жорсткістю судин із віком, жінки мають кращий кліренс TГ, а естроген знижує рівень TГ безпосередньо в печінці [5, 46]. Отже, препарати RYR можуть мати кращий вплив на рівень глюкози в крові та ліпідів крові в людей середнього віку шляхом регуляції базального метаболізму, краще впливати на SBP і DBP у людей похилого віку шляхом послаблення судинної дисфункції і жорсткості артерій, а також краще впливати на TГ у жінок завдяки кращому кліренсу [5].
Дані дослідження показали, що короткотривале лікування препаратами RYR може бути корисним для зниження артеріального тиску. Інші дані свідчать, що нутрицевтики (берберин, RYR, полікозанол) значно знижували рівні ЗХC, ЛПНЩ і HOMA-IR після 12-місячного лікування. У підгруповому аналізі цього дослідження препарати RYR давали невелике, але значне покращання ЗХC, TГ, ЛПНЩ і ЛПВЩ при тривалості втручання > 12 місяців із низькою гетерогенністю, що надало більше доказів на користь довготривалого використання RYR для зниження ліпідів крові [5].
Показано, що RYR плюс традиційна терапія ефективніше знижували рівні ЗХC, ЛПНЩ і SBP порівняно зі звичайною терапією, а рівні ЗХC і ЛПНЩ — порівняно з плацебо плюс традиційна терапія, тоді як RYR разом зі статинами знижували рівні ЗХC, TГ, ЛПНЩ, SBP і DBP порівняно зі статинами [30]. Крім того, препарати RYR плюс традиційна терапія не тільки знижували рівні FPG, HbA1c, ЗХC, TГ і ЛПНЩ, але й підвищували рівень ЛПВЩ порівняно зі звичайною терапією.
Отже, у результаті аналізу були зроблені надійні й послідовні висновки про те, що препарати RYR впливають на фактори ризику МС. Докази свідчать, що препарати RYR суттєво знижують частоту смерті та MACE при МС і покращують рівень глюкози в крові, ліпідний профіль і артеріальний тиск. У довгостроковій перспективі препарати RYR можуть покращити клінічні кінцеві показники, запобігти метаболічним захворюванням і знизити ризик ІХС. Однак через неоднорідність досліджень одержані результати слід оцінювати з обережністю, а для надання більш переконливих доказів RYR потрібні додаткові високоякісні клінічні дослідження при лікуванні МС. Ці результати свідчать про те, що препарати RYR слід брати до уваги для профілактики й лікування МС через їх сприятливий вплив на численні фактори ризику гіперглікемії, дисліпідемії і гіпертензії і їх прийнятний профіль безпеки.
Отже, препарати RYR можуть бути ефективним засобом лікування — зменшують фактори ризику МС і запобігають прогресуванню ССЗ [5].
Ожиріння
Ожиріння визначається як надлишок білої жирової тканини, що пов’язаний з вищим ризиком розвитку діабету і серцево-судинних захворювань. Було показано, що RYR впливає на ожиріння. У мишей на дієті з високим вмістом жиру введення RYR (у дозі 4–20 г/кг) значно знижувало вагу й масу жирової тканини, що супроводжувалося зменшенням кількості жирових клітин. Ефекти RYR щодо ожиріння в основному є похідними від ліполітичної активності й помірного зниження апетиту. На клітинах 3T3-L1 було продемонстровано, що екстракти RYR пригнічують проліферацію і диференціювання преадипоцитів, а це, можливо, пригнічує утворення нових адипоцитів або гіперплазію в жировій тканині. Недоліком цього дослідження була висока доза RYR, яка обмежувала клінічне застосування RYR для лікування ожиріння [7].
Вивчення впливу RYR і пігментів на ліпіди крові, кишкову флору й транскриптом печінки на моделі гіперліпідемії щурів показало, що порівняно з контрольною групою швидкість зростання ваги, співвідношення маси печінки, співвідношення маси нирок, співвідношення маси селезінки й співвідношення маси жиру щурів у групі RYR були значно знижені. Лікування RYR суттєво знижує сироваткові рівні ЗХС, TГ і ХС ЛПНЩ, що впливає на зниження рівня ліпідів крові.
Отже, комбінований аналіз транскриптому й метаболому показав, що RYR і деякі пігменти можуть покращувати метаболізм ліпідів у щурів, регулюючи біосинтез стероїдних гормонів, метаболізм гліцероліпідів і шлях метаболізму арахідонової кислоти. Крім того, RYR з пігментами також характеризуються унікальним способом регулювання ліпідів крові [47].
Протидіабетична активність
Діабет набуває масштабів епідемії в усьому світі. Перспективним підходом до контролю гіперглікемії та пом’якшення діабету є не залежність від ліків, а дієта [17]. У зв’язку з цим досліджували ефект RYR, введення якого (50–350 мг/кг) щурам із стрептозотоцин-індукованим діабетом протягом 2 тижнів помітно й дозозалежно знижувало рівень глюкози в плазмі, усувало гіперфагію і знижувало рівень мРНК фосфоенолпіруваткарбоксикінази в печінці. Це свідчить про те, що RYR знижує у щурів з діабетом глюконеогенез у печінці та рівень глюкози в плазмі. Показано, що RYR сприяє вивільненню ацетилхоліну з нервових закінчень, що, у свою чергу, стимулює мускаринові рецептори М3 у клітинах підшлункової залози й посилює вивільнення інсуліну, знижуючи рівень глюкози в плазмі [48]. Введення RYR (300 мг/кг) діабетичним мишам протягом 8 тижнів значно знижувало рівень глюкози в крові шляхом покращання толерантності до глюкози і секреції інсуліну, захищало острівці від гіперглікемічного пошкодження й пригнічувало експресію ключових факторів окиснювального стресу, включно з 8-OHdG (8-Hydroxyguanosine), 4-HNE (4-hydroxy-2-nonenal) і gp91phox (NADPH oxidase 2). Це вказує на те, що вплив RYR на окиснювальний стрес може принаймні частково пояснити покращену секрецію інсуліну панкреатичними острівцями при діабеті [49].
Також когорту, яка включала 34 504 особи віком 20 років і старше, які приймали RYR, порівнювали з когортою 34 504 дорослих пацієнтів, відібраних за відповідними віком і статтю, які приймали ловастатин. Обидві когорти не мали діабету до прийому ліків. Частота діабету для когорти RYR і когорти ловастатину становила 1,01 і 2,59 на 100 людино-років відповідно. Отже, є ймовірність того, що люди, які застосовували RYR, можуть мати менший ризик розвитку діабету порівняно з когортою ловастатину. Хоча терапія статинами вважається відносно безпечним і добре переносимим методом ефективного покращання рівня ліпідів у крові та зменшення серцево-судинних подій, три метааналізи рандомізованих і когортних досліджень показали, що терапія статинами дещо підвищує ризик уперше виниклого діабету [48]. Однак детальних клінічних випробувань із застосуванням RYR не проводилося, і ще не відомо, які хімічні складові RYR відповідальні за протидіабетичну дію.
Комбінація нутрицевтиків, що містила 10 мг/г монаколіну К, 165 мкг/г хрому і 300 мг/г гіркого гарбуза, використовувалась для 8-тижневого дієтичного лікування діабетичних синдромів (включно з гіперглікемією, гіперфагією, поліурією, глюкозурією, альбумінурією і непереносимістю глюкози). Такі показники, як зниження інсуліну й підвищення глюкагону в сироватці крові та панкреатичних острівцях, покращувались нутрицевтиками залежно від дози. Крім того, добавки зменшували дедиференціацію β-клітин, про що свідчить зниження маркера дедиференціації (Aldh1a3 — Aldehyde Dehydrogenase 1 Family Member A3) і збільшення експресії генів і факторів транскрипції, характерних для β-клітин (Ins1, Ins2, FOXO1 (Forkhead Box Protein O1) і NKX6.1 (NK6 Homeobox 1)), а також ядерної локалізації NKX6.1 у панкреатичних острівцях порівняно з контрольною групою. Дослідники дійшли висновку, що поєднання Monascus purpureus, Momordica charantia і хрому можна використовувати як допоміжний засіб для лікування діабету 2-го типу й затримки прогресування захворювання шляхом підтримки функції β-клітин [50].
Механізми зниження ризику виникнення цукрового діабету в пацієнтів, які застосовували RYR, досі невідомі. Можливо, що люди з гіперліпідемією, які обирають рецепти RYR, можуть мати кращі знання, ставлення й практику щодо профілактики захворювань і зміцнення здоров’я. Ці фактори можуть сприяти зниженню захворюваності на діабет. Крім того, RYR був ефективним проти пов’язаного з ожирінням запалення, резистентності до інсуліну та NAFLD у мишей незалежно від рівня монаколіну К [51].
Антиатеросклеротична активність
Інгібування синтезу холестерину є ефективним для первинної та вторинної профілактики атеросклеротичних захворювань. Експериментальні дослідження на тваринах і клітинних моделях показали, що екстракти RYR (Xuezhikang — XZK) мають антиатеросклеротичну дію. Встановлено, що восьмитижневе введення XZK (600–1200 мг/кг) мишам C57BL/6 значно і дозозалежно пригнічує прогресування вразливих бляшок, зменшує площу бляшок і пригнічує пошкодження ендоплазматичного ретикулуму [52]. В іншому дослідженні за участю атеросклеротичних щурів на дієті з високим вмістом холестерину пероральне введення RYR у дозі 120 мг/кг значно зменшувало розмір бляшки, стабілізувало бляшку, захищало ендотелій і зменшувало кількість ліпідних крапель і конкрементів холестерину, а також знижувало рівні С-реактивного білка високої чутливості (Hs-CRP), IL-6 і TNF-α, що свідчить про те, що антиатеросклеротична активність RYR може бути пов’язана із запальними сигнальними шляхами [53]. Введення водних і етанольних екстрактів RYR до інкубованих з гомоцистеїном клітин гладких м’язів аорти людини (HASMC) (1–160 мкг/мл) протягом 24 годин знижувало експресію TNF-α-індукованих металопротеїназ (MMP-2 і MMP-9). Це також знижувало активацію ядерного фактора κB (NF-κB) і утворення внутрішньоклітинних активних форм кисню (АФК), підтверджуючи думку про те, що RYR може мати потенційне застосування в лікуванні атеросклерозу. Враховуючи значне зниження життєздатності HASMC, інкубованих з високими концентраціями RYR (160 мкг/мл), слід звернути увагу на можливі побічні ефекти при клінічному застосуванні [7].
Останніми роками висловлюється припущення, що антисклеротична дія статинів пов’язана не тільки з їх гіполіпідемічним ефектом, але і з безпосереднім впливом на судини. Останнє сприяє покращанню функції ендотелію, пригніченню запального процесу, зменшенню атеросклеротичних бляшок, зниженню тромбоутворення. У цих змінах, за експериментальними даними, беруть участь більшість процесів: пригнічення міграції і проліферації міоцитів артерій, ріст моноцитів/макрофагів і зменшення накопичення в них холестерину, підвищення утворення в ендотелії NO-синтетази, пригнічення продукції ендотеліну-1 [7].
Інфаркт міокарда
Серцево-судинні захворювання, включно з цереброваскулярними захворюваннями, ішемічною хворобою серця і захворюваннями периферичних артерій, є основним тягарем захворювань у світі. Попередні дослідження показали, що деякі харчові фактори, такі як споживання великої кількості натрію та дієта з високим вмістом жиру, пов’язані з вищим ризиком ССЗ. Дані досліджень свідчать про те, що нижчий рівень холестерину в крові знижує ризик серйозних судинних подій, а нижчі рівні ХС ЛПНЩ асоціюються зі зниженням частоти великих коронарних подій [54]. Пацієнтам з граничною гіперхолестеринемією для зниження ризику атеросклеротичного серцево-судинного захворювання (ASCVD) рекомендується здоровий спосіб життя, здорове харчування, фізична активність і контроль ваги. Для пацієнтів з клінічною картиною ASCVD статини є терапією першої лінії для зниження холестерину ЛПНЩ. У пацієнтів із високим ризиком ASCVD або тяжкою первинною гіперхолестеринемією можна розглянути комбінацію статинів з езетимібом і/або інгібітором PCSK9 (рroprotein convertase subtilisin/kexin type 9) [31, 55].
Екстракт червоного дріжджового рису широко використовується для покращання ліпідного профілю й роботи серцево-судинної системи. Однак ефективність RYR щодо серцево-судинних наслідків у пацієнтів з інфарктом міокарда (ІМ) залишається недостатньо з’ясованою. Метааналіз, який оцінював ефективність екстракту RYR у пацієнтів з ІМ із граничною гіперхолестеринемією, включав сім досліджень, що включали 10 699 пацієнтів з ІМ та діагнозом граничної гіперхолестеринемії. Екстракт RYR (1200 мг/день) зменшував реваскуляризацію, ризик нефатального ІМ і раптової смерті. Екстракт RYR також знижував рівень ЛПНЩ, ЗХC, TГ і підвищував рівень ЛПВЩ. Цей метааналіз показав, що екстракт RYR у пацієнтів з ІМ із граничною гіперхолестеринемією пов’язаний із покращанням серцево-судинних результатів і ліпідного профілю [31]. Найбільше рандомізоване контрольоване дослідження з вивчення RYR у вторинній серцево-судинній профілактиці охоплювало 4870 пацієнтів, воно показало, що RYR знижує частоту нефатального інфаркту міокарда, смертність від коронарних захворювань, коронарну реваскуляцію і загальну смертність у пацієнтів з ІМ в анамнезі та помірною гіперхолестеринемією. Крім того, низка клінічних випробувань показала, що RYR є ефективним у зниженні холестерину в тих, хто не переносить статини через міалгію, пов’язану з їх прийомом, шлунково-кишкові побічні ефекти або підвищений рівень трансаміназ [25].
На підставі наявних даних прогнозується, що терапія екстрактом RYR є ефективним і безпечним методом лікування пацієнтів з ІМ. Однак поки що недостатньо даних, щоб підтвердити гіпотезу про те, що RYP знижує частоту фатального ІМ.
Зниження ризику виникнення інсульту
Інсульт залишається однією з провідних причин смерті та інвалідності. За оцінками, майже 13,7 мільйона людей пережили нові інсульти і ще 5,5 мільйона людей померли від інсульту в 2016 році в усьому світі [56, 57]. 10 % усіх смертей у світі припадає на інсульт [56]. Епідеміологія, профілактика й лікування інсульту встановлені, і відомо, що гіперхолестеринемія є основним фактором ризику інсульту. Хоча було доведено, що статини ефективно контролюють рівень ЗХС і широко використовуються в усьому світі, увагу дослідників привернув ризик виникнення діабету після лікування статинами [58]. RYR часто використовується серед пацієнтів з гіперхолестеринемією в Китаї, і його терапевтичні ефекти були досліджені раніше [43]. Доведено, що науково обґрунтовані препарати RYR (Xuezhikang®, HypoCol® і LipoCol Forte®), які містять монаколін K, ефективно знижують рівень ЗХC і ХС ЛПНЩ. Крім того, дослідження показали, що пацієнти, які застосовували RYR, мали менший ризик діабету, ніж ті, що застосовували статини [48]. Проте необхідні додаткові оцінки потенційних побічних ефектів RYR, хоча переносимість і безпека використання RYR були розглянуті й вивчені раніше [45].
Вплив RYR на ризик виникнення інсульту залишається недостатньо вивченим. Порівнювали ризик інсульту між людьми, які отримували або не використовували RYR. Визначили 34 723 дорослих (віком ≥ 20 років), які вперше отримували RYR з 2010 по 2014 рік. Щоб вибрати відповідну контрольну групу, використали частотну відповідність за віком і статтю і визначили не-RYR когорту, яка включала 34 723 дорослих, які вперше отримували ловастатин. Порівняно з когортою пацієнтів, які не отримували RYR, у пацієнтів, які приймали RYR, був знижений ризик інсульту, включно з геморагічним інсультом, ішемічним інсультом та іншими типами інсультів. Зв’язок між призначенням RYR і ризиком інсульту був вірогідним у обох статей, у людей старше 40 років, а також в осіб з різними захворюваннями. Призначення RYR було пов’язане з дозозалежним зниженням ризику інсульту. Це дослідження показало потенційно позитивний вплив RYR на ризик інсульту [58]. Також оцінювали сім клінічних випробувань, які показали, що використання RYR було пов’язане з покращанням стану серцево-судинної системи й ліпідного профілю у пацієнтів з інфарктом міокарда з граничною гіперхолестеринемією. Проте доступна інформація щодо порівняння ризику інсульту між людьми, які використовували і не використовували RYR, є обмеженою. Тому було проведене ретроспективне когортне дослідження з реальною базою даних для оцінки впливу RYR на ризик інсульту. Виявили зниження ризику інсульту в людей, які застосовували рецепти RYR, причому значні результати спостерігалися незалежно від віку, статі чи стану здоров’я [31]. Існує кілька причин для зниження ризику інсульту в пацієнтів, які застосовували RYR у цьому дослідженні. По-перше, метааналіз рандомізованих досліджень статинів (включно із шістьма дослідженнями із залученням ловастатину) продемонстрував значне зниження рівня холестерину й чіткі докази переваг їх використання щодо інсульту. Оскільки фітопрепарат RYR містить моноколін К (ловастатин), то механізм зниження рівня загального холестерину в пацієнтів, які застосовували RYR, очевидний [43]. Безперечно, зниження високого рівня загального холестерину до норми є одним із ключових моментів зниження атеросклерозу сонних артерій і подальшого ризику інсульту.
По-третє, дослідження на тваринах показало, що RYR був ефективним у боротьбі із запаленням, пов’язаним із ожирінням, резистентністю до інсуліну і неалкогольною жировою хворобою печінки в мишей незалежно від рівня моноколіну К. Також були надані деякі докази на підтримку гіпотези про зниження ризику розвитку діабету в людей, які застосовували RYR [48]. Вважається, що це є корисним для профілактики інсульту. Однак останні результати не можна повністю пояснити описаними раніше причинами. На додаток до моноколіну K рецепти RYR містять гамма-аміномасляну кислоту і різні моноколіни, фітостероли й ізофлавони [59], і дуже мало відомо про вплив цих компонентів на атеросклероз або інсульт. Майбутні дослідження мають оцінити вплив інших компонентів RYR на запалення, гіперліпідемію, атеросклероз та інсульт.
Незважаючи на сприятливий вплив RYR на рівень холестерину, а також той факт, що деякі дослідження показали, що RYR є відносно безпечним [45], слід враховувати потенційні побічні ефекти RYR, такі як м’язові симптоми, захворювання центральної нервової системи й діабет, причому ці ефекти частково подібні до ефектів статинів. Деякі дослідження показали, що дієтичні добавки, які містять червоний дріжджовий рис, можуть бути пов’язані з гепатотоксичністю [6], симптоматичною міопатією [6] та еректильною дисфункцією [60]. Проте використання RYR з належною виробничою практикою було відносно стабільним і безпечним, наприклад Xuezhikang®, HypoCol® і LipoCol Forte® [58].
Нейропротекторна активність
Було також показано, що екстракти RYR мають нейроцитопротекторну дію. У щурів, які отримували амілоїд β (Aβ), білок, пов’язаний з хворобою Альцгеймера, пероральне введення RYR (151–755 мг/кг) протягом 4 тижнів помітно змінювало дефіцит пам’яті, а також запобігало інфузії Aβ40 і пошкодженням в гіпокампі й корі головного мозку, які беруть участь у збільшенні реактивних речовин тіобарбітурової кислоти та АФК. Використання клітин нейробластоми IMR32 людини, експонованих високій концентрації холестерину, показало, що RYR знижує утворення й депонування Aβ40 шляхом пригнічення індукованої холестерином активності β-секретази та експресії аполіпопротеїну Е. RYR також опосередковує протеоліз білка-попередника амілоїду (АРР — amyloid precursor protein) до розчинного α-фрагмента АРР з нейропротекторною активністю в гіпокампі [7]. Однак необхідні подальші дослідження для підтвердження нейрозахисного ефекту з використанням низьких доз RYR, придатних для введення людині. Похідні ловастатину RYR також демонструють нейропротекторний ефект. Застосування сполуки, позначеної як 3f, протягом 24 годин значно зменшувало індукований 6-гідроксидопаміном (6-OHDA) апоптоз у клітинах PC12, дозозалежно знижувало активність каспази-3, -8 і -9 і внутрішньоклітинні концентрації кальцію, підвищених 6-OHDA, не пригнічуючи продукцію АФК [61]. Проводяться дослідження механізму дії сполуки 3f.
Гепатопротекторна дія
Екстракти RYR виявляють сильний гепатопротекторний ефект на мишачих моделях як алкогольної, так і неалкогольної жирової хвороби печінки. У мишей, які хронічно вживали алкоголь, пероральне введення порошкоподібного RYR протягом 5 тижнів значно знижувало підвищені рівні сироваткових трансаміназ (аспартатамінотрансферази й аланінамінотрансферази), печінкових тригліцеридів і ЗХС. Крім того, RYR підвищував печінкову антиоксидантну активність, що зменшувало пошкодження клітин печінки (стеатоз) і знижувало рівень тканинних запальних цитокінів. Ці результати свідчать про те, що ведення RYR може являти собою нову стратегію захисту від алкогольної хвороби печінки шляхом послаблення окиснювального стресу, запальних реакцій і стеатозу. Введення екстрактів RYR (XZK у дозі 300 мг/кг) мишам з NAFLD протягом 6 тижнів значно зменшувало дисліпідемію і накопичення жиру в печінці, послаблювало інсулінорезистентність, полегшувало окиснювальний стрес, зменшувало стеатоз печінки, некрозапалення і відкладення колагену й усувало аномалії рівня амінотрансферази. Механізм дії RYR, імовірно, включає інгібування експресії в клітинах печінки TNF-α. Ці результати свідчать про те, що RYR може мати потенційне клінічне застосування в лікуванні NAFLD [7].
Активність проти стомлюваності
Екстракти RYR виявляють здатність діяти проти втоми. Встановлено, що пероральне введення RYR пацієнтам з дисліпідемією протягом 4 тижнів значно зменшує м’язову втому й зберігає фізичну активність [23]. У моделі щурів Wistar введення порошкоподібного RYR протягом 4 тижнів значно подовжувало час плавання щурів, ефективно затримувало зниження рівня глюкози в крові, запобігало збільшенню концентрації лактату й азоту сечовини в крові, а також сприяло зниженню спричиненого фізичними навантаженнями окиснювального стресу. Отже, RYR ефективно діє проти втоми й потенційно може бути корисним фармакологічним агентом. Екстракти RYR багаті на монаколіни й пігменти. Введення мишам МК або розчинних у етанолі червоних пігментів протягом 30 днів значно підвищувало рівень глікогену в печінці, знижувало рівень азоту сечовини в сироватці крові й збільшувало час плавання в тесті на витривалість. Це вказує на те, що МК і червоні пігменти відповідають за дію RYR проти втоми. Однак необхідні нові дослідження для визначення механізмів дії цих компонентів [7].
Протизапальна активність
Запалення означає збудження метаболічної та імунологічної систем, і протизапальні препарати, які можуть відновити гомеостаз порушеної системи, користуються великим попитом. Існують різні протизапальні препарати, хоча багато з них пов’язані з побічними ефектами [17]. Показано, що RYR пригнічує запалення. У клітинах RAW264.7, інкубованих з ліпополісахаридами, введення азафілоноїдних похідних, виділених з RYR (5–20 мкг/мл), що включали монапурфлуори A і B, монаскопіридини C і D, а також монасфлуори A і B, значно пригнічувало вивільнення запального медіатора оксиду азоту (NO) з макрофагів. Відомо, що NO є сигнальним агентом для різних хвороб, пов’язаних з запальними процесами, а отже, його пригнічення зменшує подразнення [17]. Однак це дослідження не включало інші запальні показники, такі як IL-1β, TNF-α та IL-6, які повинні бути досліджені в майбутньому. У мишей, які мали дієту з високим вмістом холестерину, введення XZK (300 мг/кг) протягом 6 тижнів значно знижувало рівні факторів запалення TNF-α та IL-6, а також послаблювало пошкодження нирок шляхом контролю аномальних рівнів ліпідів і наступного стресу [7, 27].
Антигіпертензивна активність
Гіпертонія, яку зазвичай вважають «тихою вбивцею», є найпоширенішим серцево-судинним захворюванням і основним фактором ризику атеросклерозу, метаболічного синдрому, ниркової дисфункції, інфаркту міокарда, серцевого нападу й інсульту, які є найпоширенішими причинами смерті в розвинутих країнах. Оскільки багато ліків мають побічні ефекти, очікується, що здорове харчування буде запобігати хворобі й полегшувати ускладнення. Досліджується потенціал RYR у поєднанні з іншими біоактивними компонентами для вирішення цієї проблеми. Пацієнтам з есенціальною гіпертензією 1-го ступеня введення нутрицевтичної композиції, що містить RYR, фолієву кислоту, коензим Q10, Orthosiphon stamineus (тропічна трава з родини Lamiaceae), полікозанол і берберин, значно знижувало середні 24-годинні рівні систолічного й діастолічного артеріального тиску. Однак співвідношення між RYR та іншими компонентами не було оптимізовано щодо антигіпертензивної активності. У щурів зі спонтанною гіпертензією внутрішньовенне введення екстрактів етанолу RYR (10–50 мг/кг) викликало двофазний і потужний гіпотензивний і серцевий гальмівний ефект, а також значне зниження симпатичної вазомоторної активності. Необхідні подальші дослідження для виявлення хімічних компонентів екстрактів RYR, відповідальних за антигіпертензивний ефект. Метааналіз наявної літератури показав, що RYR разом із традиційною терапією і статинами може знизити систолічний артеріальний тиск без будь-яких значних побічних ефектів [7, 17, 30]. У сукупності результати є обнадійливими, але обмеженими. Незважаючи на те, що спостерігалося значне зниження артеріального тиску, докази можливості використання RYR для лікування гіпертонії на основі наявних даних є недостатніми.
Інші види активності
Було показано, що полісахариди з RYR мають імуномодулюючу дію. На моделі мишей введення полісахаридів, отриманих з RYR (50–300 мг/кг), значно підвищувало фагоцитарну активність макрофагів черевної порожнини, збільшувало швидкість трансформації лімфоцитів і посилювало неспецифічний імунітет. Однак в цій роботі не досліджували зв’язок між структурою полісахаридів та імуномодулюючою активністю [7].
Пігменти RYR мають і бактерицидні властивості. Гриб Monascus відомий як виробник олігокетидних пігментів, які використовуються для забарвлення харчових продуктів, у тому числі м’ясних. Випробування активності екстракту червоного дріжджового рису, що містить монасцин, рубропунктатин, комплекси рубропунктаміну й монаскуспілоїн, на проростання спор Clostridium і Bacillus показало повне пригнічення проростання спор C.beijerinckii після додавання екстракту RYR до середовища в концентрації 2 %. Для B.subtilis повне пригнічення проростання спор спостерігалося лише після додавання 4% екстракту RYR до середовища, що містить 1,3 % NaCl [62].
У курей-несучок додавання в корм RYR значно збільшувало несучість, одиниці Haugh і висоту білка, а також знижувало вміст холестерину в жовтку. Отже, RYR відіграє важливу роль у покращанні виробництва і якості яєць [7].
Фармакокінетичні дослідження
МК RYR (ловастатин), класифікований як сполука II класу згідно з Біофармацевтичною класифікаційною системою (BCS), головним чином відповідає за ефект зниження рівня холестерину в крові. Хоча монаколін К і ловастатин мають однакову структуру, їхні фармакокінетичні профілі й біодоступність відрізняються. Ловастатин вводиться як єдиний активний інгредієнт з 31% біодоступністю в людей, тоді як монаколін K є лише одним із кількох компонентів RYR, які можуть змінити фармакокінетичний профіль ловастатину [2]. Хімічна структура монаколіну К також підкреслює можливі відмінності у фармакокінетиці та ефективності порівняно з ловастатином, оскільки існують значні варіації у співвідношенні лактону й кислоти. Зокрема, форма кислоти, яка краще засвоюється, коливається від 5 до 100 % від загального монаколіну К — залежно від продукту — і значно впливає на біодоступність молекули. Розкриття лактонового кільця може відбуватися в лужних умовах або може бути ферментативно гідролізовано в тонкій кишці й печінці сімейством цитохрому P450 (CYP450) 3A [2]. МК демонструє низьку біодоступність при пероральному прийомі (< 5 %) через його слабку розчинність (1,3 мкг/мл у воді), інтенсивний метаболізм у кишечнику й печінці та трансмембранний відтік через транспортер P-глікопротеїн. Його біодоступність можна покращити шляхом збільшення швидкості розчинення і/або зменшення пресистемного кліренсу. У клітинах Caco-2 екстракти RYR (LipoCol Forte, XZK і Cholestin) були більш ефективними в інгібуванні активності CYP450-ферментів і P-глікопротеїну, а також показали вищу швидкість поглинання й розчинення ловастатину, ніж ловастатин окремо [63]. Крім того, було показано, що добровольці, які отримували LipoCol Forte, демонстрували більшу площу під кривою «концентрація в плазмі — час» і значення Cmax (максимальна концентрація в плазмі) як для ловастатину, так і для його активного метаболіту — β-оксикислоти, і нижчі значення Тmax (час досягнення пікової концентрації), ніж у тих, хто отримував ловастатин. Це свідчить, що у складі RYR пероральна біодоступність ловастатину значно покращується в результаті підвищення швидкості розчинення [63]. Така швидкість розчинення, яка спостерігається при застосуванні продуктів RYR, може дозволити ловастатину (препарат BCS класу II) функціонувати як препарат I класу BCS. Крім того, була підготована нова рецептура, яка поєднує 60 % желатину із 40 % альгінату [64]. При цьому спостерігали уповільнене вивільнення ловастатину з RYR, тривале інгібування ГMГ-КoA-редуктази та зниження синтезу холестерину. Необхідні подальші дослідження для вивчення основного механізму дії, а також фармакокінетики інших біоактивних сполук, присутніх у RYR, включно з МК і пігментами, такими як рубропунктамін, монаскорубрамін і анкафлавін [7].
Контроль якості
Для оцінки та контролю якості RYR пропонується використовувати морфологію, ультрафіолетову спектрофотометрію, тонкошарову хроматографію та високоефективну рідинну хроматографію (ВЕРХ). MK можна використовувати як маркер якості в офіційному описі RYR, а також на етикетці комерційних продуктів, пов’язаних з RYR. Вміст МК у RYR має бути понад 0,22 % за ВЕРХ. Однак Європейська комісія не встановила законодавчих норм щодо лімітів добавок RYR, і в європейських країнах немає стандартизації, тоді як FDA у 2007 році заявила, що продукти RYR, які містять МК, ідентичні лікам, а отже, підлягають регулюванню. Що стосується терапевтичної ефективності, звіт Європейського агентства з безпеки харчових продуктів (EFSA) підтвердив, що щоденне споживання 10 мг МК було корисним для підтримки нормального рівня холестерину. Однак виробники продуктів RYR рідко розкривають рівні МК, а активні інгредієнти не стандартизовані [7].
Безпека й побічні ефекти
Згідно з наявними на даний момент результатами досліджень in vitro та in vivo, RYR не є мутагеном і токсичним препаратом. У моделі щурів-альбіносів введення гострих доз RYR у 0,5–5,0 г/кг маси тіла не викликало токсичності чи смерті. Подібним чином введення RYR на рівні 2,0–12,0 % протягом 14 тижнів не спричинило жодних значних змін у споживанні їжі або масі тіла щурів, які отримували лікування, порівняно з контрольними щурами. У тесті Ames еквівалент до 1 мг етанольного екстракту з RYR на чашку не виявляв генотоксичності щодо штамів Salmonella typhimurium. Крім того, показано, що високі рівні RYR не виявляли токсичності після субхронічного введення на рівнях до 1000 мг/кг маси тіла протягом 28 і 90 днів поспіль у щурів [7].
Однак RYR має побічні ефекти, оскільки МК і цитринін, який є метаболітом мікотоксину, отриманим у результаті бродіння Monascus, пов’язані з підвищеним ризиком міопатії, симптоматичного гепатиту, периферичної нейропатії, еректильної дисфункції та анафілактичної реакції [7, 65, 66]. Використовуючи італійську систему WHO-UMC, оцінку CIOMS/RUCAM і WHO-Vigibase, в 52 із 1261 дослідження повідомляли про 55 побічних реакцій на дієтичні добавки RYR з квітня 2002 року по вересень 2015 року, а міопатія і гепатит становили 52,73 % від загальної кількості побічних реакцій [8].
Деякі статини, включно з ловастатином (MK у RYR), метаболізуються ферментом цитохрому P450 CYP3A4, і відомо, що одночасне застосування препаратів, які інгібують CYP3A4, може збільшити період напіврозпаду цих статинів, їх концентрацію у плазмі крові та ризик міотоксичності. Інгібітори CYP3A4, які взаємодіють зі статинами і, хоч і рідко, можуть викликати рабдоміоліз, включають: кларитроміцин, верапаміл, циклоспорин, дилтіазем, ітраконазол і азитроміцин, грейпфрутовий сік, інгібітори протеази HIV, фібрати, ніацин, кумарин, нефазодон, макроліди, протигрибкові засоби. Рабдоміоліз, індукований статинами, може бути наслідком підвищеної експозиції препарату, вірогідні механізми взаємодії включають посилене всмоктування ловастатину через конкуренцію за P-глікопротеїн кишечника, зниження кліренсу статину через конкуренцію за канальцеву секрецію нирок або взаємодію в печінкових сайтах з CYP3A4. Одночасне застосування статину й фібрату також підвищує ризик рабдоміолізу, тому слід уникати застосування гемфіброзилу пацієнтам, які отримують ловастатин. Отже, медичні працівники повинні перевіряти можливу взаємодію між лікарськими засобами в пацієнтів, які споживають продукти RYR, а також розглядати можливість раннього моніторингу функції печінки й ознак ушкодження м’язів. Паралельно споживачі повинні бути проінформовані про те, що МК, що міститься в RYR, ідентичний ловастатину і їм необхідно відмовитися від використання препаратів RYR як самолікування, особливо якщо вони зазнали попередніх побічних реакцій на статини [2, 7].
Хоча добавки RYR здаються багатообіцяючими для пацієнтів з гіперхолестеринемією, гіперліпідемією або для тих, хто має високий ризик серцево-судинних подій, добавки, що містять RYR, ще недостатньо контролюються. Поки не буде створена стандартизована система для формулювання й виробництва продукту, а кількість МК у певній добавці RYR не буде чітко визначена, ефективність і безпека цих продуктів залишатимуться під питанням. Необхідне залучення споживачів, клініцистів і політиків, щоб сприяти належному використанню RYR. Крім того, слід проводити рандомізовані контрольовані дослідження для перевірки безпеки й ефективності кожного препарату RYR. Профіль безпеки добавок RYR дуже подібний до профілю статинів [8].
Завдяки його широкому використанню як харчової добавки протягом багатьох років до того, як було виявлено його лікувальні властивості, RYR є продуктом харчування, і до нього слід ставитися як до такого. Щоб зменшити варіабельність вмісту МК у різних препаратах RYR і звести до мінімуму кількість токсичних сполук, таких як цитринін, контроль якості повинен бути впроваджений і забезпечений організаціями, відповідальними за нагляд за продуктами харчування й добавками. Через широкі потенційні переваги для здоров’я RYR слід виробляти як стандартизований препарат для тих, кому це потенційно піде на користь. Він може бути доступним для споживачів як добавка і тому не потребує такого суворого регулювання, як використання ліків. На етикетці продукту необхідно вказувати стандартизовану кількість МК і відсутність токсинів, що є важливим для споживачів, гарантуючи ефективність і безпеку. Споживачам добавки слід рекомендувати регулярно проходити спостереження в медичного працівника, щоб стежити за можливими побічними ефектами та взаємодією з ліками та іншими нутрицевтиками [25].
Європейське агентство щодо безпеки харчових продуктів (EFSA — European Food Safety Agency) визначило, що максимальна доза цитриніну, яку можна приймати людині без нефротоксичності, становить 20 мкг/кг на добу [67], хоча ні генотоксичний, ні канцерогенний вплив не можна з упевненістю виключити. Однак, згідно з нещодавнім метааналізом 53 рандомізованих контрольованих досліджень із 8535 пацієнтами (4437 у групі лікування RYR і 4303 у контрольній групі), використання монаколіну К не пов’язане з підвищеним ризиком побічних ефектів щодо м’язів [45, 68]. Крім того, дослідження продемонструвало зниження ризику нем’язових побічних ефектів і серйозних побічних ефектів порівняно з контрольною групою. Профіль високої переносимості RYR був підтверджений аналізом підгруп. Крім того, збільшення добових доз монаколіну К було пов’язане зі зниженим ризиком побічних ефектів, не пов’язаних з опорно-руховим апаратом [45]. Отже, RYR є загалом переносимою і безпечною дієтичною добавкою для зниження ліпідів навіть у пацієнтів, які раніше не переносили лікування статинами, особливо якщо препарати належним чином контролюються і мають низький вміст монаколіну К (3 мг/день) [69].
Навіть якщо хронічне застосування МК може спричинити легкі або помірні побічні ефекти, вони зазвичай безпечні й добре переносяться.
Нутрицевтичні комбінації з RYR
RYR часто поєднують з іншими продуктами, які можуть ефективно знижувати рівень ліпідів, такими як бергамот, артишок, берберин та інші.
Було проведене рандомізоване дослідження з нутрицевтичними препаратами, які, за попередніми даними, знижують рівень ЛПНЩ: червоний дріжджовий рис, артишок, берберин, бергамот, часник, екстракт зеленого чаю, рослинні стероли/станоли, полікозаноли, силімарин і спіруліна. Визначали: ліпопротеїни низької щільності, загальний холестерин, холестерин ліпопротеїнів високої щільності та тригліцериди сироватки. Загалом було включено 131 випробування, у яких взяли участь 13 062 особи. Усі проаналізовані нутрицевтики, за винятком полікозанолів, були ефективними в зниженні ХС ЛПНЩ і ЗХС порівняно з плацебо. Найефективнішими препаратами щодо зниження ХС ЛПНЩ і ЗХС були бергамот і RYR. Підсумовуючи, можна сказати, що бергамот і RYR є найефективнішими нутрицевтиками щодо зниження ХС ЛПНЩ і ЗХС. Докази ефекту бергамоту можуть вимагати подальших досліджень. Полікозаноли не впливають на ліпідний профіль [7, 70].
Узагальнення доступних клінічних даних про ефективність і безпеку найбільш вивчених і використовуваних гіполіпідемічних нутрицевтиків показало, що все більша кількість метааналізів рандомізованих клінічних досліджень підтверджує ефективність і переносимість сумішей деяких гіполіпідемічних нутрицевтиків, таких як RYR, фракція поліфенолів бергамоту, рослинні стероли й станоли, розчинна клітковина, берберин, екстракти артишоку, часник, зелений чай, спіруліна тощо. Не було висунуто суттєвих зауважень щодо безпеки використання таких продуктів. Також було перевірено зв’язок більшої кількості гіполіпідемічних нутрицевтиків і деяких нутрицевтиків із гіполіпідемічними препаратами. Наявні дані свідчать про те, що деякі клінічно випробувані гіполіпідемічні нутрицевтики можна безпечно використовувати для підвищення рівня ліпідів у плазмі в пацієнтів із легкою та помірною дисліпідемією з низьким серцево-судинним ризиком. Ця терапія може бути особливо важливою для пацієнтів зі змішаною дисліпідемією, особливо атерогенною дисліпідемією в пацієнтів із діабетом і метаболічним синдромом, у пацієнтів з низькою і помірною гіперхолестеринемією, що не досягає цільового рівня ХС ЛПНЩ, і для пацієнтів із побічними ефектами, пов’язаними зі статинами, які мають вищий ризик серцево-судинних подій. Їх ефективність у довгостроковій перспективі (роки) має позитивний вплив на фактори ризику серцево-судинних захворювань, ХС ЛПНЩ і покращує деякі маркери старіння судин (функція ендотелію, швидкість пульсової хвилі) [1].
Висновки
Червоний дріжджовий рис (RYR) демонструє широкий спектр біологічних властивостей, що включає гіполіпідемічні, антиатеросклеротичні, антидіабетичні, антиадипогенні, гепатопротекторні, імуномодулюючі, протизапальні, антигіпертензивні, протиракові, нейроцитопротекторні та антиостеопоротичні ефекти. Серед них гіполіпідемічна й антиатеросклеротична активність є найбільш вираженою.
У результаті численних аналізів були зроблені надійні й послідовні висновки про те, що препарати RYR впливають на фактори ризику метаболічного синдрому. Докази свідчать, що препарати RYR суттєво знижують частоту смерті та MACE при МС і покращують рівень глюкози в крові, ліпідний профіль і артеріальний тиск. Отже, препарати RYR можуть бути ефективним засобом лікування — зменшують фактори ризику МС і запобігають прогресуванню ССЗ.
Завдяки складній системі компонентів RYR, які взаємодіють між собою і підсилюють один одного, препарати RYR більш ефективні, ніж комерційні статини, рідко викликають нетолерантність у пацієнтів і рідше призводять до діабету.
Ще більш перспективним є використання сумішей ліпідознижуючих препаратів, таких як бергамот, артишок, берберин та інші.
Навіть якщо хронічне застосування МК може спричинити легкі або помірні побічні ефекти, вони зазвичай безпечні й добре переносяться. Щоб зменшити варіабельність вмісту МК у різних препаратах RYR і звести до мінімуму кількість токсичних сполук, таких як цитринін, повинен бути впроваджений належний контроль якості.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 02.10.2022
Рецензовано/Revised 13.10.2022
Прийнято до друку/Accepted 20.10.2022
/33.jpg)

/33_2.jpg)