Журнал «Медицина неотложных состояний» Том 18, №7, 2022
Вернуться к номеру
Комбінована спінально-епідуральна анестезія із седацією дексмедетомідином при операціях ендопротезування кульшового й колінного суглобів
Авторы: Галушко О.А. (1), Зенкіна Л.М. (2)
(1) — Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
(2) — ДНУ «Центр інноваційних медичних технологій НАН України», м. Київ, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
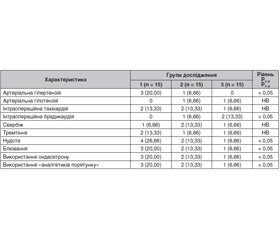
Ендопротезування кульшового й колінного суглобів (ЕККС) є значно поширеними оперативними втручаннями. Одним з поширених захворювань, що негативно впливають на результати цих операцій, є цукровий діабет. Мета дослідження: визначити ефективність і безпечність комбінованої мультимодальної малоопіоїдної анестезії із седацією дексмедетомідином у хворих, яким проводяться операції ЕККС, при супутньому цукровому діабеті. Матеріали та методи. Загалом у дослідження увійшло 45 хворих, яким проведено операцію ЕККС. Хворі були розподілені на 3 групи відповідно дo схеми анестезіологічного зaбeзпeчeння. У хворих 1-ї групи (n = 15) проводилась багатокомпонентна низькопотокова анестезія зі штучною вентиляцією легень; у 2-й групі (n = 15) для знеболювання використовувалася спінальна анестезія; у 3-й групі (n = 15) прoвoдилаcя комбінована спінально-епідуральна анестезія із седацією дексмедетомідином. Результати. Перебіг анестезії у хворих в усіх групах був задовільним, проте у хворих 3-ї групи рідше спостерігалися гіпердинамічні реакції (тахікардія і гіпотензія), післяопераційна нудота й блювання. Лише один пацієнт з 3-ї групи вимагав ондансетрону для лікування післяопераційної нудоти й блювання проти 3 і 2 пацієнтів з 1-ї і 2-ї груп відповідно (р < 0,05). Висновки. Для анестезіологічного забезпечення операцій ЕККС може бути використана будь-яка із запропонованих методик, проте найкращі результати були отримані при використанні комбінованої спінально-епідуральної анестезії із седацією дексмедетомідином.
Background. Hip and knee arthroplasty (HKA) is a common surgical procedure. One of the common diseases that negatively affect the results of these operations is diabetes. The aim of the study: to determine the effectiveness and safety of combined multimodal low-opioid anesthesia with dexmedetomidine sedation in patients undergoing HKA in concomitant diabetes mellitus. Materials and methods. In total, the study included 45 patients who underwent HKA. They were divided into 3 groups depending on the scheme of anesthesia. In group 1 (n = 15), multicomponent low-flow anesthesia with artificial lung ventilation was performed; in group 2 (n = 15), spinal anesthesia was used; in group 3 (n = 15), combined spinal and epidural anesthesia with dexmedetomidine sedation was performed. Results. The course of anesthesia in all groups was satisfactory, but patients in group 3 were less likely to experience hyperdynamic reactions (tachycardia and hypotension), postoperative nausea and vomiting. Only one person from group 3 required ondansetron for the treatment of postoperative nausea and vomiting against 3 and 2 patients from groups 1 and 2, respectively (p < 0.05). Conclusions. Any of the proposed techniques can be used for anesthesia in HKA, but the best results have been obtained in combined spinal and epidural anesthesia with dexmedetomidine sedation.
ендопротезування кульшового суглоба; ендопротезування колінного суглоба; цукровий діабет; ускладнення; дексмедетомідин
hip arthroplasty; knee arthroplasty; diabetes mellitus; complications; dexmedetomidine
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Filipenko V., Tankut V., Mezentsev V. Causes of dislocation of the endoprosthesis head after primary hip arthroplasty. Trauma. 2018. 18(1). 27-33. doi:10.22141/1608-1706.1.18.2017.95587.
- Weber M., Völlner F., Benditz A., Schwarz T., Wörner M., Craiovan B., Renkawitz T., Grifka J. Kniegelenkersatz des älteren Menschen [Total knee arthroplasty in the elderly]. Orthopade. 2017 Jan. 46(1). 34-39. German. doi: 10.1007/s00132-016-3363-5.
- Claßen T., Scheid C., Landgraeber S., Jäger M. Besonderheiten beim elektiven Hüftgelenkersatz des älteren Menschen [Characteristics of elective hipreplacement in the elderly]. Orthopade. 2017 Jan. 46(1). 25-33. German. doi: 10.1007/s00132-016-3364-4.
- Kong L., Cao J., Zhang Y., Ding W., Shen Y. Risk factors for periprosthetic joint infection following primary total hip or knee arthroplasty: a meta-analysis. Int. Wound J. 2017 Jun. 14(3). 529-536. doi: 10.1111/iwj.12640.
- Sloan M., Sheth N., Lee G.C. Is Obesity Associated with Increased Risk of Deep Vein Thrombosis or Pulmonary Embolism after Hip and Knee Arthroplasty? A Large Database Study. Clin. Orthop. Relat. Res. 2019 Mar. 477(3). 523-532. doi: 10.1097/CORR.0000000000000615.
- Roger C., Debuyzer E., Dehl M., Bulaïd Y., Lamrani A., Havet E., Mertl P. Factors associated with hospital stay length, discharge destination, and 30-day readmission rate after primary hip or knee arthroplasty: Retrospective Cohort Study. Orthop. Traumatol. Surg. Res. 2019 Sep. 105(5). 949-955. doi: 10.1016/j.otsr.2019.04.012.
- Wu K.T., Chen C.Y., Chen B., Wang J.W., Lin P.C., Yen S.H. The Incidence and Risk Factors of Acute Kidney Disease after Total Knee Arthroplasty with Early Postoperative Volume Supplement. Biomed Res. Int. 2018 Jul 17. 2018. 8718545. doi: 10.1155/2018/8718545.
- IDF Diabetes Atlas 2021 — 10th edition. Access: www.diabetesatlas.org.betesatlas.org.
- Zheng Y., Ley S.H., Hu F.B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications. Nat. Rev. Endocrinol. 2018 Feb. 14(2). 88-98. doi: 10.1038/nrendo.2017.151.
- Qin W., Huang X., Yang H., Shen M. The Influence of Diabetes Mellitus on Patients Undergoing Primary Total Lower Extremity Arthroplasty: A Systematic Review and Meta-Analysis. Biomed. Res. Int. 2020 Dec 15. 2020. 6661691. doi: 10.1155/2020/6661691.
- Rudy M.D., Ahuja N.K., Aaronson A.J. Diabetes and Hyperglycemiain Lower-Extremity Total Joint Arthroplasty: Clinical Epidemiology, Outcomes, and Management. JBJS Rev. 2018 May. 6(5). e10. doi: 10.2106/JBJS.RVW.17.00146.
- Ren X., Ling L., Qi L., Liu Z., Zhang W., Yang Z. et al. Patients’ risk factors for periprosthetic joint infection in primary total hip arthroplasty: a meta-analysis of 40 studies. BMC Musculoskelet. Disord. 2021 Sep 12. 22(1). 776. doi: 10.1186/s12891-021-04647-1.
- Maradit Kremers H., Lewallen L.W., Mabry T.M., Berry D.J., Berbari E.F., Osmon D.R. Diabetes mellitus, hyperglycemia, hemoglobin A1C and the risk of prosthetic joint infections in total hip and knee arthroplasty. J. Arthroplasty. 2015 Mar. 30(3). 439-43. doi: 10.1016/j.arth.2014.10.009.
- Statz J.M., Odum S.M., Johnson N.R., Otero J.E. Failure to Medically Optimize Before Total Hip Arthroplasty: Which Modifiable Risk Factor Is the Most Dangerous? Arthroplast. Today. 2021 Jul 5. 10. 18-23. doi: 10.1016/j.artd.2021.05.021.
- Prensky C., Urruela A., Guss M.S., Karia R., Lenzo T.J., Egol K.A. Symptomatic venous thrombo-embolism in low-energy isolated fractures in hospitalised patients. Injury. 2013 Aug. 44(8). 1135-9. doi: 10.1016/j.injury.2013.04.018.
- Deng W., Huo L., Yuan Q., Huang D., Li Q., Tian W. Risk factors for venous thromboembolism in patients with diabetes under going joint arthroplasty. BMC Musculoskelet. Disord. 2021 Jul 6. 22(1). 608. doi: 10.1186/s12891-021-04453-9.
- Blaudszun G., Lysakowski C., Elia N., Tramèr M.R. Effect of perioperative systemic α2 agonists on postoperative morphine consumption and pain intensity: systematic review and meta-analysis of randomized controlled trials. Anesthesiology. 2012 Jun. 116(6). 1312-22. doi: 10.1097/ALN.0b013e31825681cb.
- Nair A.S. Benefits of using dexmedetomidine during carotid endarterectomy: A review. Saudi J. Anaesth. 2014 Apr. 8(2). 264-7. doi: 10.4103/1658-354X.130744. PMID: 24843344; PMCID: PMC4024688.
- Khizhnyak A., Ievlevа V., Volkova Y., Sharlai K. Dexmedetomidine as a component of postoperative analgosedation in patients with severe traumatic brain injury. Emergency medicine. 2017. 8(87). 62-66. doi:10.22141/2224-0586.8.87.2017.121325.
- Barends C.R., Absalom A., van Minnen B., Vissink A., Visser A. Dexmedetomidine versus Midazolam in Procedural Sedation. A Systematic Review of Efficacy and Safety. PLoS One. 2017 Jan 20. 12(1). e0169525. doi: 10.1371/journal.pone.0169525.
- Zhang H., Wu Z., Zhao X., Qiao Y. Role of dexmedetomidine in reducing the incidence of postoperative cognitive dysfunction caused by sevoflurane inhalation anesthesia in elderly patients with esophageal carcinoma. J. Cancer Res. Ther. 2018. 14(7). 1497-1502. doi: 10.4103/jcrt.JCRT_164_18.
- Brown E.N., Pavone K.J., Naranjo M. Multimodal General Anesthesia: Theory and Practice. Anesth. Analg. 2018 Nov. 127(5). 1246-1258. doi: 10.1213/ANE.0000000000003668.
- Inagaki Y., Yamakage M., Sakamoto A., Okayama A., Oya N., Hiraoka T., Morita K. The Efficacy and Safety of Dexmedetomidine for Sedation During Surgery Under Epidural or Spinal Anesthesia: A Randomized, Double-Blind, Placebo-Controlled Study. Yonago Acta Med. 2022 Jan 4. 65(1). 14-25. doi: 10.33160/yam.2022.02.002.
- Li C.J., Wang B.J., Mu D.L., Wang D.X. The effect of dexmedetomidine on intraoperative blood glucose homeostasis: secondary analysis of a randomized controlled trial. BMC Anesthesiol. 2021 May 7. 21(1). 139. doi: 10.1186/s12871-021-01360-3.
- Wang K., Wu M., Xu J., Wu C., Zhang B., Wang G., Ma D. Effects of dexmedetomidine onperioperative stress, inflammation, andimmune function: systematic review and meta-analysis. Br. J. Anaesth. 2019 Dec. 123(6). 777-794. doi: 10.1016/j.bja.2019.07.027.

/7/31.jpg)
/7/32.jpg)