Журнал «Здоровье ребенка» Том 17, №7, 2022
Вернуться к номеру
Вплив поєднаної терапії солями кальцію і вітаміном D на екскрецію макро- і мікроелементів із сечею в дітей раннього віку
Авторы: Абатуров О.Є. (1), Крючко Т.О. (2), Кривуша О.Л. (1), Бабич В.Л. (1), Токарєва Н.М. (1), Ткаченко О.Я. (2)
(1) — Дніпровський державний медичний університет, м. Дніпро, Україна
(2) — Полтавський державний медичний університет, м. Полтава, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
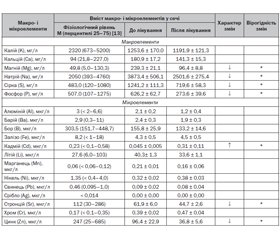
Актуальність. Науковим трендом сучасної медицини є усвідомлення важливої ролі вітаміну D і кальцію в організмі людини. Протягом останніх років відзначається зростання поширеності недостатньої забезпеченості кальцієм серед популяції людей — як дорослих індивідуумів, так і дітей. Основним терапевтичним методом поповнення дефіциту кальцію є застосування препаратів Ca і вітаміну D. Мета роботи: вивчення впливу поєднаного застосування профілактичних доз Ca і вітаміну D на екскрецію макро- і мікроелементів із сечею в дітей раннього віку й встановлення вірогідного взаємозв’язку між балансом основних макро- і мікроелементів. Матеріали та методи. Під нашим спостереженням перебувало 36 клінічно здорових дітей раннього віку, які протягом 2 місяців отримували препарат Кальцикер 2,5 мл 3 рази на добу. Дослідження вмісту макро- і мікроелементів у сечі проведено методом оптико-емісійної спектрометрії з індуктивно-зв’язаною плазмою. Статистичний аналіз отриманих результатів проводили з використанням пакета прикладних програм Statistica 6.1 за допомогою персонального комп’ютера на базі процесора Intel Pentium. Результати. Проведене дослідження продемонструвало, що найбільша концентрація в сечі була характерна для Na, K, S (г/л); середній рівень концентрації в сечі спостерігався в Ca, Mg, P, B, Zn, він коливався в діапазоні від 96,4 мг/л для Mg і Zn до 626,2 мг/л для P; дуже низька концентрація в сечі — нижче за 1 мкг/л — відзначалася в Pb, Cd, Mn, Ni, Cr. Поєднане застосування солей Ca і вітаміну D вірогідно змінювало рівень екскреції деяких макро- і мікроелементів із сечею, що характеризувалося зниженням концентрації Mg — з 239,3 ± 21,1 мг/л до 96,4 ± 8,8 мг/л (p < 0,01), Na — з 3873,4 ± 506,1 мг/л до 2501,6 ± 275,4 мг/л (p < 0,02), S — з 1241,2 ± 111,3 мг/л до 719,6 ± 58,3 мг/л (p < 0,05); P — з 626,2 ± 62,7 мг/л до 273,6 ± 39,6 мг/л (p < 0,05) у сечі. Встановлено, що профілактичний прийом препарату Кальцикер сприяє підтримці балансу Ca і P завдяки регуляції активності екскреції P. Зниження екскреції Zn із сечею після профілактичного курсу поєднаного прийому карбонату Ca і вітаміну D забезпечує підвищення резистентності до інфекційних агентів за рахунок антиоксидантної, протизапальної, імуномодулюючої і противірусної властивостей Zn. Висновки. Поєднане застосування карбонату Ca і вітаміну D (препарат Кальцикер) протягом 2 місяців сприяє затримці цинку, що обумовлює імуномодулюючий ефект препарату, прискорює елімінацію кадмію, який має виражену токсичну дію, і регулює активність екскреції P. Використання препарату Кальцикер у рекомендованій дозі 2,5 мл 3 рази на добу протягом 2 місяців характеризується високим профілем безпеки і може бути рекомендоване дітям раннього віку, особливо з груп ризику розвитку недостатності кальцію.
Background. The scientific trend of modern medicine is the awareness of the important role of vitamin D and calcium in the human body. In recent years, there has been an increase in the prevalence of calcium deficiency among the population of both adults and children. The main therapeutic method of replenishing calcium deficiency is the use of Ca and vitamin D preparations. Purpose: to study the effect of combined use of prophylactic doses of Ca and vitamin D on the urinary excretion of macro- and microelements in young children and to establish a significant relationship between the balance of essential macro- and microelements. Materials and methods. Under our supervision, there were 36 clinically healthy young children who received Calcicare 2.5 ml 3 times a day for 2 months. The study of the urinary content of macro- and microelements was carried out by optical emission spectrometry with inductively coupled plasma. Statistical analysis of the results was carried out with the application package Statistica 6.1 using a personal computer based on Intel Pentium processor. Results. The study showed that the highest urinary concentration was characteristic of Na, K, S; the average level was observed for Ca, Mg, P, B, Zn, which ranged from 96.4 mg/l for Mg and Zn to 626.2 mg/l for P; very low concentration in the urine, below 1 μg/l, was observed for Pb, Cd, Mn, Ni, Cr. The combined use of Ca salts and vitamin D significantly changed the level of urinary excretion of some macro- and microelements. This was characterized by a decrease in the concentration of Mg from 239.3 ± 21.1 mg/l to 96.4 ± 8.8 mg/l (p < 0.01), Na from 3873.4 ± 506.1 mg/l to 2501.6 ± 275.4 mg/l (p < 0.02), S from 1241.2 ± 111.3 mg/l to 719.6 ± 58.3 mg/l (p < 0.05), P from 626.2 ± 62.7 mg/l to 273.6 ± 39.6 mg/l (p < 0.05) in the urine. It was found that the prophylactic administration of Calcicare helps maintain the balance of Ca and P by regulating the activity of P excretion. Reduction of urinary excretion of Zn after a prophylactic combined administration of calcium carbonate and vitamin D provides increased resistance to infectious agents due to the antioxidant, anti-inflammatory, immunomodulatory and antiviral properties of Zn. Conclusions. The combined use of calcium carbonate and vitamin D (Calcicare) for 2 months promotes zinc retention that causes the immunomodulatory effect of the drug, accelerates the elimination of cadmium, which has a pronounced toxic effect and regulates the activity of P excretion. The use of Calcicare in the recommended dose of 2.5 ml 3 times a day for 2 months is characterized by a high safety profile and can be recommended for young children, especially those at risk of developing calcium deficiency.
діти раннього віку; вітамін D; кальцій; макро- і мікроелементи в сечі
young children; vitamin D; calcium; urinary macro- and microelements
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Абатуров О.Є., Крючко Т.О., Кривуша О.Л., Ткаченко О.Я., Бабич В.Л., Мякота К.В. Модуляція активності β-дефензинового захисту в дітей. Здоров’я дитини. 2020. № 7–8(15). С. 15-20. DOI: 10.22141/2224-0551.15.7.2020.219232.
- Абатуров О.Є., Кривуша О.Л., Бабич В.Л. Вплив вітаміну D та кальцію на якість життя дітей раннього віку. Здоров’я дитини. 2021. № 7(16). С. 18-24. DOI: 10.22141/2224-0551.16.7.2021.244576.
- Becquet Ph., Vazquez-Anon M., Mercier Y., Batonon-Alavo D.I., Yan F., Wedekind K., Mahmood T. Absorption of methionine sources in animals — is there more to know? Animal Nutrition. 2022. doi: 10.1016/j.aninu.2022.09.004.
- Behar J. Effect of calcium on magnesium absorption. Am. J. Physiol. 1975 Dec. 229(6). 1590-5. doi: 10.1152/ajplegacy.1975.229.6.1590. PMID: 1211491.
- Chandravanshi L., Shiv K., Kumar S. Developmental toxicity of cadmium in infants and children: a review. Environ. Anal. Health Toxicol. 2021 Mar. 36(1). e2021003-0. doi: 10.5620/eaht.2021003. Epub 2021 Feb 4. PMID: 33730790; PMCID: PMC8207007.
- Chen X., Dai Y., Wang Z., Zhu G., Ding X., Jin T. The association between serum vitamin D levels and renal tubular dysfunction in a general population exposed to cadmium in China. PLoS One. 2018 Apr 10. 13(4). e0195682. doi: 10.1371/journal.pone.0195682. PMID: 29634781; –PMCID: PMC5892922.
- Chen Z., Shi K., Kuang W., Huang L. Exploration of the optimal strategy for dietary calcium intervention against the toxicity of liver and kidney induced by cadmium in mice: An in vivo diet intervention study. PLoS One. 2021 May 11. 16(5). e0250885. doi: 10.1371/journal.pone.0250885. PMID: 33974642; PMCID: PMC8112675.
- Christakos S., Dhawan P., Verstuyf A., Verlinden L., Carmeliet G. Vitamin D: Metabolism, Molecular Mechanism of Action, and Pleiotropic Effects. Physiol. Rev. 2016 Jan. 96(1). 365-408. doi: 10.1152/physrev.00014.2015. PMID: 26681795; PMCID: PMC4839493.
- Dai H., Zhang H., Wang H., Niu J., Luo B., Yan J., Li X. The Effect of Smoking Habits on Blood Cadmium and Lead Levels in Residents Living Near a Mining and Smelting Area in Northwest China: a Cross-Sectional Study. Biol. Trace Elem. Res. 2022 May 2. doi: 10.1007/s12011-022-03248-w. Epub ahead of print. PMID: 35499801.
- Eom S.Y., Yim D.H., Hong S.M., Kim Y.D., Kim H., Choi B.S., Park J.D., Park C.H., Kim G.B., Yu S.D. Changes in blood and urinary cadmium levels and bone mineral density according to osteoporosis medication in individuals with an increased cadmium body burden. Hum. Exp. Toxicol. 2018 Apr. 37(4). 350-357. doi: 10.1177/0960327117705425. Epub 2017 Apr 25. PMID: 28441892.
- Figueres L., Beck-Cormier S., Beck L., Marks J. The Complexities of Organ Crosstalk in Phosphate Homeostasis: Time to Put Phosphate Sensing Back in the Limelight. Int. J. Mol Sci. 2021 May 27. 22(11). 5701. doi: 10.3390/ijms22115701. PMID: 34071837; PMCID: PMC8199323.
- He L., Zhou P., Zhou X., Tian S., Han J., Zhai S. Evaluation of the clinical practice guidelines and consensuses on calcium and vitamin D supplementation in healthy children using the Appraisal of Guidelines for Research and Evaluation II instrument and Reporting Items for Practice Guidelines in Healthcare statement. Front. Nutr. 2022 Sep 27. 9. 984423. doi: 10.3389/fnut.2022.984423. PMID: 36238458; PMCID: PMC9551644.
- Heitland P., Köster H.D. Human biomonitoring of 73 elements in blood, serum, erythrocytes and urine. J. Trace Elem. Med. Biol. 2021 Mar. 64. 126706. doi: 10.1016/j.jtemb.2020.126706. Epub 2020 Dec 14. PMID: 33352468.
- Hoet P., Jacquerye C., Deumer G., Lison D., Haufroid V. Refe–rence values and upper reference limits for 26 trace elements in the urine of adults living in Belgium. Clin. Chem. Lab. Med. 2013 Apr. 51(4). 839-49. doi: 10.1515/cclm-2012-0688. PMID: 23314559.
- Hyde M.L., Fraser D.R. In vivo measurement of the absorption of strontium in the rumen and small intestine of sheep as an index of calcium absorption capacity. Br. J. Nutr. 2014 Sep 14. 112(5). 718-24. doi: 10.1017/S0007114514001500. Epub 2014 Jul 7. PMID: 24998300.
- Kaushik N., Anang S., Ganti K.P., Surjit M. Zinc: A Potential Antiviral Against Hepatitis E Virus Infection? DNA Cell. Biol. 2018 Jul. 37(7). 593-599. doi: 10.1089/dna.2018.4175. Epub 2018 Jun 13. PMID: 29897788.
- Khashim Alswailmi F., Shah S.I.A., Nawaz H., Al-Mazai–deh G.M. Molecular Mechanisms of Vitamin D-Mediated Immunomodulation. Galen Med. J. 2021 Jun 5. 10. e2097. doi: 10.31661/gmj.v10i0.2097. PMID: 35572849; PMCID: PMC9086864.
- Kido S., Kaneko I., Tatsumi S., Segawa H., Miyamoto K. Vitamin D and type II sodium-dependent phosphate cotransporters. Contrib. Nephrol. 2013. 180. 86-97. doi: 10.1159/000346786. Epub 2013 May 6. PMID: 23652552.
- Lagos L.V., Lee S.A., Bedford M.R., Stein H.H. Formulation of diets for pigs based on a ratio between digestible calcium and digestible phosphorus results in reduced excretion of calcium in urine without affecting retention of calcium and phosphorus compared with formulation based on values for total calcium. J. Anim. Sci. 2021 May 1. 99(5). skab138. doi: 10.1093/jas/skab138. PMID: 33939802; PMCID: PMC8158427.
- Lee W., Lee S., Roh J., Won J.U., Yoon J.H. The Association between Involuntary Smoking Exposure with Urine Cotinine Level and Blood Cadmium Level in General Non-Smoking Populations. J. Korean Med. Sci. 2017 Apr. 32(4). 568-575. doi: 10.3346/jkms.2017.32.4.568. PMID: 28244280; PMCID: PMC5334152.
- Marini H.R., Micali A., Squadrito G., Puzzolo D., Freni J., Antonuccio P., Minutoli L. Nutraceuticals: A New Challenge against Cadmium-Induced Testicular Injury. Nutrients. 2022 Feb 4. 14(3). 663. doi: 10.3390/nu14030663. PMID: 35277022; PMCID: PMC8838120.
- Mihatsch W., Thome U., Saenz de Pipaon M. Update on Calcium and Phosphorus Requirements of Preterm Infants and Recommendations for Enteral Mineral Intake. Nutrients. 2021 Apr 27. 13(5). 1470. doi: 10.3390/nu13051470. PMID: 33925281; PMCID: PMC8146348.
- Morton J., Tan E., Leese E., Cocker J. Determination of 61 elements in urine samples collected from a non-occupationally exposed UK adult population. Toxicol. Lett. 2014 Dec 1. 231(2). 179-93. doi: 10.1016/j.toxlet.2014.08.019. Epub 2014 Aug 21. PMID: 25151427.
- Nielsen F.H. The Problematic Use of Dietary Reference Intakes to Assess Magnesium Status and Clinical Importance. Biol. Trace Elem. Res. 2019 Mar. 188(1). 52-59. doi: 10.1007/s12011-018-1573-x. Epub 2018 Nov 27. PMID: 30484139.
- Nikić D., Stojanović D., Stanković A. Cadmium in urine of children and adults from industrial areas. Cent. Eur. J. Public Health. 2005 Sep. 13(3). 149-52. PMID: 16218332.
- Nimni M.E., Han B., Cordoba F. Are we getting enough sulfur in our diet? Nutr. Metab. (Lond). 2007 Nov 6. 4. 24. doi: 10.1186/1743-7075-4-24. PMID: 17986345; PMCID: PMC2198910.
- Peng H., Yao F., Xiong S., Wu Z., Niu G., Lu T. Strontium in public drinking water and associated public health risks in Chinese ci–ties. Environ. Sci Pollut. Res. Int. 2021 May. 28(18). 23048-23059. doi: 10.1007/s11356-021-12378-y. Epub 2021 Jan 12. PMID: 33432414; PMCID: PMC8113192.
- Pérez-Gallardo L., Gómez M., Parra P., Sánchez J., Palou A., Serra F. Effect of calcium-enriched high-fat diet on calcium, magnesium and zinc retention in mice. Br. J. Nutr. 2009 May. 101(10). 1463-6. doi: 10.1017/S0007114508102446. Epub 2008 Nov 6. PMID: 18986597.
- Polzonetti V., Pucciarelli S., Vincenzetti S., Polidori P. Dietary Intake of Vitamin D from Dairy Products Reduces the Risk of Osteoporosis. Nutrients. 2020 Jun 10. 12(6). 1743. doi: 10.3390/nu12061743. PMID: 32532150; PMCID: PMC7353177.
- Portales-Castillo I., Simic P. PTH, FGF-23, Klotho and Vitamin D as regulators of calcium and phosphorus: Genetics, epigenetics and beyond. Front. Endocrinol. (Lausanne). 2022 Sep 29. 13. 992666. doi: 10.3389/fendo.2022.992666. PMID: 36246903; PMCID: PMC9558279.
- Prasad A.S. Zinc is an Antioxidant and Anti-Inflammatory Agent: Its Role in Human Health. Front. Nutr. 2014 Sep 1. 1. 14. doi: 10.3389/fnut.2014.00014. PMID: 25988117; PMCID: PMC4429650.
- Rehman K., Fatima F., Waheed I., Akash M.S.H. Prevalence of exposure of heavy metals and their impact on health consequences. J. Cell. Biochem. 2018 Jan. 119(1). 157-184. doi: 10.1002/jcb.26234. Epub 2017 Aug 2. PMID: 28643849.
- Ross A.C., Taylor C.L., Yaktine A.L., Del Valle H.B. Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium Food and Nutrition Board. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC, USA: National Academies Press; 2011.
- Snedeker S.M., Smith S.A., Greger J.L. Effect of dietary calcium and phosphorus levels on the utilization of iron, copper, and zinc by adult males. J. Nutr. 1982 Jan. 112(1). 136-43. doi: 10.1093/jn/112.1.136. PMID: 7054462.
- Sukumar D., DeLuccia R., Cheung M., Ramadoss R., Ng T., Lamoureux A. Validation of a Newly Developed Food Frequency Questionnaire to Assess Dietary Intakes of Magnesium. Nutrients. 2019 Nov 15. 11(11). 2789. doi: 10.3390/nu11112789. PMID: 31731722; PMCID: PMC6893720.
- Tian Z., Wang Y., Zheng J. Assessment of exposure to toxic me–tals and measures to address deficiency of essential trace elements in young children in rural Hubei, China. Environ. Sci. Pollut. Res. Int. 2020 Jun. 27(17). 21581-21589. doi: 10.1007/s11356-020-08750-z. Epub 2020 Apr 11. PMID: 32279267.
- Vannucci L., Fossi C., Quattrini S., Guasti L., Pampaloni B., Gronchi G. et al. Calcium Intake in Bone Health: A Focus on Calcium-Rich Mineral Waters. Nutrients. 2018 Dec 5. 10(12). 1930. doi: 10.3390/nu10121930. PMID: 30563174; PMCID: PMC6316542.
- Wang C., Zhang R., Wei X., Lv M., Jiang Z. Metalloimmunology: The metal ion-controlled immunity. Adv. Immunol. 2020. 145. 187-241. doi: 10.1016/bs.ai.2019.11.007. Epub 2019 Dec 9. PMID: 32081198.
- Wang H., Wang D., Ouyang Y., Huang F., Ding G., Zhang B. Do Chinese Children Get Enough Micronutrients? Nutrients. 2017 Apr 18. 9(4). 397. doi: 10.3390/nu9040397. PMID: 28420205; PMCID: PMC5409736.
- Zhao D., Juhasz A.L., Luo J., Huang L., Luo X.S., Li H.B., Ma L.Q. Mineral Dietary Supplement To Decrease Cadmium Relative Bioavailability in Rice Based on a Mouse Bioassay. Environ. Sci. Technol. 2017 Nov 7. 51(21). 12123-12130. doi: 10.1021/acs.est.7b02993. Epub 2017 Oct 9. PMID: 28960068.
- Zhao M., Zhu X., Shan D., Huang X., Xu Q. Metabolomics in liver injury induced by dietary cadmium exposure and protective effect of calcium supplementation. Anal. Biochem. 2022 Mar 15. 641. 114556. doi: 10.1016/j.ab.2022.114556. Epub 2022 Jan 19. PMID: 35063435.
- Zofková I., Nemcikova P., Matucha P. Trace elements and bone health. Clin. Chem. Lab. Med. 2013 Aug. 51(8). 1555-61. doi: 10.1515/cclm-2012-0868. PMID: 23509220.

/19.jpg)