Журнал «Здоровье ребенка» Том 17, №6, 2022
Вернуться к номеру
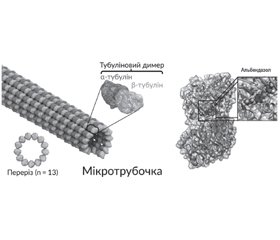
Альбендазол: крізь матрицю теорії до реального препарату
Авторы: Бездітко Н.В., Міщенко О.Я., Матяшова Н.О.
Інститут підвищення кваліфікації спеціалістів фармації Національного фармацевтичного університету, м. Харків, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Глистяні інвазії досить поширені серед населення земної кулі. Найбільш поширеними гельмінтозами в Україні зазвичай були ентеробіоз — близько 75 %, аскаридоз — близько 21 %, трихоцефальоз — близько 3 %. Метою антигельмінтної терапії є ерадикація паразита (дегельмінтизація) та ліквідація клінічних проявів інвазії і наслідків хронічної інтоксикації. Десять років альбендазол входить до переліку життєво необхідних препаратів ВООЗ як ефективний і безпечний антигельмінтний засіб для профілактики і лікування широкого кола гельмінтозів. Результати останніх кокранівських оглядів переконливо свідчать про високу ефективність альбендазолу при найбільш поширених гельмінтозах. Висока ефективність досягається завдяки широкому спектру дії альбендазолу, подвійному механізму та особливостям фармакокінетики. Він впливає на гельмінти в різних стадіях розвитку та на яйця гельмінтів, має можливість знищувати гельмінтів, що знаходяться як у просвіті кишечника, так і во внутрішніх органах організму хазяїна.
Worm infestations are quite common among world population. The most common helminthiasis in Ukraine were usually enterobiasis — about 75 %, ascariasis — about 21 %, trichuriasis — about 3 %. The goal of anthelmintic therapy is the eradication of the parasite (deworming) and the elimination of clinical manifestations of infestation and the consequences of chronic intoxication. For ten years, albendazole has been included in the World Health Organization list of essential drugs as an effective and safe anthelmintic agent for the prevention and treatment of a wide range of helminth infections. The results of the latest Cochrane reviews convincingly testify to the high effectiveness of albendazole in the most common helminth infections. High efficiency is achieved due to the wide spectrum of albendazole action, the dual mechanism and the peculiarities of pharmacokinetics. It affects helminths in various stages of development and helminth eggs, has the ability to destroy helminths located both in the intestinal lumen and in the internal organs of the host’s body.
глистяні інвазії; альбендазол; ефективність; безпека; аскаридоз; гельмінти
worm infestations; albendazole; efficiency; security; ascariasis; helminths
- Montresor A., Mupfasoni D., Mikhailov A., Mwinzi P., Lucianez A., Jamsheed M., et al. The global progress of soil-transmitted helminthiases control in 2020 and World Health Organization targets for 2030. PLoS Negl. Trop. Dis. 2020 Aug 10. 14(8). e0008505. doi: 10.1371/journal.pntd.0008505. PMID: 32776942; PMCID: PMC7446869.
- Ayele A., Tegegne Y., Derso A., Eshetu T., Zeleke A.J. Prevalence and Associated Factors of Intestinal Helminths Among Kindergarten Children in Gondar Town, Northwest Ethiopia. Pediatric Health Med. Ther. 2021 Feb 5. 12. 35-41. doi: 10.2147/PHMT.S290265. PMID: 33574727; PMCID: PMC7873616.
- Vola A., Mariconti M., Lissandrin R., Cuzzocrea F., Bortolotto C., Sammarchi L., et al. Prospective collection of clinical data on cystic echinococcosis: experience with the European Registry of Cystic Echinococcosis in Pavia, Italy. Trans. R. Soc. Trop. Med. Hyg. 2022 Feb 1. 116(2). 157-162. doi: 10.1093/trstmh/trab097. PMID: 34323274.
- Abdeltawabi M.S., Seddik N.E., Salem H.K. World Wide Epidemiology of Helminths Infection. In (Ed.): Human Helminthiasis. 2017. IntechOpen. https://doi.org/10.5772/67273.
- Крамарев С.А. Гельминтозы у детей: ваши вопросы эксперту. Здоров’я України. Тематич. номер «Педіатрія». 2016, грудень. № 4 (39). https://health-ua.com/category/psychiatry.
- Бодня Е.И. Комплексный подход к лечению гельминтозов. Здоровье ребенка. 2017. Т. 12. № 1. http://mili.ua/images/files/vormil_bodnya_komplek_podxod.pdf.
- Else K.J., Keiser J., Holland C.V., Grencis R.K., Sattelle D.B., Fujiwara R.T., et al. Whipworm and roundworm infections. Nat. Rev. Dis. Primers. 2020 May 28. 6(1). 44. doi: 10.1038/s41572-020-0171-3. PMID: 32467581.
- Docu Axelerad A., Stroe A.Z., Gogu A.E., Pusztai A., Jianu D.C., Daniel D., Docu Axelerad D. Clinical spectrum of symptoms in cerebral Toxocariasis (Review). Exp. Ther. Med. 2021 May. 21(5). 521. doi: 10.3892/etm.2021.9953. Epub 2021 Mar 22. PMID: 33815594; PMCID: PMC8014984.
- Fauziah N., Aviani J.K., Agrianfanny Y.N., Fatimah S.N. Intestinal Parasitic Infection and Nutritional Status in Children under Five Years Old: A Systematic Review. Trop. Med. Infect. Dis. 2022 Nov 12. 7(11). 371. doi: 10.3390/tropicalmed7110371. PMID: 36422922; –PMCID: PMC9697828.
- Bharti B., Bharti S., Khurana S. Worm Infestation: Diagnosis, Treatment and Prevention. Indian J. Pediatr. 2018 Nov. 85(11). 1017-1024. doi: 10.1007/s12098-017-2505-z. Epub 2017 Nov 11. PMID: 29127616.
- Wu Y., Duffey M., Alex S.E., Suarez-Reyes C., Clark E.H., Weatherhead J.E. The role of helminths in the development of non-communicable diseases. Front Immunol. 2022 Aug 31. 13. 941977. doi: 10.3389/fimmu.2022.941977. PMID: 36119098; PMCID: PMC9473640.
- Gildner T.E., Cepon-Robins T.J., Urlacher S.S. Cumulative host energetic costs of soil-transmitted helminth infection. Trends Parasitol. 2022 Aug. 38(8). 629-641. doi: 10.1016/j.pt.2022.04.007. Epub 2022 May 19. PMID: 35599133.
- Sorci G., Cornet S., Faivre B. Immune evasion, immunopathology and the regulation of the immune system. Pathogens. 2013 Feb 13. 2(1). 71-91. doi: 10.3390/pathogens2010071. PMID: 25436882; PMCID: PMC4235712.
- Borhani M., Fathi S., Lahmar S., Ahmed H., Abdulhameed M.F., Fasihi Harandi M. Cystic echinococcosis in the Eastern Mediterranean region: Neglected and prevailing! PLoS Negl. Trop. Dis. 2020 May 7. 14(5). e0008114. doi: 10.1371/journal.pntd.0008114. PMID: 32379760; PMCID: PMC7205190.
- Singh B.B., Khatkar M.S., Gill J.P., Dhand N.K. Estimation of the health and economic burden of neurocysticercosis in India. Acta Trop. 2017 Jan. 165. 161-169. doi: 10.1016/j.actatropica.2016.01.017. Epub 2016 Jan 21. PMID: 26802489.
- Bhattarai R., Carabin H., Proaño J.V., Flores-Rivera J., Corona T., Flisser A., León-Maldonado L., Budke C.M. The monetary burden of cysticercosis in Mexico. PLoS Negl. Trop. Dis. 2019 Jul 10. 13(7). e0007501. doi: 10.1371/journal.pntd.0007501. PMID: 31291239; –PMCID: PMC6645581.
- Sung-Tae Hong. Albendazole and Praziquantel. Review and Safety Monitoring in Korea. Infect. Chemother. 2018. 50 (1). 1-10.
- World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533. WHO/MHP/HPS/EML/2021.02.
- Malik K., Dua A. Albendazole. 2022 May 15. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 31971723.
- Badripour A., Behzadi M., Hassanipour A., Azar P.R.S., Rahbar A., Abbaslou Z., et al. Albendazole ameliorates inflammatory response in a rat model of acute mesenteric ischemia reperfusion injury. Biomed Pharmacother. 2022 Sep. 153. 113320. doi: 10.1016/j.biopha.2022.113320. Epub 2022 Jun 22. PMID: 35752010.
- Dilks C.M., Koury E.J., Buchanan C.M., Andersen E.C. Newly identified parasitic nematode beta-tubulin alleles confer resistance to benzimidazoles. Int. J. Parasitol. Drugs Drug Resist. 2021 Dec. 17. 168-175. doi: 10.1016/j.ijpddr.2021.09.006. Epub 2021 Oct 8. PMID: 34637983; PMCID: PMC8503852.
- Tan T.K., Lim Y.A.L., Chua K.H., Chai H.C., Low V.L., Bathmanaban P., et al. Characterization of benzimidazole resistance in Haemonchus contortus: integration of phenotypic, genotypic and proteomic approaches. Parasitol. Res. 2020 Sep. 119(9). 2851-2862. doi: 10.1007/s00436-020-06790-5. Epub 2020 Jul 11. PMID: 32651637.
- Ochoa D., Saiz-Rodríguez M., González-Rojano E., Román M., Sánchez-Rojas S., Wojnicz A., et al. High-Fat Breakfast Increases Bioavailability of Albendazole Compared to Low-Fat Breakfast: Single-Dose Study in Healthy Subjects. Front Pharmacol. 2021 Apr 15. 12. 664465. doi: 10.3389/fphar.2021.664465. PMID: 33935787; PMCID: PMC8082448.
- Verrest L., Dorlo T.P.C. Lack of clinical pharmacokinetic studies to optimize the treatment of neglected tropical diseases: a systematic review. Clin. Pharmacokinet. 2017. 56. 583-606.
- Capece B.P., Virkel G.L., Lanusse C.E. (September 2009). Enantiomeric behaviour of albendazole and fenbendazole sulfoxides in domestic animals: pharmacological implications. Veterinary Journal. 181 (3). 241-50. doi: 10.1016/j.tvjl.2008.11.010. PMID 19124257.
- Junquera P. Albendazole toxicity, poisoning, intoxication, overdose, antidote: safety summary for veterinary use on dogs, cats, cattle, sheep, goats, swine and poultry. Parasitipedia. Archived from the original on August 8, 2017. Retrieved July 24, 2017.
- Schulz J.D., Neodo A., Coulibaly J.T., Keiser J. Pharmacokinetics of Albendazole, Albendazole Sulfoxide, and Albendazole Sulfone Determined from Plasma, Blood, Dried-Blood Spots, and Mitra Samples of Hookworm-Infected Adolescents. Antimicrob. Agents Chemother. 2019 Mar 27. 63(4). e02489-18. doi: 10.1128/AAC.02489-18. PMID: 30745388; PMCID: PMC6437472.
- Whittaker C., Chesnais C.B., Pion S.D.S., Kamgno J., Wal–ker M., Basáñez M.G., Boussinesq M. Factors associated with variation in single-dose albendazole pharmacokinetics: A systematic review and modelling ana–lysis. PLoS Negl. Trop. Dis. 2022 Oct 28. 16(10). e0010497. doi: 10.1371/journal.pntd.0010497. PMID: 36306320; PMCID: PMC9662735.
- Oliveira C.C., Costa D.F.L., Limeira C.H., Nogueira D.B., Nascimento B.H.R., Vaz A.F.M. Anthelmintic intoxication in goats and sheep: A systematic review. Res. Vet. Sci. 2022 Dec 20. 152. 657-662. doi: 10.1016/j.rvsc.2022.09.038. Epub 2022 Oct 5. PMID: 36219891.
- Myers M.J., Howard K.D., Kawalek J.C. Pharmacokinetic comparison of six anthelmintics in sheep, goats, and cattle. J. Vet. Pharmacol. Ther. 2021 Jan. 44(1). 58-67. doi: 10.1111/jvp.12897. Epub 2020 Aug 1. PMID: 32740952.
- Chai J.Y., Jung B.K., Hong S.J. Albendazole and Mebendazole as Anti-Parasitic and Anti-Cancer Agents: an Update. Korean J. Parasitol. 2021 Jun. 59(3). 189-225. doi: 10.3347/kjp.2021.59.3.189. Epub 2021 Jun 21. PMID: 34218593; PMCID: PMC8255490.
- Database of privately and publicly funded clinical studies conduc–ted around the world. https://clinicaltrials.gov/ct2/home.
- Moser W., Schindler C., Keiser J. Efficacy of recommended drugs against soil transmitted helminths: systematic review and network meta-analysis. BMJ. 2017 Sep 25. 358. j4307. doi: 10.1136/bmj.j4307. PMID: 28947636; PMCID: PMC5611648.
- Clarke N.E., Doi S.A.R., Wangdi K., Chen Y., Clements A.C.A., Nery S.V. Efficacy of Anthelminthic Drugs and Drug Combinations Against Soil-transmitted Helminths: A Systematic Review and Network Meta-analysis. Clin. Infect. Dis. 2019 Jan 1. 68(1). 96-105. doi: 10.1093/cid/ciy423. PMID: 29788074.
- Conterno L.O., Turchi M.D., Corrêa I., Monteiro de Barros Almeida R.A. Anthelmintic drugs for treating ascariasis. Cochrane Database Syst. Rev. 2020 Apr 14. 4(4). CD010599. doi: 10.1002/14651858.CD010599.pub2. PMID: 32289194; PMCID: PMC7156140.
- Ordóñez-Mena J.M., McCarthy N.D., Fanshawe T.R. Comparative efficacy of drugs for treating giardiasis: a systematic update of the literature and network meta-analysis of randomized clinical trials. J. Antimicrob. Chemother. 2018 Mar 1. 73(3). 596-606. doi: 10.1093/jac/dkx430. PMID: 29186570; PMCID: PMC5890742.
- Zhao B.C., Jiang H.Y., Ma W.Y., Jin D.D., Li H.M., Lu H., et al. Albendazole and Corticosteroids for the Treatment of Solitary Cysticercus Granuloma: A Network Meta-analysis. PLoS Negl. Trop. Dis. 2016 Feb 5. 10(2). e0004418. doi: 10.1371/journal.pntd.0004418. PMID: 26849048; PMCID: PMC4744042.
- Monk E.J.M., Abba K., Ranganathan L.N. Anthelmintics for people with neurocysticercosis. Cochrane Database Syst. Rev. 2021 Jun 1. 6(6). CD000215. doi: 10.1002/14651858.CD000215.pub5. PMID: 34060667; PMCID: PMC8167835.
- Abuelazm M.T., Abdelazeem B., Badr H., Gamal M., Ashraf M., Abd-Elsalam S. Efficacy and safety of triple therapy versus dual therapy for lymphatic filariasis: A systematic review and meta-analysis. Trop. Med. Int. Health. 2022 Mar. 27(3). 226-235. doi: 10.1111/tmi.13727. Epub 2022 Feb 13. PMID: 35080325.
- Qian M.B., Patel C., Palmeirim M.S., Wang X., Schindler C., Utzinger J., Zhou X.N., Keiser J. Efficacy of drugs against clonorchiasis and opisthorchiasis: a systematic review and network meta-analysis. Lancet Microbe. 2022 Aug. 3(8). e616-e624. doi: 10.1016/S2666-5247(22)00026-X. Epub 2022 Jun 10. PMID: 35697047.
- Haby M.M., Sosa Leon L.A., Luciañez A., Nicholls R.S., Re–veiz L., Donadeu M. Systematic review of the effectiveness of selected drugs for preventive chemotherapy for Taenia solium taeniasis. PLoS Negl. Trop. Dis. 2020 Jan 16. 14(1). e0007873. doi: 10.1371/journal.pntd.0007873. PMID: 31945055; PMCID: PMC6964831.
- Choi J.S., Han J.Y., Ahn H.K., Ryu H.M., Koren G. Foetal outcomes after exposure to albendazole in early pregnancy. J. Obstet. Gynecol. 2017. 37. 1108-1111.
- Salam R.A., Haider B.A., Humayun Q., Bhutta Z.A. Effect of administration of antihelminthics for soil-transmitted helminths during pregnancy. Cochrane Database Syst. Rev. 2015. CD005547
- Salam R.A., Das J.K., Bhutta Z.A. Effect of mass dewor–ming with antihelminthics for soil-transmitted helminths during pregnancy. Cochrane Database Syst. Rev. 2021 May 17. 5(5). CD005547. doi: 10.1002/14651858.CD005547.pub4. PMID: 33998661; PMCID: PMC8127571.
- National Guidelines for Deworming in Pregnancy. Maternal Health Division Ministry of Health and Family Welfare. Government of India. December 2014. Режим доступу: https://www.researchgate.net/publication/282337646_National_Guidelines_for_Deworming_in_Pregnancy_India

/114.jpg)
/155.jpg)
/117.jpg)