Журнал "Гастроэнтерология" Том 56, №4, 2022
Вернуться к номеру
Прогностичне значення вмісту насичених жирних кислот крові при запальних захворюваннях кишечника
Авторы: Стойкевич М.В., Карачинова В.А., Кленіна І.А., Петишко О.П.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
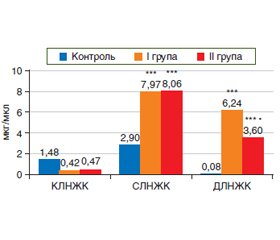
Актуальність. Патогенетичні фактори, які обумовлюють розвиток запальних захворювань кишечника (ЗЗК), залишаються до кінця не вивченими, а саме особливості вмісту насичених жирних кислот (НЖК) у сироватці крові при різних ступенях тяжкості перебігу захворювання, що є досить актуальним завданням. Мета: оцінка вмісту НЖК у сироватці крові пацієнтів залежно від ступеня тяжкості перебігу ЗЗК. Матеріали та методи. Досліджено 37 пацієнтів із ЗЗК, середній вік яких становив (38,5 ± 2,1) року. Залежно від ступеня тяжкості перебігу захворювання пацієнти були розділені на 2 групи: І — із середнім (n = 24) та ІІ — з тяжким ступенем перебігу ЗЗК (n = 13). Контрольну групу становили 16 здорових осіб. Методом газової хроматографії визначено кількісний вміст НЖК у сироватці крові обстежених пацієнтів. Для опису даних застосовували медіану (Ме), нижній (25%) і верхній (75%) квартилі. Результати. В результаті проведеного біохімічного аналізу встановлено тенденцію до зниження вмісту коротколанцюгової НЖК (КЛНЖК, масляної кислоти, p > 0,05) та вірогідне підвищення сумарного вмісту середньо- та довголанцюгових НЖК (СЛНЖК та ДЛНЖК, р < 0,001) в сироватці крові пацієнтів І та ІІ групи щодо контролю. Показано, що зі збільшенням ступеня тяжкості перебігу ЗЗК знижується вміст ДЛНЖК в крові (r = –0,420, p = 0,048). Проаналізовано сироватковий спектр НЖК і встановлено вірогідне збільшення всіх отриманих фракцій СЛНЖК в обох групах пацієнтів: капронової (р < 0,001), каприлової (р < 0,001), капринової (р ≤ 0,002), ундецилової (р ≤ 0,006) та лауринової кислот (р ≤ 0,001). Характерно, що вміст більшості фракцій СЛНЖК мав тенденцію до зниження (p > 0,05) у І проти ІІ групи пацієнтів. Вміст ДЛНЖК, а саме: тридецилової (р ≤ 0,012), міристинової (р < 0,001), пентадецилової (р ≤ 0,012), пальмітинової (р < 0,001), стеаринової (р ≤ 0,001) та генейкоцилової кислот (р < 0,001) вірогідно збільшувався в І та ІІ групі пацієнтів, а вміст маргаринової і арахінової кислот — лише у І групі щодо контролю. Майже всі ДЛНЖК (крім тридецилової кислоти) мали тенденцію до зростання у І проти ІІ групи пацієнтів. Висновки. Показано, що вміст НЖК у крові пов’язаний зі ступенем тяжкості перебігу ЗЗК. Встановлений різноспрямований механізм дії НЖК з різною довжиною карбонового ланцюга, що пов’язаний із впливом на про-/протизапальні медіатори та підтримкою імунного і кишкового гомеостазу. Підтверджено необхідність визначення сироваткових НЖК при ЗЗК з метою корекції виявлених порушень.
Background. Pathogenetic factors that cause the development of inflammatory bowel diseases (IBD) remain poorly understood, namely, the peculiarities of saturated fatty acids (SFAs) in the blood serum at different degrees of disease severity, which is quite an important task. Objective: to evaluate serum level of SFAs depending on IBD severity. Materials and methods. Thirty-seven patients with IBD were examined, their average age was (38.5 ± 2.1) years. Depending on the severity of the disease, the patients were divided into 2 groups: group I — with IBD of moderate severity (n = 24) and group II — with severe IBD (n = 13). The control group consisted of 16 healthy people. The quantitative content of SFAs in the blood serum of the examined patients was determined by gas chromatography. Median (Me), lower (25%) and upper (75%) quartiles were used to describe the data. Results. Biochemical analysis revealed a tendency to decrease in the level of short-chain SFA (butyric acid; p > 0.05) and a significant increase in the total content of medium- and long-chain SFAs (MCSFAs and LCSFAs; p < 0.001) in the serum of group I and II patients compared to the controls. It was found that with increasing severity of IBD, there was a decrease in LCSFAs content in the blood (r = –0.420, p = 0.048). The serum spectrum of SFAs was analyzed and a significant increase in all MCSFAs fractions was detected in both groups of patients: caproic acid (p < 0.001), caprylic acid (p < 0.001), capric acid (p ≤ 0.002), undecylic acid (p ≤ 0.006) and lauric acid (p ≤ 0.001). Characteristically, the content of the most MCSFAs fractions had a tendency to decrease (p > 0.05) in group I against group II of patients. The content of LCSFAs, namely: tridecylic acid (p ≤ 0.012), myristic acid (p < 0.001), pentadecylic acid (p ≤ 0.012), palmitic acid (p < 0.001), stearic acid (p ≤ 0.001) and heneicosylic acid (p < 0.001), increased significantly in group I and II of patients, while the content of margaric and eicosanoic acids — only in group I compared to the controls. Almost all LCSFAs (except tridecylic acid) had a tendency to increase in group I against group II. Conclusions. It has been shown that the content of SFAs in the blood depends on the degree of IBD severity. The mechanism of SFAs action with different carbon chain lengths is multidirectional and is associated with the effect on pro-/anti-inflammatory mediators and with the maintenance of the immune and intestinal homeostasis. The necessity of determining serum SFAs in IBD to correct the identified disorders has been confirmed.
насичені жирні кислоти; запальні захворювання кишечника; середній ступінь перебігу захворювання; тяжкий ступінь перебігу захворювання; пацієнти
saturated fatty acids; inflammatory bowel diseases; moderate severity; severe disease; patients
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Bartoszek A., Moo E.V., Binienda A., et al. Free Fatty Acid Receptors as new potential therapeutic target in inflammatory bowel diseases. Pharmacol Res. 2020. Vol. 152. 104604. doi: 10.1016/j.phrs.2019.104604.
- Russo E., Cinci L., Di Gloria L., et al. Crohn’s disease recurrence updates: first surgery vs. surgical relapse patients display different profiles of ileal microbiota and systemic microbial-associated inflammatory factors. Front Immunol. 2022. Vol. 13. 886468. doi: 10.3389/fimmu.2022.886468.
- Li M., Yang L., Mu C., et al. Gut microbial metabolome in inflammatory bowel disease: From association to therapeutic perspectives. Comput Struct Biotechnol J. 2022. Vol. 20. P. 2402-2414. doi: 10.1016/j.csbj.2022.03.038.
- He J., Luo X., Xin H., et al. The Effects of Fatty Acids on Inflammatory Bowel Disease: A Two-Sample Mendelian Randomization Study. Nutrients. 2022. Vol. 14, № 14. 2883. doi: 10.3390/nu14142883.
- Basson A.R., Chen C., Sagl F., et al. Regulation of Intestinal Inflammation by Dietary Fats. Front Immunol. 2020. Vol. 11. 604989. doi: 10.3389/fimmu.2020.604989.
- Wark G., Samocha-Bonet D., Ghaly S., Danta M. The Role of Diet in the Pathogenesis and Management of Inflammatory Bowel Disease: A Review. Nutrients. 2020. Vol. 13. № 1. 135. 24 p. doi: 10.3390/nu13010135.
- Carretta M.D., Quiroga J., López R., et al. Participation of Short-Chain Fatty Acids and Their Receptors in Gut Inflammation and Colon Cancer. Front Physiol. 2021. Vol. 12. 662739. doi: 10.3389/fphys.2021.662739.
- Zhang Z., Zhang H., Chen T., et al. Regulatory role of short-chain fatty acids in infammatory bowel disease. Cell Communication and Signaling. 2022. Vol. 20. 64. doi: 10.1186/s12964-022-00869-5.
- Piotrowska M., Binienda A., Fichna J. The role of fatty acids in Crohn’s disease pathophysiology — An overview. Mol Cell Endocrinol. 2021. Vol. 538. 111448. 9 p. doi: 10.1016/j.mce.2021. 111448.
- Martin-Gallausiaux С., Marinelli L., Blottière H.M., et al. SCFA: mechanisms and functional importance in the gut. Proc Nutr Soc. 2021. Vol. 80. № 1. P. 37-49. doi: 10.1017/S0029665120006916.
- Cummins E.P., Crean D. Hypoxia and inflammatory bowel disease. Microbes Infect. 2017. Vol. 19. № 3. P. 210-221. doi: 10.1016/j.micinf.2016.09.004.
- Venegas D.P., De la Fuente M.K., Landskron G., et al. Short Chain Fatty Acids (SCFAs)-Mediated Gut Epithelial and Immune Regulation and Its Relevance for Inflammatory Bowel Diseases. Front Immunol. 2019. Vol. 10. 277. doi:10.3389/fimmu.2019.00277.
- Jia M., Zhang Y., Gao Y., Ma X. Effects of Medium Chain Fatty Acids on Intestinal Health of Monogastric Animals. Curr Protein Pept Sci. 2020. Vol. 21. № 8. P. 777-784. doi: 10.2174/1389203721666191231145901.
- Schönfeld P., Wojtczak L. Short- and medium-chain fatty acids in energy metabolism: the cellular perspective. J Lipid Res. 2016. Vol. 57. № 6. P. 943-54. doi: 10.1194/jlr.R067629.
- Kimura I., Ichimura A., Ohue-Kitano R., Igarashi M. Free Fatty Acid Receptors in Health and Disease. Physiol Rev. 2020. Vol. 100. № 1. P. 171-210. doi: 10.1152/physrev.00041.2018.
- Ma C., Vasu R., Zhang H. The Role of Long-Chain Fatty Acids in Inflammatory Bowel Disease. Mediators Inflamm. 2019. Vol. 2019. Article ID 8495913. 10 p. doi:10.1155/2019/8495913.
- Ananthakrishnan A., Khalili H., Konijeti G., et al. Long-term intake of dietary fat and risk of ulcerative colitis and Crohn’s disease. Gut. 2014. Vol. 63. № 5. P. 776-84. doi: 10.1136/gutjnl-–2013-305304.
- Karrasch T., Obermeier F., Straub R.H. Systemic Metabolic Signaling in Acute and Chronic Gastrointestinal Infl ammation of Infl ammatory Bowel Diseases. Horm Metab Res. 2014. Vol. 46. № 06. P. 445-451. doi: 10.1055/s-0034-1374587.
- Scoville E.A., Allaman M.M., Adams D.W., et al. Serum Polyunsaturated Fatty Acids Correlate with Serum Cytokines and Clinical Disease Activity in Crohn’s Disease. Sci Rep. 2019. Vol. 9. № 1. 2882. 11 p. doi: 10.1038/s41598-019-39232-z.
- Murgia A., Hinz C., Liggi S., et al. Italian cohort of patients affected by inflammatory bowel disease is characterised by variation in glycerophospholipid, free fatty acids and amino acid levels. Metabolomics. 2018. Vol. 14. № 10. 140. 14 p. doi: 10.1007/s11306-018-1439-4.
- Kikut J., Drozd A., Mokrzycka M., et al. There Is a Differential Pattern in the Fatty Acid Profile in Children with CD Compared to Children with UC. J Clin Med. 2022. Vol. 11. № 9. 2365. doi: 10.3390/jcm11092365.
- Barnes E.L., Nestor M., Onyewadume L., et al. High Dietary Intake of Specific Fatty Acids Increases Risk of Flares in Patients with Ulcerative Colitis in Remission During Treatment With Aminosalicylates. Clin Gastroenterol Hepatol. 2017. Vol. 15. № 9. Р. 1390-1396.e1. doi: 10.1016/j.cgh.2016.12.036.
- Степанов Ю.М., Діденко В.І., Кленіна І.А., Карачинова В.А., Ошмянська Н.Ю. Спектр жирних кислот сироватки крові пацієнтів із хронічними дифузними захворюваннями печінки залежно від етіології та морфологічних особливостей. Гастроентерологія. 2018. Т. 52. №. 3 С. 127-134. doi: 10.22141/2308-2097.52.3.2018.141841.
- Ichihara K., Fukubayashi Y. Preparation of fatty acid methyl esters for gas-liquid chromatography. J Lipid Res. 2010. Vol. 51. № 3. P. 635-640. doi: 10.1194/jlr.D001065.
- Kandula M., Kumar K.B.S., Palanichamy S., Rampal A. Discovery and preclinical development of a novel prodrug conjugate of mesalamine with eicosapentaenoic acid and caprylic acid for the treatment of inflammatory bowel diseases. Int Immunopharmacol. 2016. Vol. 40. P. 443-451. doi: 10.1016/j.intimp.2016.09.013.
- Hidalgo M., Carretta M.D., Burgos R.A. Long Chain Fatty Acids as Modulators of Immune Cells Function: Contribution of FFA1 and FFA4 Receptors. Front Physiol. 2021. Vol. 12. 668330. doi: 10.3389/fphys.2021.668330.
- Shores D.R., Binion D.G., Freeman B.A., Baker P. New Insights into the Role of Fatty Acids in the Pathogenesis and Resolution of Inflammatory Bowel Disease. Inflamm Bowel Dis. 2011. Vol. 17. № 10. Р. 2192-2204. doi: 10.1002/ibd.21560.
- Nguyen T., Ploeger H.E., Obeid J., et al. Reduced fat oxidation rates during submaximal exercise in adolescents with Crohn’s disease. Inflamm Bowel Dis. 2013. Vol. 19. № 12. P. 2659-65. doi: 10.1097/01.MIB.0000436958.54663.4f.
- Linares R., Fernández M., Gutiérrez A., et al. Endocrine disruption in Crohn’s disease: Bisphenol A enhances systemic inflammatory response in patients with gut barrier translocation of dysbiotic microbiota products. FASEB J. 2021. Vol. 35. № 7. e21697. doi: 10.1096/fj.202100481R.