Международный эндокринологический журнал Том 19, №1, 2023
Вернуться к номеру
Зв’язок активності ксантиноксидази з параметрами гомеостазу глюкози у хворих на цукровий діабет 2-го типу
Авторы: Yu. Karachentsev (1, 2), A. Cherniaieva (1, 2), M. Mykytyuk (1, 2), L. Sergienko (1)
(1) — State Institution “V. Danilevsky Institute for Endocrine Pathology Problems of the National Academy
of Medical Sciences of Ukraine”, Kharkiv, Ukraine
(2) — Kharkiv National Medical University, Kharkiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
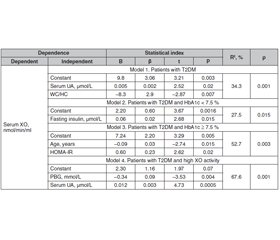
Мета дослідження — визначити зв’язок між клініко-антропометричними показниками, параметрами гомеостазу глюкози й активністю ксантиноксидази (КО) у сироватці крові хворих на цукровий діабет 2-го типу (ЦД2) з урахуванням статі, контролю глікемії та активності КО в сироватці крові. Матеріали та методи. Обстежено 125 хворих на ЦД2 віком від 34 до 81 року, їх середній вік становив 58,9 ± 9,4 року, тривалість захворювання — від одного місяця до 29 років (у середньому 8,9 ± 6,6 року). Вік пацієнтів на момент дебюту захворювання у загальній вибірці дорівнював 29–71 року, у середньому 50,6 ± 9,1 року. Результати. Автори встановили нелінійну залежність активності КО в сироватці крові від концентрації інсуліну натще у хворих на ЦД2 у загальній вибірці, що описується мультиплікативною моделлю (r = 0,45; p = 0,001). Активність КО в сироватці крові хворих на ЦД2 зростає з адаптивним підвищенням секреторної активності β-клітин натще, визначеної за індексом HOMA_β%. Найвищі рівні сироваткової активності КО спостерігаються у хворих на ЦД2 з низькою чутливістю до інсуліну натще (HOMA_S% < 50 %). Крім того, виявлено, що активність КО в сироватці крові обстежених нелінійно пов’язана з показниками QUICKI (r = –0,35; p = 0,016) та Caro (r = –0,40; p = 0,007). Установлено нелінійну залежність активності КО сироватки від інсуліну натще (r = 0,50; p = 0,08) та індексів HOMA_β% (r = –0,53; p = 0,06), HOMA_S% (r = –0,48; p = 0,09), HOMA-IR (r = –0,48; p = 0,09) у чоловіків з оптимальним контролем глікемії (HbA1с < 7,5 %) на рівні тенденції та індексом Caro (r = –0,64; p = 0,02). У жінок цієї групи спостерігалася нелінійна залежність активності КО сироватки крові від інсуліну натще (r = 0,56; p = 0,004), індексів HOMA_β% (r = 0,56; p = 0,003), HOMA_S% (r = –0,54; p = 0,005), HOMA-IR (r = 0,54; p = 0,005), QUICKI (r = –0,50; p = 0,01) і Caro (r = –0,61; p = 0,003). Висновки. У пацієнтів із ЦД2 сироватковий рівень сечової кислоти лінійно пов’язаний з рівнем сироваткової активності КO, що визначає 34 % його варіабельності. Незалежно від стану глікемічного контролю активність КО в сироватці крові хворих на ЦД2 нелінійно пов’язана з параметрами, що характеризують стан гомеостазу глюкози (інсулін натще, індекси HOMA_S%, HOMA_β%, QUICKI і Caro). Предикторами високої активності КО в сироватці крові пацієнтів із ЦД2 є рівень постпрандіальної глікемії (t = –3,53; p = 0,004) і сироватковий вміст сечової кислоти (t = 4,73; p = 0,0005).
Background. The purpose of the study is to determine the associations between clinical and anthropometric parameters, glucose homeostasis and serum xanthinoxidase (XO) activity in patients with type 2 diabetes mellitus (T2DM) taking into account gender, glycemic control and serum XO activity. Materials and methods. One hundred and twenty-five T2DM patients aged 34 to 81 years were examined, with an average age of 58.9 ± 9.4 years, disease duration from 1 month to 29 years (average of 8.9 ± 6.6 years). The age of patients at the time of the disease manifestation in the general sample was from 29 to 71 years, on average 50.6 ± 9.1 years. Results. The authors have found a nonlinear dependence of serum XO activity on fasting insulin concentration in patients with T2DM in the total sample, described by the multiplicative model (r = 0.45; p = 0.001). Serum XO activity in patients with T2DM in the general sample increases with adaptive increase in secretory activity of β-cells on an empty stomach according to the HOMA_β%. Serum ХO activity was highest in T2DM patients with low fasting insulin sensitivity (HOMA_S% < 50 %). In addition, it has been determined that the serum ХО activity in the subjects is nonlinearly associated with the QUICKI (r = –0.35; p = 0.016) and Caro indices (r = –0.40; p = 0.007). We have found a nonlinear dependence of serum XO activity on fasting insulin (r = 0.50; p = 0.08), HOMA_β% (r = –0.53; p = 0.06), HOMA_S% (r = –0.48; p = 0.09), HOMA-IR (r = –0.48; p = 0.09) in men with optimal glycemic control (HbA1c < 7.5 %) at the trend level and Caro (r = –0.64; p = 0.02). In women of this group, there was a nonlinear dependence of serum XO activity on fasting insulin (r = 0.56; p = 0.004), HOMA_β% (r = 0.56; p = 0.003), HOMA_S% (r = –0.54; p = 0.005), HOMA-IR (r = 0.54; p = 0.005), QUICKI (r = –0.50; p = 0.01) and Caro (r = –0.61; p = 0.003). Conclusions. In patients with T2DM, the serum uric acid is linearly associated with the level of serum XO activity, which determines 34 % of its variability. In patients with T2DM, regardless of the state of glycemic control, serum XO activity is nonlinearly associated with parameters characterizing the state of glucose homeostasis (fasting insulin, HOMA_S%, HOMA_β%, QUICKI and Caro indices). Predictors of high serum XO activity in patients with T2DM are the level of postprandial blood glucose (t = –3.53; p = 0.004) and serum uric acid (t = 4.73; p = 0.0005).
ксантиноксидаза; гіперурикемія; цукровий діабет 2-го типу; метаболічний синдром
xanthine oxidase; hyperuricemia; type 2 diabetes mellitus; metabolic syndrome
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Sun H., Saeedi P., Karuranga S., Pinkepank M., Ogurtsova K., Duncan B.B., Stein C. et al. IDF Diabetes Atlas: global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022 Jan. 183. 109119. doi: 10.1016/j.diabres.2021.109119.
- Khan M.A.B., Hashim M.J., King J.K., Govender R.D., Mustafa H., Al Kaabi J. Epidemiology of Type 2 Diabetes — Global Burden of Disease and Forecasted Trends. J. Epidemiol. Glob. Health. 2020 Mar. 10(1). 107-111. doi: 10.2991/jegh.k.191028.001.
- Jauffret C., Ottaviani S., Latourte A., Ea H.K., Graf S., Lio–té F., Bardin T. et al. Simple Application and Adherence to Gout Guidelines Enables Disease Control: An Observational Study in French Referral Centres. J. Clin. Med. 2022 Sep 28. 11(19). 5742. doi: 10.3390/jcm11195742.
- Maloberti A., Giannattasio C., Bombelli M., Desideri G., Cicero A.F.G., Muiesan M.L., Rosei E.A. et al.; Working Group on Uric Acid and Cardiovascular Risk of the Italian Society of Hypertension (SIIA). Hyperuricemia and Risk of Cardiovascular Outcomes: The Experience of the URRAH (Uric Acid Right for Heart Health) Project. High Blood Press. Cardiovasc. Prev. 2020 Apr. 27(2). 121-128. doi: 10.1007/s40292-020-00368-z.
- Wang H., Liu J., Xie D., Liu H., Zhen L., Guo D., Liu X. Elevated serum uric acid and risk of cardiovascular or all-cause mortality in maintenance hemodialysis patients: a meta-analysis. Nutr. Metab. Cardiovasc. Dis. 2021 Feb 8. 31(2). 372-381. doi: 10.1016/j.numecd.2020.11.017.
- Țăpoi L., Șalaru D.L., Sascău R., Stătescu C. Uric Acid — An Emergent Risk Marker for Thrombosis? J. Clin. Med. 2021 May 12. 10(10). 2062. doi: 10.3390/jcm10102062.
- Borghi C., Agnoletti D., Cicero A.F.G., Lurbe E., Virdis A. Uric Acid and Hypertension: a Review of Evidence and Future Perspectives for the Management of Cardiovascular Risk. Hypertension. 2022 Sep. 79(9). 1927-1936. doi: 10.1161/HYPERTENSIONAHA.122.17956.
- Liu F., Chen S., Zhao W., Chen M., Ke J., Zhang Z., Lu J., Li L. Urine Uric Acid Excretion Levels are Positively Associated with Obesity and Abdominal Obesity in Type 2 Diabetes Patients without Chronic Kidney Disease. Diabetes Metab. Syndr. Obes. 2021 Dec 1. 14. 4691-4703. doi: 10.2147/DMSO.S335558.
- Chen M.Y., Zhao C.C., Li T.T., Zhu Y., Yu T.P., Bao Y.Q., Li L.X., Jia W.P. Serum uric acid levels are associated with obesity but not cardio-cerebrovascular events in Chinese inpatients with type 2 diabetes. Sci. Rep. 2017 Jan 4. 7. 40009. doi: 10.1038/srep40009.
- King C., Lanaspa M.A., Jensen T., Tolan D.R., Sánchez-Lozada L.G., Johnson R.J. Uric Acid as a Cause of the Meta–bolic Syndrome. Contrib. Nephrol. 2018. 192. 88-102. doi: 10.1159/000484283.
- Zalawadiya S.K., Veeranna V., Mallikethi-Reddy S., Bavishi C., Lunagaria A., Kottam A., Afonso L. Uric acid and cardiovascular disease risk reclassification: findings from NHANES III. Eur. J. Prev. Cardiol. 2015 Apr. 22(4). 513-8. doi: 10.1177/2047487313519346.
- Falalyeyeva T., Mamula Y., Scarpellini E., Leshchenko I., Humeniuk A., Pankiv I., Kobyliak N. Probiotics and obesity associated disease: an extended view beyond traditional strains. Minerva Gastroenterol. (Torino). 2021 Dec. 67(4). 348-356. doi: 10.23736/S2724-5985.21.02909-0.
- Bandaru P., Shankar A. Association between Serum Uric Acid Levels and Diabetes Mellitus. Int. J. Endocrinol. 2011. 2011. 604715. doi: 10.1155/2011/604715.
- Katsiki N., Dimitriadis G.D., Mikhailidis D.P. Serum Uric Acid and Diabetes: From Pathophysiology to Cardiovascular Disease. Curr. Pharm. Des. 2021. 27(16). 1941-1951. doi: 10.2174/1381612827666210104124320.
- Sluijs I., Holmes M.V., van der Schouw Y.T., Beulens J.W., Asselbergs F.W., Huerta J.M., Palmer T.M. et al.; InterAct Consortium. A Mendelian Randomization Study of Circulating Uric Acid and Type 2 Diabetes. Diabetes. 2015 Aug. 64(8). 3028-36. doi: 10.2337/db14-0742.
- Wu W.C., Lai Y.W., Chou Y.C., Liao Y.C., You S.L., Bai C.H., Sun C.A. Serum Uric Acid Level as a Harbinger of Type 2 Diabetes: A Prospective Observation in Taiwan. Int. J. Environ. Res. Public Health. 2020 Mar 28. 17(7). 2277. doi: 10.3390/ijerph17072277.
- Yaribeygi H., Farrokhi F.R., Butler A.E., Sahebkar A. Insulin resistance: review of the underlying molecular mechanisms. J. Cell. Physiol. 2019 Jun. 234(6). 8152-8161. doi: 10.1002/jcp.27603.
- Pankiv I. Insulin resistance in patients with psoriasis. International Journal of Endocrinology (Ukraine). 2021. 17(7). 570-574. doi: 10.22141/2224-0721.17.7.2021.244973.
- Zamora M., Villena J.A. Contribution of Impaired Insulin Signaling to the Pathogenesis of Diabetic Cardiomyopathy. Int. J. Mol. Sci. 2019 Jun 11. 20(11). 2833. doi: 10.3390/ijms20112833.
- Feoli A.M., Macagnan F.E., Piovesan C.H. et al. Xanthine oxidase activity is associated with risk factors for cardiovascular disease and inflammatory and oxidative status markers in metabolic syndrome: effects of a single exercise session. Oxid. Med. Cell. Longev. 2014. 2014. 587083. doi: 10.1155/2014/587083.
- Zhang J., Dierckx R., Cleland J.G. Xanthine oxidase inhibition for the treatment of cardiovascular disease: a systematic review and meta-analysis. Cardiovasc. Ther. 2014 Apr. 32(2). 57-8. doi: 10.1111/1755-5922.12059.
- Alem M.M., Alshehri A.M., Cahusac P.M. et al. Effect of Xanthine Oxidase Inhibition on Arterial Stiffness in Patients With Chronic Heart Failure. Clin. Med. Insights Cardiol. 2018 Jun 5. 12. 1179546818779584. doi: 10.1177/1179546818779584.
- Doehner W., Jankowska E.A., Springer J., Lainscak M., Anker S.D. Uric acid and xanthine oxidase in heart failure — emerging data and therapeutic implications. Int. J. Cardiol. 2016 Jun 15. 213. 15-9. doi: 10.1016/j.ijcard.2015.08.089.
- Battelli M.G., Polito L., Bortolotti M., Bolognesi A. Xanthine Oxidoreductase-Derived Reactive Species: Physiological and Pathological Effects. Oxid. Med. Cell. Longev. 2016. 2016. 3527579. doi: 10.1155/2016/3527579.
- Nuttall F.Q. Body Mass Index: Obesity, BMI, and Health: A Critical Review. Nutr. Today. 2015 May. 50(3). 117-128. doi: 10.1097/NT.0000000000000092.
- Chawla R., Madhu S.V., Makkar B.M., Ghosh S., Saboo B., Kalra S.; RSSDI-ESI Consensus Group. RSSDI-ESI Clinical Practice Recommendations for the Management of Type 2 Diabetes Mellitus 2020. Indian J. Endocrinol. Metab. 2020 Jan-Feb. 24(1). 1-122. doi: 10.4103/ijem.IJEM_225_20.
- Martorell M., Lucas X., Alarcón-Zapata P., Capó X., Quetglas-Llabrés M.M., Tejada S., Sureda A. Targeting Xanthine Oxidase by Natural Products as a Therapeutic Approach for Mental Disorders. Curr. Pharm. Des. 2021. 27(3). 367-382. doi: 10.2174/1381612826666200621165839.
- Ebbert J.O., Elrashidi M.Y., Jensen M.D. Managing overweight and obesity in adults to reduce cardiovascular disease risk. Curr. Athe–roscler. Rep. 2014 Oct. 16(10). 445. doi: 10.1007/s11883-014-0445-x.
- Kisic B., Miric D., Zoric L. et al. Xanthine oxidase activity in patients with age-related cataract associated with hypertension. Braz. J. Med. Biol. Res. 2018 Mar 26. 51(5). e6129. doi: 10.1590/1414-431X20176129.
- Li X., Meng X., Gao X., Pang X., Wang Y., Wu X., Deng X. et al. Elevated Serum Xanthine Oxidase Activity Is Associated With the Development of Type 2 Diabetes: A Prospective Cohort Study. Diabetes Care. 2018 Apr. 41(4). 884-890. doi: 10.2337/dc17-1434.
- Miric D.J., Kisic B.M., Filipovic-Danic S., Grbic R., Dragojevic I., Miric M.B., Puhalo-Sladoje D. Xanthine Oxidase Activity in Type 2 Diabetes Mellitus Patients with and without Diabetic Peripheral Neuropathy. J. Diabetes Res. 2016. 2016. 4370490. doi: 10.1155/2016/4370490.
- Sunagawa S., Shirakura T., Hokama N., Kozuka C., Yonamine M., Namba T., Morishima S. et al. Activity of xanthine oxidase in plasma correlates with indices of insulin resistance and liver dysfunction in patients with type 2 diabetes mellitus and metabolic syndrome: a pilot exploratory study. J. Diabetes Investig. 2019 Jan. 10(1). 94-103. doi: 10.1111/jdi.12870.
- Hernandez-Hernandez M.E., Torres-Rasgado E., Pulido-Perez P., Nicolás-Toledo L., Martínez-Gómez M., Rodríguez-Antolín J., Pérez-Fuentes R., Romero J.R. Disordered Glucose Levels Are Associated with Xanthine Oxidase Activity in Overweight Type 2 Diabetic Women. Int. J. Mol. Sci. 2022 Sep 23. 23(19). 11177. doi: 10.3390/ijms231911177.
- Azenabor A., Erivona R., Adejumo E., Ozuruoke D., Azenabor R. Xanthine oxidase activity in type 2 diabetic Nigerians. Diabetes Metab. Syndr. 2019 May-Jun. 13(3). 2021-2024. doi: 10.1016/j.dsx.2019.04.022.
- Klisic A., Kocic G., Kavaric N., Jovanovic M., Stanisic V., Ninic A. Xanthine oxidase and uric acid as independent predictors of albuminuria in patients with diabetes mellitus type 2. Clin. Exp. Med. 2018 May. 18(2). 283-290. doi: 10.1007/s10238-017-0483-0.