Международный эндокринологический журнал Том 19, №2, 2023
Вернуться к номеру
Вплив неалкогольного стеатогепатиту на функціональний стан нирок у пацієнтів із цукровим діабетом 2-го типу і діабетичною хворобою нирок
Авторы: Z.Ya. Кotsiubiichuk, O.S. Khukhlina, А.А. Аntoniv, O.Ye. Mandryk
Bukovinian State Medical University, Chernivtsi, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
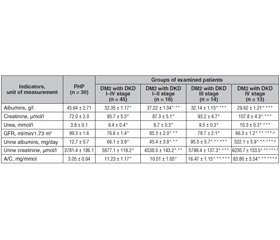
Актуальність. Стеатоз печінки та неалкогольний стеатогепатит (НАСГ) вважаються найпоширенішими патологіями печінки, що в розвинених країнах спостерігаються в 20–30 % дорослого населення. У хворих на цукровий діабет (ЦД) часто виникають такі неспецифічні ураження нирок, як безсимптомна бактеріурія, пієлонефрит, карбункул нирки, абсцес нирки, туберкульоз нирки, папілярний некроз, що значно ускладнюють перебіг діабетичної нефропатії (ДН). На ДН припадає 40 % ускладнень при ЦД 1-го типу та 5–15 % при ЦД 2-го типу. Мета дослідження: встановити вплив неалкогольного стеатогепатиту на функціональний стан нирок у пацієнтів із цукровим діабетом 2-го типу і діабетичною хворобою нирок (ДХН). Матеріали та методи. Обстежено 160 осіб із НАСГ, коморбідним ЦД 2-го типу середньої тяжкості та ДХН I–IV стадій. Проведено проспективне дослідження, у якому взяли участь 160 пацієнтів і 30 практично здорових осіб. Зокрема, 25 хворих на НАСГ із ЦД 2-го типу (перша група), 20 пацієнтів із НАСГ та ожирінням І ступеня (друга група), 70 осіб із НАСГ І–IV стадії (третя група), із них 31 (44,3 %) пацієнт мав ДХН І–ІІ стадії (група 3а), 20 (28,6 %) — ІІІ стадії (група 3б), 19 (27,1 %) — ДХН ІV стадії (група 3в). Результати. У пацієнтів із НАСГ, ЦД 2-го типу та ДХН І–IV стадії гіпоальбумінурія була вірогідно вищою порівняно з показником в осіб із ЦД 2-го типу, ДХН І–IV стадії без НАСГ, що свідчить про вплив НАСГ на рівень альбумінурії; підвищення рівня креатиніну і сечовини в крові; зниження швидкості клубочкової фільтрації, що підтверджує негативний вплив НАСГ на перебіг ЦД 2-го типу з ДХН. За наявності НАСГ у пацієнтів із ДХН був вищий рівень альбумінурії, креатиніну в сечі, співвідношення альбумін/креатинін, ніж за його відсутності. Висновки. Показники функціонального стану нирок у хворих на НАСГ та ЦД 2-го типу змінювалися залежно від наявності ДХН та її стадії. Зі збільшенням стадії ДХН знижувався вміст альбуміну в крові, підвищувалися рівні креатиніну та сечовини. Результатом встановлених змін стало підвищення швидкості клубочкової фільтрації, що свідчить про феномен гіперфільтрації, притаманний початковим стадіям ДХН.
Background. Hepatic steatosis and nonalcoholic steatohepatitis (NASH) are considered the most common liver pathologies, which in developed countries is observed in 20–30 % of the adult population. Patients with diabetes mellitus (DM) often develop non-specific kidney lesions such as asymptomatic bacteriuria, pyelonephritis, kidney carbuncle, kidney abscess, kidney tuberculosis, necrotizing papillitis, or papillary necrosis, which significantly complicate the course of diabetic nephropathy (DN). DN accounts for 40 % of complications in type 1 DM and 5–15 % among patients with type 2 DM. The purpose of the study is to clarify the impact of non-alcoholic steatohepatitis on the renal functional status in patients with type 2 diabetes and diabetic kidney disease (DКD). Materials and methods. One hundred and sixty patients with NASH with comorbid type 2 DM of moderate severity and DКD stages I–IV were examined. A prospective study was conducted, which involved 160 patients and 30 practically healthy individuals. In particular, 25 patients with NASH and type 2 diabetes (group 1), 20 people with NASH and class I obesity (group 2), 70 patients with NASH stage I–IV (group 3), of whom 31 patients (44.3 %) had DКD stage I–II (group 3a), 20 (28.6 %) stage III (group 3b), 19 (27.1 %) had DKD stage IV (group 3c). Results. In patients with NASH, type 2 DM, and DKD stage I–IV, hypoalbuminemia was found to be probably higher compared to that of patients with type 2 DM, DКD stage I–IV and without NASH that indicates the influence of NASH on the level of albuminemia; higher blood level of creatinine and urea; lower glomerular filtration rate, which confirms the negative effect of NASH on the course of type 2 DM with DКD. In the presence of NASH, patients with DКD had a higher level of albuminuria, urinary creatinine, albumin-creatinine ratio than if it’s absent. Conclusions. Indicators of the renal functional state in patients with NASH and type 2 DM varied depending on the presence of DКD and its stage. As the stage of DКD increased, the content of albumin in the blood decreased, the levels of creatinine and urea increased. The result of the detected changes was an increase in glomerular filtration rate, which indicates the phenomenon of hyperfiltration, which is specific for the initial stages of DКD.
неалкогольний стеатогепатит; цукровий діабет 2-го типу; діабетична хвороба нирок; інсулінорезистентність
non-alcoholic steatohepatitis; type 2 diabetes; diabetic kidney disease; insulin resistance
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Henry L., Paik J., Younossi Z.M. Review article: the epidemiologic burden of non-alcoholic fatty liver disease across the world. Aliment. Pharmacol. Ther. 2022 Sep. 56(6). 942-956. doi: 10.1111/apt.17158.
- Muzica C.M., Sfarti C., Trifan A., Zenovia S., Cuciureanu T., Nastasa R., Huiban L. et al. Nonalcoholic Fatty Liver Di–sease and Type 2 Diabetes Mellitus: A Bidirectional Relationship. Can. J. Gastroenterol. Hepatol. 2020 Dec 28. 2020. 6638306. doi: 10.1155/2020/6638306.
- Sagoo M.K., Gnudi L. Diabetic Nephropathy: An Overview. Methods Mol. Biol. 2020. 2067. 3-7. doi: 10.1007/978-1-4939-9841-8_1.
- McGrath K., Edi R. Diabetic Kidney Disease: Diagnosis, Treatment, and Prevention. Am. Fam. Physician. 2019 Jun 15. 99(12). 751-759.
- Yasuda F., Mii A., Morita M., Aoki M., Tagawa M., Aratani S., Kaneko T. et al. Importance of frequency and morphologi–cal characteristics of nodular diabetic glomerulosclerosis in diabetic nephropathy. Hum. Pathol. 2018 May. 75. 95-103. doi: 10.1016/j.humpath.2018.01.019.
- Sulaiman M.K. Diabetic nephropathy: recent advances in pathophysiology and challenges in dietary management. Diabetol. Metab. Syndr. 2019 Jan 23. 11. 7. doi: 10.1186/s13098-019-0403-4.
- Maslianko V. Early diagnostics and incidence of diabetic nephropathy depending on type 1 diabetes mellitus duration. International Journal of Endocrinology (Ukraine). 2017. 13(2). 167-170. doi: 10.22141/2224-0721.13.2.2017.100607 (in Ukrainian).
- Zhang X.X., Kong J., Yun K. Prevalence of Diabetic Nephro–pathy among Patients with Type 2 Diabetes Mellitus in China: A Meta-Analysis of Observational Studies. J. Diabetes Res. 2020 Feb 3. 2020. 2315607. doi: 10.1155/2020/2315607.
- Burrows N.R., Koyama A., Pavkov M.E. Reported Cases of End-Stage Kidney Disease — United States, 2000–2019. MMWR Morb. Mortal Wkly Rep. 2022 Mar 18. 71(11). 412-415. doi: 10.15585/mmwr.mm7111a3.
- Thurlow J.S., Joshi M., Yan G., Norris K.C., Agodoa L.Y., Yuan C.M., Nee R. Global Epidemiology of End-Stage Kidney Disease and Disparities in Kidney Replacement Therapy. Am. J. Nephrol. 2021. 52(2). 98-107. doi: 10.1159/000514550.
- Doshi S.M., Friedman F.N. Diagnosis and Management of Type 2 Diabetic Kidney Disease. CJASN. 2017. 12(8). 1366-1373. doi: 10.2215/CJN.11111016.
- Haneda M., Utsunomiya K., Koya D., Babazono T., Moriya T., Makino H., Kimura K. et al. A new classification of Diabetic Nephropathy 2014: a report from Joint Committee on Diabetic Nephropathy. Clin. Exp. Nephrol. 2015 Feb. 19(1). 1-5. doi: 10.1007/s10157-014-1057-z.
- Pankiv V. Diabetes Mellitus Type 2 and Non-alcoholic Fatty Liver Disease. The Effects of Metformin. International Journal of Endocrinology (Ukraine). 2013. 5(53). 55-63. doi: 10.22141/2224-0721.5.53.2013.84493.
- Khukhlina O., Antoniv A., Kanovska L., Mandryk O., Smandych V. Effectiveness of nonalcoholic steatohepatitis correction on the background of obesity with concomitant chronic kidney disease. Georgian Med. News. 2018 Oct. 283. 76-80.
- Van den Berg E.H., Flores-Guerrero J.L., Gruppen E.G., de Borst M.H., Wolak-Dinsmore J., Connelly M.A., Bakker S.J.L., Dullaart R.P.F. Non-Alcoholic Fatty Liver Disease and Risk of Incident Type 2 Diabetes: Role of Circulating Branched-Chain Amino Acids. Nutrients. 2019 Mar 26. 11(3). 705. doi: 10.3390/nu11030705.
- Bermejo S., Soler M.J., Gimeno J., Barrios C., Rodríguez E., Mojal S., Pascual J. Predictive factors for non-diabetic nephropathy in diabetic patients. The utility of renal biopsy. Nefrologia. 2016 Sep-Oct. 36(5). 535-544. doi: 10.1016/j.nefro.2016.06.006 (in English, Spanish).
- Bril F., Lomonaco R., Orsak B., Ortiz-Lopez C., Webb A., Tio F., Hecht J., Cusi K. Relationship between disease severity, hyperinsulinemia, and impaired insulin clearance in patients with nonalcoholic steatohepatitis. Hepatology. 2014 Jun. 59(6). 2178-87. doi: 10.1002/hep.26988.
- Gastaldelli A. Insulin resistance and reduced metabolic fle–xibility: cause or consequence of NAFLD? Clin. Sci. (London). 2017 Nov 6. 131(22). 2701-2704. doi: 10.1042/CS20170987.
- Khukhlina O.S., Antoniv A.A., Dudka I.V., Dudka T.V., Mandryk O.E. The state of blood lipid spectrum and the indicators of insulin resistance in patients with non-alcoholic steatohepatitis with obesity and hypertensive disease. World of Medicine and Biology. 2018. 2(64). 85-88. doi: 10.26724/2079-8334-2018-2-64-85-88.
- Mantovani A., Byrne C.D., Bonora E., Targher G. Nonalcoholic Fatty Liver Disease and Risk of Incident Type 2 Diabetes: A Meta-analysis. Diabetes Care. 2018 Feb. 41(2). 372-382. doi: 10.2337/dc17-1902.
- Rosso C., Mezzabotta L., Gaggini M., Salomone F., Gambino R., Marengo A., Saba F. et al. Peripheral insulin resistance predicts liver damage in nondiabetic subjects with nonalcoholic fatty liver di–sease. Hepatology. 2016 Jan. 63(1). 107-16. doi: 10.1002/hep.28287.
- Tuttle K.R., Bakris G.L., Bilous R.W., Chiang J.L., de Boer I.H., Goldstein-Fuchs J., Hirsch I.B. et al. Diabetic kidney di–sease: a report from an ADA Consensus Conference. Diabetes Care. 2014 Oct. 37(10). 2864-83. doi: 10.2337/dc14-1296.
- Zac-Varghese S., Winocour P. Managing diabetic kidney di–sease. Br. Med. Bull. 2018 Mar 1. 125(1). 55-66. doi: 10.1093/bmb/ldx047.
- Yamazaki T., Mimura I., Tanaka T., Nangaku M. Treatment of Diabetic Kidney Disease: Current and Future. Diabetes Metab. J. 2021 Jan. 45(1). 11-26. doi: 10.4093/dmj.2020.0217.