Починаючи з 2019 року у зв’язку з COVID-19 ми живемо в умовах гострого і хронічного стресу. Регуляторна система реагування, контролю і захисту від стресу має три ланки: нервову, імунну та ендокринну, які взаємодіють за принципом взаємної регуляції, що забезпечується нейротрансмітерами, гормонами, цитокінами й численними факторами. Їх узгоджена дія, спільне функціонування зберігає гомеостаз і наше фізичне здоров’я [1–5].
У той же час при ураженні однієї з підсистем виникають різноманітні розлади. Наприклад, розлади стрес-адаптивної системи «гіпоталамус — гіпофіз» генерують тривожні й депресивні синдроми, інсомнію, посттравматичний стресовий розлад (ПТСР). Стрес, тривожно-депресивні стани — це чинники серцево-судинного ризику. Унаслідок розладів імунної системи відбувається генерування гострих і активація інфекційних та неінфекційних хронічних запалень, алергічних реакцій. Унаслідок розладів ендокринної системи насамперед формуються порушення функції тиреоїдної, адреналової і статевої системи (рис. 1) [6].
Численні популяційні дослідження вказують на психоемоційний стрес як важливий фактор ризику серцево-судинних захворювань (ССЗ). Найбільш несприятливий ефект має хронічний вплив стресорів, що призводить до стану тривалої психоемоційної напруженості, підвищеної тривоги, фізичного й психічного дискомфорту й депресії. В умовах хронічного стресу відбувається стійка й тривала активація симпатоадреналової та гіпоталамо-гіпофізарно-надниркової осей.
У рекомендаціях Європейського товариства кардіологів (ESC, 2021) до переліку некардіальних захворювань і станів, що підвищують імовірність розвитку ССЗ і потребують оцінки серцево-судинного ризику, включені психічні розлади зі значними функціональними порушеннями [7, 8].
Зв’язок між ССЗ і стресовими розладами досліджували в рятувальників Світового торгового центру (після теракту 11.09.2001; Нью-Йорк; n = 5). Сукупний ризик випадків інфарктів міокарда (ІМ; коефіцієнт небезпеки = 2,2) та інсультів (коефіцієнт небезпеки = 2,5) протягом 5 років був достовірно більшим (р < 0,0001) в осіб із ПТСР. Доведено негативний вплив ПТСР на ініціацію ішемії міокарда, перебіг ішемічної хвороби серця (ІХС) [9]. Частота психогенної стрес-індукованої ішемії міокарда залежить від методу вивчення і коливається в межах 12–55 % (у середньому 30 %) [10].
У ретроспективному когортному дослідженні, що здійснено із застосуванням бази Національного департаменту ветеранів (США, 2003–2011), було проаналізовано дані 138 341 ветерана віком ≥ 55 років без попередніх захворювань серцево-судинної системи. Показано, що наявність ПТСР асоційована з підвищеним ризиком захворювання на інсульт — до 80 %, а частота цереброваскулярної патології збільшується в 1,6 раза [11].
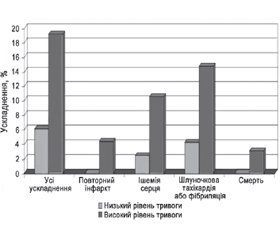
Дослідження D.K. Moser et al. [12] показує (рис. 2), що тривога серед початково здорових осіб часто прогнозує майбутній гострий інфаркт міокарда або смерть через серцево-судинні захворювання незалежно від інших основних факторів ризику. Пацієнти з більш високим рівнем тривоги в 4,9 раза частіше мали такі ускладнення.
Аналіз показників смертності із серцево-судинних причин під час локдауну з приводу COVID-19 (квітень — травень 2020 року) в Нью-Йорку, що лідирує за кількістю хворих і померлих від COVID-19, виявив збільшення випадків смерті внаслідок ІХС, артеріальної гіпертензії (АГ) у 4 рази [13]. Дійсно, локдаун — це ізоляція, самотність, деморалізація і страх, пригнічення психічного стану, відсутність психологічної підтримки та терапії психоневрологічних розладів. Сьогодні зрозуміло, що вірусна пандемія спричинила епідемію тривоги. Кожна 3-тя людина, яка хворіє або хворіла на COVID-19, має тривогу, депресію і порушення сну, ранні й віддалені емоційно-поведінкові наслідки [14, 15].
Досліджена асоціація негативних психологічних чинників із серцево-судинними подіями. Так, депресія підвищує ризик інцидентів ІМ як кінцевої точки (RR = 1,30), інсульту (RR =1,45), АГ (RR = 1,42). Тривожні розлади збільшують ризик ССЗ і смерті (RR= 1,41), інцидентів ІХС (RR = 1,41), стенокардії (RR = 5,20), інсульту (RR = 1,71). Стрес із будь-якої причини збільшує ризик смерті від ІХС (RR = 1,27), також соціальна ізоляція (RR = 1,53), песимізм провокує інциденти ІХС (RR = 2,17) [16].
У Тайвані у 2014 році була проаналізована база даних вибірки з 1997 по 2008 рік із загальною кількістю 1 000 000 суб’єктів. У вибірку включили пацієнтів з першим епізодом ІМ. Раптова смерть, серцево-судинна смерть і госпіталізація внаслідок серцевої недостатності (СН) були оцінені в усіх пацієнтів. Дослідження показало, що ризик серцевої смерті й госпіталізації був знижений у пацієнтів, які отримували малі (1,2 мг щодня; у перерахунку на діазепам) і помірні (1,2–5,0 мг щодня) дози бензодіазепінів порівняно з тими пацієнтами, які не отримали ці ліки [17].
Бензодіазепіни корисні як додаткове лікування аномалій артеріального тиску (АТ) у пацієнтів з генералізованим тривожним розладом (ГТР) [18]. У рандомізованому дослідженні вони були ефективні в боротьбі з лабільною артеріальною гіпертензією [19]. Додаткове застосування бензодіазепінів при АГ привело до загального поліпшення, зниження АТ, зменшення тривожності, стомлюваності й депресії [20].
Є дослідження пацієнтів, які були направлені до відділення невідкладної допомоги у зв’язку з високим АТ (≥ 190/100 мм рт.ст.) без гострих ознак пошкодження органів-мішеней. Досліджувана група отримувала діазепам 5 мг перорально, контрольна група — каптоприл 25 мг сублінгвально. Дві групи були порівняні щодо статі, віку, початкових значень АТ, частоти серцевих скорочень (ЧСС) і лабораторних показників з подальшою рандомізацією. Після призначення медикаментозного лікування АТ і ЧСС реєстрували щогодини протягом 3 годин. В обох групах була однакова динаміка зниження систолічного АТ (САТ), разом з тим у групі діазепаму динаміка зниження діастолічного АТ (ДАТ) була достовірно більша (р < 0,001) [21].
У разі гіпертензивного кризу (ГК) досліджені використані ліки. Як і очікувалося, лікування надзвичайних ситуацій у хворих з АГ ґрунтувалося на комбінації діуретиків, лабеталолу, урапідилу й нітратів. Разом з тим лікарі достатньо часто призначали клонідин (44 %) і діазепам (36 %), хоча діазепам не визнаний антигіпертензивним препаратом. Лікування асоціювалося зі значним зниженням АТ (САТ = –41 мм рт.ст., ДАТ = –21 мм рт.ст.; р < 0,001 для обох) за відносно короткий час (< 5 годин). Показово, що пацієнти, які приймали діазепам, досягли такого ж ступеня зниження АТ, як і пацієнти, які не отримували протитривожного лікування. Крім того, прийом діазепаму обумовлював більш швидке зниження АТ і значне зменшення кількості антигіпертензивних препаратів (0,7 проти 1,2; р < 0,01) [22].
Тому бензодіазепіни можуть використовуватися при лікуванні синдрому тривоги, тривожних розладів, можливо, як терапія першої лінії в пацієнтів із серцево-судинними захворюваннями. Загалом низькі й помірні дози бензодіазепінів корисні при безсимптомній ішемії міокарда, стенокардії, АГ і хронічній СН, особливо в пацієнтів із супутньою тривогою [23].
У зв’язку з цим привертає увагу вітчизняний бензодіазепін Гідазепам IC (Gidazepam IC, «ІнтерХім», Україна), котрий поєднує анксіолітичну й антидепресантну дію на фоні активуючої анти-
астенічної дії. Показаний для лікування станів, при яких відзначається емоційна лабільність, підвищена дратівливість, порушення сну, тривога, страх. Відрізняється Гідазепам IC від інших бензодіазепінів слабо вираженою міорелаксантною дією, зниженим ризиком побічних явищ. У помірних терапевтичних дозах не чинить снодійної дії та не заважає оперантній діяльності. Після сублінгвального прийому 20 або 50 мг дія препарату проявляється через 10–15 хв, досягаючи максимуму протягом 1–4 год (можливий прийом до 3 разів на добу). Усунення гострого нападу тривоги, тривожної симптоматики, жаху здійснюється протягом 1–2 днів. Прийом усіх бензодіазепінів пов’язаний з ризиком, тому використовують мінімальні ефективні дози, короткі курси від 3–5 до 14 днів не рекомендують пацієнтам похилого віку (> 65 років) [24].
На фоні терапії Гідазепамом IC зростає гемодинамічний ресурс і знижуються пресорні судинні реакції. Гідазепам IC нормалізує вміст гістаміну й серотоніну в крові, перешкоджаючи таким чином стресовій активації симпатоадреналової системи. Можна застосовувати Гідазепам IC одноразово як фармакологічний метод контролю страху, якщо ситуація швидкоминуюча. Наприклад, у нашій практиці для лікування ГК найчастіше застосовуємо урапідил, есмолол, еналаприл, фуросемід парентерально, а перорально — каптоприл, пропранолол, торасемід у поєднанні з Гідазепамом IC 20 або 50 мг сублінгвально.
Душевну рівновагу кардіологічних хворих порушує тривожний синдром. Тривожність — перша стадія реалізації стресорної відповіді організму, яка характеризується наявністю фобій, занепокоєнням і/або очікуванням небезпеки, що загрожує людині. Це природна адаптивна реакція на стрес. Однак в умовах хронічного стресу відбувається дисбаланс і неузгодженість активності нейромедіаторних систем, таким чином фізіологічна реакція перетворюється на патологічний стан. Доведено, що в Україні ознаки тривоги й депресії серед пацієнтів із ССЗ досягають 61–74 % [25]. Для діагностики психосоматичних, тривожно-депресивних станів має значення сукупність психічних і соматовегетативних симптомів, аналіз самооцінки пацієнтів, наприклад, за шкалами GAD-7, PHQ-9, HADS A/D, PSS-10.
Необхідно наголосити, що головну роль у лікуванні психосоматичних, тривожно-депресивних розладів відіграють немедикаментозні напрямки: психотерапія (наприклад, когнітивно-поведінкова), водолікування (наприклад, контрастний душ), фізичні вправи або навантаження (в режимі релаксації), модифікація способу життя. Важливим є добре ставлення до пацієнта, роз’яснення причин його стану. Це дозволяє, зокрема, знизити симптоми тривоги й запобігти ініціації панічної атаки (ПА). Добре, якщо пацієнт довіряє своєму лікарю, буде під час консультації разом із близькою людиною [26–28].
Серед переліку медикаментів, які застосовують у пацієнтів з тривожними й панічними психосоматичними станами, особливе значення мають небензодіазепінові анксіолітики, наприклад Мебікар IC (Mebicar IC, «ІнтерХім», Україна). Діюча речовина лікарського засобу Мебікар IC за хімічною структурою є близькою до природних метаболітів організму: молекула мебікару складається з двох метильованих фрагментів сечовини, що не є чужорідним для організму людини. Діє на активність лімбіко-ретикулярного комплексу, зокрема на емоціогенні зони гіпоталамуса, впливає на всі чотири основні нейромедіаторні системи — ГАМКергічну, холінергічну, серотонінергічну й адренергічну, що сприяє їх збалансованості та інтеграції [29].
Мебікар ІС виявляє анксіолітичну активність, усуває відчуття неспокою, тривоги, страху, внутрішнє емоційне напруження й роздратування. Заспокійливий ефект лікарського засобу не супроводжується міорелаксацією. Лікарський засіб не знижує розумову й рухову активність, тому його можна застосовувати протягом робочого дня. Не має снодійного ефекту, але поліпшує сон. Мебікар ІС чинить ноотропну дію, покращує когнітивні функції, підвищує увагу й розумову працездатність; виявляє антиоксидантну активність, він адаптоген і церебропротектор при оксидативному стресі, має антагоністичну активність стосовно збудження адренергічної і глутаматергічної систем. Діє швидко, є ефект першого прийому, препарат призначають незалежно від їжі 300 мг 3 рази на день або 500 мг 2–3 рази на добу. Дія Мебікару IC розгортається протягом перших 1–2 тижнів. Курс лікування — від 4 до 12 тижнів, без звикання й синдрому відміни [31].
Якщо має місце гострий синдром тривоги на підставі гострого стресу, що може супроводжуватися психічною реакцією жаху й безпорадності, потрібне застосування бензодіазепінових анксіолітиків. При гострому стресі за наявності значного жаху можлива комбінація Гідазепаму IC з Мебікаром IC протягом періоду від 3–5 до 14 днів [33]. Далі, якщо дія на тормозні процеси в центральних емоційних зонах недостатня, є перезбудження центральної нервової системи (ЦНС), можлива комбінація Мебікару IC з фенібутом (Нообут® ІС (Noobut IC), «ІнтерХім», Україна).
Нообут ІС є похідним γ-аміномасляної кислоти (ГАМК) і фенілетиламіну. Домінуючою його дією є антигіпоксична й антиамнестична. Поліпшує ГАМКергічну передачу нервових імпульсів у ЦНС, гармонізує процеси збудження й гальмування і запобігає перезбудженню ЦНС. Має властивості транквілізатора: усуває психоемоційне напруження, почуття тривоги, страху, емоційну лабільність, дратівливість, покращує сон. Застосовують по 250–500 мг 3 рази на добу, курс лікування становить від 2 до 6 тижнів [30].
У пацієнтів з АГ I–II ст. призначення мебікару на додаток до антигіпертензивного препарату (еналаприл) сприяє додатковому зниженню офісного САТ на 6,3 %, середньодобового САТ — на 6,4 %, середнього САТ протягом дня і ночі — на 5,1 і 7,7 %. Антигіпертензивний ефект мебікару асоційований зі зменшенням проявів вегетативних розладів (за опитувальником Вейна) у 43,8 % хворих і з їх зникненням — у 43,3 % [31].
Далі у хворих з АГ I–II ст. виявлено підвищений рівень реактивної та особистісної тривожності, депресії та алекситимії, надмірна активність симпатичної нервової системи, що мають прямий кореляційний зв’язок із середньодобовим рівнем АТ (r = 0,67; r = 0,52; r = 0,64; r = 0,41; p < 0,05). Застосування традиційного гіпотензивного лікування з додатковим включенням мебікару максимально усувало прояви тривожно-депресивних симптомів, унормувало функціональну активність надниркових залоз і рівень нейромедіаторів [32].
Для оцінки схильності до хронічного стресу хворих на стабільну ІХС із постійною формою фібриляції передсердь (ФП) використовували шкалу PSS-10, для аналізу ступеня тривоги та депресії — шкали HADS A/D і PHQ-9. Низький рівень стресу виявлено тільки в 6,6 % (р < 0,01). У чоловіків з ІХС у поєднані з ФП частіше, ніж у жінок (13,3 %), відзначалися високий рівень стресу (26,6 %, р < 0,01) і виражена тривожно-депресивна симптоматика (46,6 %, р < 0,01). Включення мебікару 500 мг двічі на добу до базисної фармакотерапії хворих на ІХС у поєднанні з ФП сприяє корекції хронічного стресу, тривоги і депресії, покращенню сну, імовірному поліпшенню показників психологічних шкал [33, 34].
Досліджена динаміка синдрому СН у пацієнтів з ІХС і значною поширеністю розладів баро-, хемо- і психовегетативної реактивності, що пов’язані з ризиком прогресування СН (у 1,6–3,8 раза). Психовегетативні порушення є характерною особливістю пацієнтів зі зниженою фракцією викиду лівого шлуночка, застійними стадіями СН і високим ступенем вираженості психосоматичних розладів. Додавання мебікару до базової терапії пацієнтам із СН і поєднаною психовегетативною дисфункцією приводить до редукції депресивної та тривожної симптоматики. Використання мебікару приводило до поліпшення барорефлекторної (р = 0,006), психовегетативної реактивності (р = 0,003), поліпшення перебігу ІХС, зниження потреби в прийомі нітрогліцерину (р < 0,05) [35].
Додавання до базисної терапії ІХС, асоційованої з метаболічним синдромом (МС), препарату мебікар 500 мг тричі на добу супроводжується зменшенням вираженості тривожно-депресивних розладів і вегетативної симптоматики за шкалами PHQ-9 (на 23,9 %), PHQ-15 (на 28,8 %), GAD-7 (на 37,8 %), HADS-A (на 30,1 %), HADS-D (на 36,3 %), SAQ (на 30,8 %) і Вейна. Усунення психовегетативних розладів супроводжувалося нормалізацією загальної активності вегетативної нервової системи і симпатико-парасимпатичного балансу, а також поліпшенням якості життя хворих з ІХС і супутнім МС [36].
Встановлено, що третина кардіологічних хворих має симптоми тривоги (32 % з 12 913 пацієнтів). Досліджена смертність потягом року після госпіталізації. Найчастіше з приводу тривожного синдрому лікарі додатково призначали бензодіазепіни (68 %) й антидепресанти (55 %). Серед хворих з тривожними розладами смертність була більшою (6 %) порівняно з пацієнтами, які не приймали психотропні препарати (2 %). Призначення психотропних ліків є відображенням психічної захворюваності, що підвищує ризик смерті [37].
Узагалі сприятливий анксіолітичний ефект мебікару доведений у комплексному лікуванні пацієнтів з низкою ССЗ — АГ, ІХС, пароксизмальною й постійною формами ФП, СН тощо. Мебікар усуває соматовегетативні симптоми, що можуть турбувати кардіологічних хворих: тахікардію, екстрасистолію, кардіалгію, гіпер- або гіпотензивні кризи [38].
Хронічний стрес унаслідок COVID-19 надзвичайно посилився за рахунок гострих і хронічних стресорних реакцій під час війни [39–42]. У зв’язку з цим стали звичними тяжкі форми тривожних розладів (наприклад, генералізований тривожний розлад, панічні розлади/атаки (ПР/ПА), ПТСР тощо) [43]. Тут з’ясуємо, що може бути перекриття основної симптоматики ССЗ і психосоматичної, соматовегетативної. Тому в кардіологічних пацієнтів є обов’язковими структурований аналіз психологічних шкал (наприклад, GAD-7, PHQ-9, HADS A/D, PTSD CAPS-5, SAQ тощо) і диференціальна діагностика з перебігом основного захворювання, можливо, ускладнень (наприклад, ІМ, порушення ритму серця, емболія легеневої артерії, тразиторна ішемічна атака тощо) [44, 45].
Доведено, що наявність ГТР у пацієнтів з ІХС підвищує ризик несприятливих серцевих подій на 36–88 %. Поширеність ГТР і ПР серед хворих на ІХС — 24 і 53 %, утім, ризики в 15 разів вище, ніж у популяції, що призводять до несприятливих серцевих подій і більшої інвалідності [46]. ГТР пов’язаний з кризовим перебігом АГ, ожирінням, цукровим діабетом (ЦД) і дисліпідемією, які збільшують серцево-судинні ризики [51]. Лікування ГТР зменшує ризики й поліпшує лікування ІХС [47].
Підвищені захворюваність і серцево-судинна смертність пояснюються зв’язком психологічних факторів зі стимуляцією вегетативної нервової системи, що викликає вироблення катехоламінів, збільшення АТ, констрикцію коронарних артерій, підвищення активації тромбоцитів [4]. Далі активується тромбогенез, аритмогенез, ішемія міокарда й порушується функція шлуночків серця [48]. Тривога й депресія можуть бути предикторами смерті — у пацієнтів з оцінкою за HADS-A ≥ 8 балів ризики у 2 рази більші (НR = 1,92), при HADS-D ≥ 8 балів НR становить 2,29, а зменшення балів асоційоване зі зменшенням ризиків смерті [49]. Пацієнти з ПТСР мають підвищений ризик розвитку ССЗ і смерті від них (зокрема, ішемії міокарда, ІМ), який є ще більшим серед ветеранів-чоловіків [50, 51].
Додаткова фармакотерапія показана у випадках тяжких форм тривожних розладів (наприклад, ГТР, ПР/ПА, ПТСР). Розглядають це питання в разі недостатньої ефективності лікування тривожно-депресивних психосоматичних станів із застосуванням бензодіазепінових і небензодіазепінових анксіолітиків, у випадках рецидиву психовегетативної симптоматики. Початкове лікування включає прийом антидепресанту й антиконвульсанту. Пам’ятаємо, що в кардіологічних хворих необхідно враховувати безпеку фармакотерапії афективних розладів [52]. Наприклад, з обережністю застосовують селективні інгібітори зворотного захоплення серотоніну (СІЗЗС) пацієнтам, які приймають антитромбоцитарні препарати (альтернатива — тразодон, міртазапін, міансерин) [30].
Препарати першої лінії серед антидепресантів — це СІЗЗС (наприклад, сертралін 25–150 мг/добу, есциталопрам 5–20 мг/добу, пароксетин 10–50 мг/добу, флувоксамін 50–200 мг/добу) в поєднанні з антиконвульсантом (наприклад, прегабалін від 75 мг/добу). Лікувальний період — до 6 тижнів, стабілізація стану — до 6 місяців, профілактика рецидиву — до 12 місяців [43, 46, 53–60].
Бензодіазепіни додатково застосовують лише у випадках наявності кризової ситуації, гострої стресової реакції, рефрактерності до препаратів першої лінії. Наприклад, застосування «денного» транквілізатора (Гідазепам IC) можливе на старті за наявності гострої стресової реакції (до 14 днів), поки СІЗЗС не почнуть діяти [25, 61, 62].
ГТР досить часто (до 68 %) поєднується з ПР [63–65]. ПР передбачає виникнення ПА як пароксизму тривоги. ПА — це хвиля інтенсивного страху із соматовегетативними симптомами, що виснажує хворих і вимагає невідкладних дій [66, 67]. Разом із психологічною корекцією з метою усунення хвилі ПА використовують комбінацію бензодіазепінового анксіолітика (наприклад, Гідазепам IC 20–50 мг 2–3 р/добу короткочасно), небензодіазепінового анксіолітика (наприклад, Мебікар IC, перша доза 1000 мг, потім 500 мг тричі на добу) і прегабаліну 75–150 мг; якщо є тахікардія, можна додати бета-блокатор (наприклад, метопрололу тартрат 50 мг). Далі налаштовують базову терапію із застосуванням психотерапії та СІЗЗС [30].
Серед тривожних розладів поширеним явищем є порушення сну — до 40–80 % (частіше при ПТСР) [68]. Відомо, що сон — це головна адаптаційна й антистресова система, що визначає ступінь резистентності організму до різноманітних стресів. Під час сну можливості адаптаційно-антистресової системи забезпечують пристосування організму до навколишнього середовища й загальну стресостійкість. У випадку інсомнії пацієнти найчастіше мають такі скарги: потрібно понад 30 хв, щоб заснути, або є страх перед неможливістю заснути, всю ніч у голову «лізуть думки», часті пробудження протягом ночі і неможливість повторного засинання, ранні пробудження (додатково можливий аналіз шкал, наприклад PSQI, BSAS). У результаті досліджень виявлена висока коморбідність інсомнії з різними захворюваннями, зокрема із серцево-судинними, неврологічними й метаболічними. Показана кардіопротективна роль сну [69].
Інсомнія пов’язана з поганим настроєм, зниженням якості життя, а також із ризиком ССЗ. Дослідження показали підвищення рівня кортизолу, зниження імунітету й підвищення маркерів симпатичної активності в людей із хронічним безсонням. Хронічна інсомнія й укорочення сну пов’язані з розвитком ЦД, АГ і ССЗ [70].
Пацієнти як із симптомами депресії, так і з розладами сну (OR = 2,64) мали вищий ризик ССЗ, ніж пацієнти без них. З 30 398 учасників 38 % мали ССЗ, а 62 % — не мали [71].
У перехресне дослідження, засноване на Національному дослідженні здоров’я та харчування (NHANES) 2005–2008 рр., були включені 7850 учасників віком від 20 років. Багатофакторний регресійний аналіз показав, що проблеми зі сном пов’язані зі збільшенням ризику ССЗ на 75 %, застійної СН — на 128 %, стенокардії — на 96 %, ІМ — на 105 %, інсульту — на 78 % [72].
Безсоння дуже поширене серед пацієнтів із СН. Дані щодо симптомів безсоння, включно з труднощами із засинанням, підтримкою сну, невідновним сном і серцево-судинними факторами ризику, були зібрані в 54 279 чоловіків і жінок віком 20–89 років, які брали участь у дослідженні Nord-Trøndelag Health (HUNT) між 1995 і 1997 роками і не мали відомої СН на початковому рівні. У цій когорті спостерігали за випадками СН з початкового рівня до 2008 року. Показано зв’язок між кількістю симптомів безсоння (важко заснути, нічне пробудження, нестача сну) і ризиком СН. Коефіцієнт ризику становив 0,96 для людей з одним симптомом безсоння і 1,35 і 4,53 — для людей з двома і трьома симптомами порівняно з людьми без жодного симптому [73].
Вплив інсомнії на ризик повторних серцево-судинних подій (MACE) вивчався в проспективному когортному дослідженні, яке включало 1082 пацієнти, через 2–36 місяців після ІМ і/або коронарної реваскуляризації. Клінічну інсомнію оцінювали за шкалою безсоння Бергена (BIS). Первинну комбіновану кінцеву точку MACE (серцево-судинна смерть, госпіталізація через ІМ, реваскуляризація, інсульт або СН) оцінювали із середнім періодом спостереження 4,2 року. На початковому етапі середній вік становив 62 роки, 45 % повідомили про клінічне безсоння. Для клінічної інсомнії відносний ризик рецидиву MACE становив 1,62 з поправкою на вік, стать і попередні коронарні події. Ці результати підкреслюють важливість виявлення й лікування безсоння в пацієнтів з ІХС [74].
У випадках, коли інсомнія пов’язана з прохідним стресом, фобією або ситуація підлягає поведінковій корекції, як доповнення до немедикаментозних методів може призначатися: бензодіазепін (наприклад, Гідазепам ІС 20–50 мг/ніч, якщо < 65 років), агоніст бензодіазепінових рецепторів (наприклад, зопіклон) або селективний агоніст ГАМК (наприклад, Левана® ІС 0,5–2 мг/ніч) разом з небензодіазепіновим анксіолітиком (Meбікар ІС 500 мг 3 рази на день). Коротким курсом, до 10–14 днів, максимально до 4 тижнів [75].
Левана® ІС (Levana IC, «ІнтерХім», Україна) є селективним агоністом ГАМК-А-рецепторного комплексу. Належить до групи похідних бензодіазепіну. Чинить виражену снодійну, анксіолітичну, помірну міорелаксантну дію. Особливістю снодійної дії препарату є здатність збільшувати тривалість не тільки повільнохвильового, але й парадоксального сну при незмінній кількості його епізодів, що робить снодійний ефект препарату більш фізіологічним. Дає ефект засинання, це важливо для тих пацієнтів, що неодноразово прокидаються посеред ночі. Разова доза індивідуальна — від 0,5 мг до 2 мг/ніч, курс лікування — від 3–5 до 14–30 днів [76]. Проведене дослідження за більшістю показників суб’єктивної та об’єктивної оцінки статистично підтвердило швидку й виражену клінічну ефективність препарату Левана® IC у лікуванні інсомнії. За даними полісомнографічного дослідження встановлено, що на тлі терапії препаратом Левана® IC простежувалась нормалізація процесу засинання, збільшення тривалості нічного сну, збільшення тривалості глибоких стадій фази повільнохвильового сну, зменшення часу дрімотного стану, збільшення тривалості фази швидкого сну, відновлення циклічності сну і його ефективності [77].
Якщо інсомнія виходить за межі 4 тижнів, розвивається на фоні хронічного стресу і не має транзиторного характеру, її лікують із застосуванням антидепресанту, дія якого пов’язана із седативним ефектом і усуненням порушень сну (тразодон, міртазапін, міансерин або агомелатін), і антиконвульсанту (наприклад, прегабалін) [77–81].
Висновки
Отже, порушення душевної рівноваги кардіологічних хворих пов’язане з наявністю психосоматичних розладів, тривожно-депресивних станів, що обтяжують основне захворювання, підвищують ризики несприятливого перебігу серцево-судинних захворювань. Немедикаментозна й медикаментозна терапія психосоматичних відхилень є обґрунтованою. Серед лікарських засобів препаратами першої лінії для усунення психологічних і соматовегетативних симптомів є бензодіазепінові й небензодіазепінові анксіолітики; у випадку транзиторної інсомнії можливий короткий курс снодійного препарату. У випадках тяжких форм тривожних розладів ліками першої лінії початкової терапії є СІЗЗС і прегабалін.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 30.01.2023
Рецензовано/Revised 11.02.2023
Прийнято до друку/Accepted 14.02.2023
Список литературы
1. Miller A.H., Maletic V., Raison C.L. Inflammation and its discontents: the role of cytokines in the pathophysiology of major depression. Biol. Psychiatry. 2009 May 1. 65(9). 732-41. doi: 10.1016/j.biopsych.2008.11.029. Epub 2009 Jan 15. PMID: 19150053; PMCID: PMC2680424.
2. Danese A., Lewis S.J. Psychoneuroimmunology of Early-Life Stress: The Hidden Wounds of Childhood Trauma? Neuropsychopharmacol. 2017. 42. 99-114. https://doi.org/10.1038/npp.2016.198.
3. Малахов В.О., Монастирський В.О. Сучасні уявлення про імунонейроендокринну систему в нормі та при патології. Новости медицины и фармации. 2010. 11–12 (331–332). http://www.mif-ua.com/archive/issue-12864.
4. Боярчук О.Д. Біохімія стресу. Луганськ: ЛНУ імені Тараса Шевченка, 2013. 177 с.
5. Чумаченко О.Ю., Редька О.Г. Спорт та стрес. Миколаїв: МНУ, 2019. 210 с.
6. Miller A.H., Maletic V., Raison C.L. Inflammation and its discontents: the role of cytokines in the pathophysiology of major depression. Biol. Psychiatry. 2009 May 1. 65(9). 732-41. doi: 10.1016/j.biopsych.2008.11.029. Epub 2009 Jan 15. PMID: 19150053; PMCID: PMC2680424.
7. ESC 2021 Guidelines on cardiovascular disease prevention in clinical practice. https://akru.org/esc.php
8. Рекомендації ESC із профілактики серцево-судинних захворювань. Здоров’я України. 2021. № 20. 513. https://health-ua.com/article/68120-rekomendatc-ESC-2021-zproflaktiki-sertcevosudinnih-zahvoryuvan.
9. Remch М. et al. Post-Traumatic Stress Disorder and Cardiovascular Diseases. A Cohort Study of Men and Women Involved in Cleaning the Debris of the World Trade Center Complex. Circulation: Cardiovascular Quality and Outcomes. 2018. 11. e004572. doi.org/10.1161/CIRCOUTCOMES.117.004572.
10. Стабільна ішемічна хвороба серця: Клінічна настанова, заснована на доказах. https://www.dec.gov.ua/wp-ontent/uploads/2021/12/2021_10_26_kn_stabilna-ihs.pdf.
11. Beristianos M.,Yaffe K., Cohen B., Byers A. PTSD and Risk of Incident Cardiovascular Disease in Aging Veterans. The American journal of geriatric psychiatry: official journal of the American Association for Geriatric Psychiatry. 2014. 24. 10.1016/j.jagp.2014.12.003.
12. Moser D. The Rust of Life: Impact of Anxiety on Cardiac Patients. American journal of critical care: an official publication. American Association of Critical-Care Nurses. 2007. 16. 361-9. 10.4037/ajcc2007.16.4.361.
13. Wadhera R.K., Shen C., Gondi S., Chen S., Kazi D.S., Yeh R.W. Cardiovascular Deaths During the COVID-19 Pandemic in the United States. J. Am. Coll. Cardiol. 2021 Jan 19. 77(2). 159-169. doi: 10.1016/j.jacc.2020.10.055. PMID: 33446309; PMCID: PMC7800141.
14. Nasrallah Y.A. During a viral pandemic anxienty is endemic: The psychiatric aspects of COVID-19. Current Psychiatry. 2020. 19(4). E3-E5. https://cdn.mdedge.com/files/s3fs-public/CP01904e3.PDF.
15. Rogers J. P. et al. Psychiatric and neuropsychiatric presentations associated with severe coronavirus infections: a systematic review and meta-analysis with comparison to the COVID-19 pandemic. Lancet Psychiatry. 2020 Jul. 7(7). 611-627. doi: 10.1016/S2215-0366(20)30203-0. Epub 2020 May 18. PMID: 32437679; PMCID: PMC7234781.
16. Glenn N. L. et al. Psychological Health, Well-Being, and the Mind-Heart-Body Connection: A Scientific Statement From the American Heart Association. Circulation. 2021. 143(10). e763-e783. doi: 10.1161/CIR.0000000000000947.
17. Wu Cho-Kai et al. Anti-anxiety drugs use and cardiovascular outcomes in patients with myocardial infarction: A national wide assessment. Atherosclerosis. 2014. 235. 496-502. doi: 10.1016/j.atherosclerosis.2014.05.918.
18. Fontaine R., Boisvert D. Psychophysiological disorders in anxious patients: hypertension and hypotension. Psychother. Psychosom. 1982. 38(1). 165-72. doi: 10.1159/000287624. PMID: 7146263.
19. Mabadeje A.F., Adebayo G.I. Comparative effects of labetalol and bromazepam on ambulatory blood pressure of Nigerians with labile and stress hypertension. Clin. Exp. Hypertens. A. 1989. 11 Suppl. 1. 441-7. doi: 10.3109/10641968909045452. PMID: 2568202.
20. Matsuo H., Watanabe S., Ishiguro M., Arai M., Sugiyama A., Matsuno Y. et al. The efficacy of additive use of etizolam in patients with essential hypertension and unspecified complaints. Int. J. Clin. Pharmacol. Ther. Toxicol. 1992 Feb. 30(2). 51-6. PMID: 1551746.
21. Grossman E., Nadler M., Sharabi Y., Thaler M., Shachar A., Shamiss A. Antianxiety treatment in patients with excessive hypertension. Am. J. Hypertens. 2005 Sep. 18 (9 Pt 1). 1174-7. doi: 10.1016/j.amjhyper.2005.03.728.
22. Gabba M., Salinaro F., Mussinelli R., Boldrini M., Raimondi A., Belotti C. et al. [Op.7a.06] Treating hypertensive crises between guidelines and real-world: an anti-hypertensive role of anti-anxiety drugs? Journal of Hypertension. 2016. Vol. 34. Р. e83. doi: 10.1097/01.hjh.0000491551.02246.96.
23. Starcevic V. Representation of Benzodiazepines in Treatment Guidelines: The Paradox of Undesirable Objectivity. Psychother Psychosom. 2022. 91. 295-299. doi: 10.1159/000524772.
24. Інструкція для медичного застосування препарату Гідазепам IC®.
25. Коваленко В.М., Корнацький В.М. Стан здоров’я народу України та медичної допомоги третинного рівня. Київ: Коломішин В.Ю., 2019. 224 с.
26. Сапольски Р. Психология стресса. 3-е изд. СПб.: Питер, 2015. 480 с.: ил.
27. Рекомендації МОЗ з психологічної допомоги. 27.02.2022. https://www.kmu.gov.ua/news/rekomendaciyi-moz-z-psihologichnoyi-dopomogi.
28. Поширені психічні розлади в дорослого населення: Рекомендації для України (MH4U). Львів, 2021. 95 с. https://www.mh4u.in.ua/wp-content/uploads/2021/06/nice-guidelines-rekomendacziyi-dlya-ukrayiny-kviten-2021.pdf
29. Інструкція для медичного застосування препарату Мебікар I.C.
30. Інструкція для медичного застосування препарату Нообут IC.
31. Амосова Е.Н. та ін. Лечение «мягкой» артериальной гипертензии: не только антигипертензивные препараты. Укр. терапевтичний журнал. 2010. № 1. С. 84-87.
32. Гринів О.І. Корекція хронічного психоемоційного напруження та стану вазодилатаційного резерву в пацієнтів з АГ. Південноукраїнський медичний науковий журнал. 2018. 20. 26-29.
33. Середюк Л.В. та ін. Ефективність застосування мебікару в корекції психоемоційного фону у хворих на стабільну ІХС з постійною формою фібриляції передсердь. Український терапевтичний журнал. 2019. № 2. С. 52-67.
34. Гирина О.Н. Применение дневного транквилизатора Адаптол в комплексной терапии пациентов высокого кардиоваскулярного риска: целесообразность, эффективность и безопасность. Український терапевтичний журнал. 2010. № 1. С. 125-130.
35. Катеренчук О.І. Особливості вегетативної реактивності в пацієнтів із серцевою недостатністю ішемічного генезу та можливість її корекції мебікаром. Матеріали XVII Національного конгресу кардіологів України. Київ, 2016. Український кардіологічний журнал. 2016. Додаток 3. С. 192.
36. Михайловська Н.С. та ін. Медикаментозна корекція вегетативних і психосоматичних порушень у хворих з ІХС із супутнім метаболічним синдромом. Кардиология: от науки к практике. 2018. № 1. С. 41-51.
37. Pernille Fevejle Cromhout et al. Exploring the use of psychotropic medication in cardiac patients with and without anxiety and its association with 1-year mortality. European Journal of Cardiovascular Nursing. 2022. Vol. 21. Issue 6. P. 612- 619. https://doi.org/10.1093/eurjcn/zvab111.
38. Сидорова Н. M. Ліки від страху: аналітичний огляд літератури. Сучасні аспекти військової медицини. 2021. 28-2. С. 173-188.
39. Кутько И.И. и др. Дистресс вооруженного конфликта. Новости медицины и фармации. 2014. № 16. С. 16-20.
40. Загуровский В.М. Стресс и его последствия. Медицина неотложных состояний. 2014. № 7. С. 11-23.
41. Чабан О.С., Франкова И.А. Современные тенденции в диагностике и лечении посттравматического стрессового расстройства. НейроNews. 2015. № 2. С. 8-18.
42. Чабан О.С. Стрес. Здоров’я України. 2017. № 1(40). С. 25-27.
43. Долішня Н. Тривога і депресія. Новости медицины и фармации. 2015. № 556. С. 7-11.
44. Практическое руководство по ведению пациентов с тревожными расстройствами, AMS-MHO. НейроNews. 2015. № 8. С. 45-58.
45. Настанова щодо скринінгу, діагностики та лікування депресії у дорослих пацієнтів та осіб підліткового віку (США). НейроNEWS. 2018. № 1. С. 46-52.
46. Foldes-Busque G., Dionne C.E., Turcotte S. et al. Epidemiology and prognostic implications of panic disorder and ge-neralized anxiety disorder in patients with coronary artery disease: rationale and design for a longitudinal cohort study. BMC Cardiovasc. Disord. 2021. 21. 26. https://doi.org/10.1186/s12872-021-01848-3.
47. Moser D.K. “The rust of life”: impact of anxiety on cardiac patients. Am. J. Crit. Care. 2007 Jul. 16(4). 361-9. PMID: 17595368; PMCID: PMC2668571.
48. Molinari E., Parati G., Compare A. Clinical Psychology and Heart Disease. 2006. doi: 10.1007/978-88-470-0378-1.
49. Berg S.K., Thorup C.B., Borregaard B., Christensen A.V., Thrysoee L., Rasmussen T.B., Ekholm O., Juel K., Vamosi M. Patient-reported outcomes are independent predictors of one-year mortality and cardiac events across cardiac diagnoses: Findings from the national DenHeart survey. Eur. J. Prev. Cardiol. 2019 Apr. 26(6). 624-637. doi: 10.1177/2047487318769766. Epub 2018 Apr 11. PMID: 29638142.
50. Turner J.H., Neylan T.C., Schiller N.B., Li Y., Cohen B.E. Objective evidence of myocardial ischemia in patients with posttraumatic stress disorder. Biol. Psychiatry. 2013 Dec 1. 74(11). 861-6. doi: 10.1016/j.biopsych.2013.07.012. Epub 2013 Aug 23. PMID: 23978403; PMCID: PMC4005370.
51. Boscarino J.A., Chang J. Electrocardiogram abnormalities among men with stress-related psychiatric disorders: implications for coronary heart disease and clinical research. Ann. Behav. Med. 1999. 21(3). 227-34. doi: 10.1007/BF02884839. PMID: 10626030.
52. Бурчинский С.Г. Проблема безпеки фармакотерапії афективних розладів: нові можливості. Укр. медичний часопис. 2022. 1–2 (147–148). С. 12-15. DOI: 10.32471/umj.1680-3051.147.225019.
53. National Collaborating Centre for Mental Health, National Collaborating Centre for Primary Care. Generalised anxiety disorder and panic disorder (with or without agoraphobia) in adults. Management in primary, secondary and community care. London, 2011.
54. Рекомендации по диагностике и лечению пациентов с тревожным расстройством (NICE). НейроNews. 2013. № 8. С. 35-47.
55. Рекомендации по диагностике и лечению тревожных расстройств (Германия). НейроNews. 2014. № 8. С. 51-56.
56. Бурчинский С.Г. Возможности фармакотерапевтической коррекции тревожных расстройств. НейроNews. 2015. № 2. С. 44-46.
57. Пішель В.Я., Полив’яна М.Ю. Проблемні питання ПТСР. НейроNEWS. 2016. № 7. С. 32-34.
58. Орос М.М., Сабовчик А.Я. Панічний розлад: сучасні погляди на лікування. Укр. медичний часопис. 2019. 2(130). Т. 1. С. 57-59.
59. Jakubovski E. et al. Systematic review and meta-analysis: dose-response curve of SSRIs and SNRIs in anxiety disorders. Depress Anxiety. 2019. 36(3). 198-212.
60. Клінічні протоколи надання медичної допомоги дорослим пацієнтам, які страждають на психічні розлади. Наказ МОЗ України № 59 від 05.02.2007.
61. Starcevic V. Anxiety disorders in adults: a clinical guide. Oxford: Oxford University Press, 2009.
62. Bhatt N.V. et al. Anxiety Disorders. 2019. https://emedicine.medscape.com/article/286227-overview.
63. Горбунова А.А., Колюцкая Е.В. Паническое расстройство и аффективная патология. Новости медицины и фармации. 2015. № 556. С. 12-16.
64. Дюкова Г.М. Панические расстройства. Новости медицины и фармации. 2013. № 458. С. 13-16.
65. Imai H. et al. Azapirones versus placebo for panic disorder in adults. Cochrane Database Syst. Rev. 2014. 9. CD010828.
66. Bandelow B. et al. Treatment of anxiety disorders. Dialogues Clin. Neurosci. 2017. 19(2). 93-107.
67. Ströhle А. et al. The diagnosis and treatment of anxiety disorders. Deutsches Ärzteblatt International. 2018. 115. 611-20.
68. de Moraes Costa G., Ziegelmann P.K., Zanatta F.B., Martins C.C., de Moraes Costa P., Mello C.F. Efficacy, acceptability, and tolerability of antidepressants for sleep quality disturbances in post-traumatic stress disorder: A systematic review and network meta-analysis. Prog. Neuropsychopharmacol. Biol. Psychiatry. 2022 Jul 13. 117. 110557. doi: 10.1016/j.pnpbp.2022.110557. Epub 2022 Apr 6. PMID: 35395322.
69. Долженко М. М., Лучинська Ю.О. Мелатонін при гіпертонічній хворобі. webcardio.org. 15.07.2022. https://www.webcardio.org/melatonin-pry-ghipertonichnij-khvorobi.aspx.
70. Khan M.S., Aouad R. The Effects of Insomnia and Sleep Loss on Cardiovascular Disease. Sleep Med. Clin. 2022. 17(2). 193-203. doi: 10.1016/j.jsmc.2022.02.008. PMID: 35659073.
71. Wang C., Hu J. Influence of the Interaction Between Depressive Symptoms and Sleep Disorders on Cardiovascular Di-seases Occurrence. Int. J. Gen. Med. 2021. 14. 10327-10335. https://doi.org/10.2147/IJGM.S334894.
72. Kadier K. et al. Association of sleep-related disorders with cardiovascular disease among adults in the United States: A cross-sectional study based on national health and nutrition examination survey 2005–2008. Frontiers in Cardiovascular Medicine. 2022. https://doi.org/10.3389/fcvm.2022.954238.
73. Lars E. Laugsand et al. Insomnia and the risk of incident heart failure: a population study. European Heart Journal. 2014. Vol. 35. Issue 21. 1. P. 1382-1393. https://doi.org/10.1093/eurheartj/eht019.
74. Lars Aastebøl Frøjd et al. Insomnia as a predictor of recurrent cardiovascular events in patients with coronary heart disease. SLEEP Advances. 2022. Vol. 3. Issue 1. zpac007. https://doi.org/10.1093/sleepadvances/zpac007.
75. Riemann D. et al. European guideline for the diagnosis and treatment of insomnia. J. Sleep Res. 2017. 26. 675-700. https://doi.org/10.1111/jsr.12594.
76. Інструкція для медичного застосування препарату Левана IC.
77. Міщенко Т.С. та ін. Хронічна інсомнія і методи її корекції. Міжнародний неврологічний журнал. 2021. Т. 17. № 18. С. 16-25. https://inj.zaslavsky.com.ua/index.php/journal/article/view/916.
78. Brower K.J. et al. A randomized double-blind pilot trial of gabapentin versus placebo to treat alcohol dependence and comorbid insomnia. Alcohol Clin. Exp. Res. 2008. Vol. 32. № 8. P. 1429-1438.
79. Хаустова О.О. Розлади сну у осіб літнього віку. НейроNEWS. 2016. № 2-1. https://neuronews.com.ua/ua/archive/2016/2-1/article-1660/rozladi-snu-u-osib-litnogo-viku#gsc.tab=0.
80. Krystal A.D. Pharmacologic treatment of insomnia: other medications. In: Kryger M.H., Roth T., Dement W.C. (eds.) Principles and Practice of Sleep Medicine. 6th ed. Philadelphia: Elsevie, 2016. P. 842-854.
81. Schwab R.J. Підхід до пацієнта з розладом сну або неспання. 2022. MSD Довідник. http://tiny.cc/o232vz.

/31.jpg)