Вступ: диференціація окремих β-блокаторів
У класі β-блокаторів спостерігаються різні терапевтичні механізми. Аналог β-блокатора, пропранолол, і нещодавно розроблені засоби, такі як буциндолол, карведилол, лабеталол, окспренолол, надолол, піндолол, соталол і тимолол, клінічно не відрізняються стосовно селективності щодо β1- і β2-адренорецепторів [1–4]. Навпаки, інші β-блокатори (наприклад, ацебутолол, атенолол, бетаксолол, бісопролол, целіпролол, есмолол, метопролол, небіволол і ксамотерол) більш-менш селективно блокують β1-адренорецептори, що знаходяться головним чином у серці, але не блокують β2-рецептори, що розширюють гладку мускулатуру судин і дихальних шляхів [1–4]. Деякі β-блокатори (наприклад, целіпролол, піндолол, ацебутолол і окспренолол) викликають активацію β1-рецепторів («внутрішня симпатоміметична активність» (ВСА)), яка, як правило, обмежує зниження продуктивності міокарда і частоти серцевих скорочень під час β-блокади і знижує потенціал звуження периферичних судин, спрямований до периферичних β2-адренорецепторів [5]. Однак наявність ВСА порівняно її відсутністю не має клінічної користі у хворих на ішемічну хворобу серця (ІХС) [6] або серцеву недостатність зі зниженою фракцією викиду лівого шлуночка (СН ЗФВ ЛШ) [7].
Іншими судинорозширювальними механізмами, які експресуються окремими β-блокаторами, є додаткова блокада α-адренорецепторів (буциндолол, карведилол, целіпролол, лабеталол) [1, 5, 8, 9] або стимулювання вивільнення оксиду азоту (NO) небівололом унаслідок активації β3-адренорецепторів небівололом [10–12]. Ці групи β-блокаторів є першим поколінням (неселективні), другим поколінням (кардіо/β1-селективні) і третім поколінням (з додатковими судинорозширювальними властивостями) [13].
Мета
Різниця між окремими β-блокаторами з точки зору механізмів, селективності та фармакокінетичних властивостей (серед іншого) як полегшує, так і ускладнює розробку індивідуалізованих схем для хворих на серцево-судинні захворювання [14, 15]. Мета нашого огляду — порівняти терапевтичні властивості кардіоселективних β-блокаторів другого і третього поколінь у хворих на артеріальну гіпертензію, ІХС і СН ЗФВ ЛШ. Важливо наголосити, що засоби з нижчою β1-селективністю починають блокувати β2-адренорецептори при більш високих дозах (наприклад, у європейській короткій характеристиці атенололу в цьому контексті зазначено, що «селективність зменшується зі збільшенням дози»). Відповідно ми обрали для цього два найбільш високоселективних β-блокатори — бісопролол (друге покоління) і небіволол (третє покоління).
Методи
Огляд заснований на пошуку літературних наукових статей за наявністю слів «бісопролол» або «небіволол» у назві. Пріоритет віддається включенню рандомізованих досліджень з активним препаратом порівняння з огляду на велику базу даних літератури щодо β-блокаторів (включено плацебо-контрольовані дослідження результатів, оскільки відсутні прямі дослідження порівняння, засновані на клінічних результатах). У деяких випадках також використовуються посилання, подані в цих статтях. У кожному розділі спочатку будуть розглянуті доступні прямі дослідження порівняння цих засобів, а потім рандомізовані контрольовані дослідження порівняння бісопрололу і небівололу, як зазначено вище, зі структурою кожного підрозділу згідно з опублікованими доказами. Інші докази клінічних досліджень бісопрололу або небівололу подані з меншим пріоритетом, що вказує на загальні терапевтичні властивості цих β-блокаторів.
Властивості бісопрололу і небівололу
Відносна селективність щодо β1-блокаторів та інших адренорецепторів
Селективність щодо β1-адренорецепторів стала ключовою властивістю в класі β-блокаторів, як описано вище й узагальнено в табл. 1 [16–45]. Дослідження селективності бісопрололу й небівололу щодо β1- і β2-адренорецепторів дали суперечливі результати. Небіволол приблизно в три рази більш селективний, ніж бісопролол, щодо β1- порівняно з β2-адренорецепторами в міокарді людини [46, 47]; подібні результати були отримані в дослідженні за участю людей, у якому вимірювали вплив селективних β-блокаторів на фізіологічні реакції щодо агоніста β2-адренорецепторів тербуталіну (обидва були більш β1-селективними, ніж атенолол) [48]. Однак в інших дослідженнях міокарда людини або культивованих клітин, що експресують β1- або β2-адренорецептори людини, було виявлено, що бісопролол був більш β1-селективним, ніж небіволол [49]. Експериментальне дослідження показало, що бісопролол і ксамотерол були приблизно в 14 разів більш селективними щодо β1-адренорецепторів людини, ніж щодо β2-адренорецепторів, порівняно з нижчим співвідношенням для атенололу (~ у 5 разів), ацебутололу і метопрололу (~ у 2 рази) [50].
/50.jpg)
У серці також містяться β3-адренорецептори. Дослідження зв’язування показали, що бісопролол був у 31 раз більш селективним блокатором β1-адренорецепторів порівняно з β3-адренорецепторами [51]. Небіволол є частковим агоністом β3-рецепторів (див. нижче).
Внутрішня симпатоміметична активність
Деякі β-блокатори демонструють внутрішню симпатоміметичну активність, тобто часткову агоністичну активність щодо різних β-адренорецепторів [52–55]. Ні бісопролол, ні небіволол не мають внутрішньої симпатоміметичної активності щодо β1- або β2-адренорецепторів [52–55].
Небіволол (на відміну від бісопрололу) виявляє внутрішню симпатоміметичну активність щодо β3-адренорецепторів, пов’язаних із судинорозширювальною дією на фоні збільшення вироблення оксиду азоту [12, 56, 57]. Ця дія може пояснити менший ефект небівололу щодо зниження частоти серцевих скорочень порівняно з бісопрололом (див. нижче) [51, 55, 56, 58].
Зворотний агонізм β1-адренорецепторів
Конститутивна активність (певний рівень активації рецептора за відсутності його специфічного агоніста) спостерігалась для β1-адрено-рецепторів [59]. Зворотний β1-агоніст може пригнічувати активацію рецептора до рівня, нижчого за той, що спостерігається за відсутності агоніста [59]. І бісопролол, і небіволол є зворотними агоністами β1-рецепторів (як і більшість блокаторів β1-адренорецепторів [49, 56]); однак рівень зворотного агонізму цих засобів є подібним, а отже, не впливає на різницю в їхній терапевтичній дії [49]. Зворотний агонізм пов’язаний із запобіганням десенсибілізації рецепторів, а отже, збільшенням кількості β1-адренорецепторів [56]. Хоча це є теоретичною перевагою при СН ЗФВ ЛШ, можливість різних β-блокаторів підвищувати кількість β1-адренорецепторів не була пов’язана з різницею в сприятливому впливі на серцеву діяльність [56].
Інші симпатолітичні дії
β-блокатори є симпатолітичними засобами, оскільки вони пригнічують дію симпатичних ней-ромедіаторів на рівні β-адренорецепторів [51–55]. Можуть діяти додаткові механізми, що включають блокаду α-адренорецепторів (лабеталол, карведилол), модуляцію функції барорефлексу, вплив на пресинаптичні β1-адренорецептори, які модулюють вивільнення симпатичних нейромедіаторів, або обмеження симпатичного відтоку з мозку (для ліпофільних засобів, які проникають через гематоенцефалічний бар’єр) [52–55].
Фармакокінетичні властивості
У табл. 2 узагальнені фармакокінетичні властивості бісопрололу і небівололу [12, 60–63]. Період напіввиведення (T1/2) обох лікарських засобів відповідає дозуванню один раз на добу, і вони всмоктуються відносно швидко. Небіволол, на відміну від бісопрололу, піддається активному, але змінному пресистемному метаболізму з можливістю фармакокінетичної взаємодії з іншими інгібіторами CYP450 2D6, зазначеними в європейській короткій характеристиці лікарського засобу для небівололу. Різниця в швидкості метаболізму небівололу в окремих осіб впливає на фармакокінетичні властивості небівололу з більшим часом досягнення максимальної концентрації лікарського засобу в плазмі (Tmax) і довшим T1/2. Крім того, спостерігається приблизно 8-кратна різниця в біодоступності й приблизно 15-кратна різниця в експозиції небівололу між активними і повільними метаболізаторами лікарського засобу, а спосіб виведення відрізняється залежно від фенотипу метаболізатора. Рівень загальних β1-блокаторів між цими фенотипами метаболізаторів після введення небівололу був подібний, однак через більшу кількість активних метаболітів небівололу в пацієнтів зі швидким метаболізмом.
/52.jpg)
Небіволол майже повністю зв’язується з білками, бісопролол — приблизно на 30 %.
Було виявлено, що варіації ниркової функції сприяють варіабельності концентрацій бісопрололу в плазмі при пероральному введенні в популяції хворих на цукровий діабет, і це може бути корисним для вимірювання ниркової функції для підтримки індивідуалізованого дозування бісопрололу [64]. В іншому дослідженні було проаналізовано 31 коваріату і виявлено, що лише вищі дози бісопрололу й куріння сигарет (вони індукують ферменти в системі цитохрому Р450) впливають на фармакокінетичні властивості бісопрололу [65].
Отже, фармакокінетичний профіль небівололу є більш складним, ніж профіль бісопрололу. Нещодавнє дослідження показало, що вплив небівололу (а також метопрололу, пропранололу і карведилолу) у фармакокінетичних дослідженнях був більш змінним, ніж вплив бісопрололу (а також атенололу, соталолу, лабеталолу, надололу і піндололу), на основі коефіцієнта варіації площі під кривою залежності «концентрація — час» після перорального введення цих лікарських засобів [66].
Загальногеномні дослідження асоціацій (ЗГДА) продемонстрували зв’язок між впливом β-блокаторів на артеріальний тиск (АТ) і однонуклеотидними поліморфізмами (ОНП) у гені BST1 або PTPRD, хоча не було припущень щодо різниці між антигіпертензивною ефективністю окремих β-адреноблокаторів залежно від наявності або відсутності цієї мутації [67, 68]. Також було висловлено припущення, що загальні варіації ферменту CYP2D6 можуть значно змінювати ефективність і безпеку метопрололу в пацієнтів у певних географічних регіонах. Можна очікувати вплив інших β-блокаторів, які піддаються активному метаболізму системою цитохрому Р450 [69]. В одному ЗГДА було виявлено ОНП у трьох генах, які могли модулювати антигіпертензивний ефект на бісопролол, на відміну від атенололу, хоча функціональна значущість цього на сьогодні незрозуміла [70]. В інших дослідженнях ОНП (Arg189Gly) впливав на реакцію частоти серцевих скорочень на карведилол, але не бісопролол [71].
Бісопролол і небіволол при серцевій недостатності
Рандомізовані прямі дослідження порівняння і метааналізи
У рандомізованому перехресному дослідженні оцінювалось двомісячне лікування карведилолом, бісопрололом і небівололом у 61 хворого на СН ЗФВ ЛШ середнього ступеня тяжкості [72]. Спостерігалась певна різниця в групах перфузії кисню і відповіді на гіпоксію, у яких, на думку авторів, можна було б розглянути індивідуалізоване лікування пацієнтів, але не спостерігалось суттєвої різниці між методами лікування за функціональною класифікацією хронічної серцевої недостатності Нью-Йоркської асоціації кардіологів (NYHA), балами Міннесотського опитувальника якості життя у хворих на хронічну серцеву недостатність, ниркової функції, рівнями натрійуретичного пептиду B-типу, результатами ехокардіографії або механікою зовнішнього дихання. Одне невелике дослідження показало, що двотижневе лікування небівололом поліпшило функцію лівого шлуночка порівняно з бісопрололом, целіпрололом або карведилолом у здорових добровольців, що може бути пов’язаним з поліпшенням діастолічної функції та податливості міокарда, хоча необхідність цього дослідження для хворих на СН ЗФВ ЛШ незрозуміла [73].
Метааналіз мережевих досліджень результатів при СН ЗФВ ЛШ [74] включав дослідження CIBIS з використанням бісопрололу [75–77] і дослідження SENIORS з використанням небівололу [78] (інформацію про ці дослідження див. нижче). Не спостерігалось істотної різниці між бісопрололом і небівололом щодо впливу на загальну летальність, смертність від серцево-судинних захворювань або раптову смерть (рис. 1).
Інші рандомізовані дослідження результатів
Жодне рандомізоване пряме дослідження результатів не порівнювало бісопролол і небіволол у хворих на СН ЗФВ ЛШ. Відповідно в цьому розділі розглядаються дослідження результатів, які проводилися окремо із цими засобами.
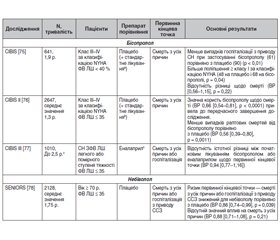
Три рандомізовані дослідження результатів [75–77] оцінювали бісопролол порівняно з плацебо (плюс стандарт лікування) у хворих на СН ЗФВ ЛШ (табл. 3). Перше з них, дослідження бісопрололу при серцевій недостатності (CIBIS), продемонструвало поліпшення симптомів у пацієнтів, рандомізованих у групу бісопрололу і плацебо, але в невеликій популяції пацієнтів не спостерігалось поліпшення клінічних результатів [75]. У дослідження CIBIS II була включена більша популяція, але це дослідження було завершено передчасно після значного зниження частоти смерті (основний результат дослідження) в групі бісопрололу й плацебо [76]. Ретроспективні аналізи цих досліджень показали, що переваги в результатах були подібними незалежно від наявності в пацієнтів цукрового діабету, ниркової недостатності або симптомів класу IV за класифікацією NYHA, похилого віку або застосування наперстянки, аміодарону або антагоністів альдостерону [79].
/53.jpg)
Третє дослідження, CIBIS III, було розроблено для оцінки ефективності початкової терапії бісопрололом, а подальше додавання еналаприлу було більш ефективним, ніж початкова терапія еналаприлом і подальше додавання бісопрололу [77]. Не спостерігалось різниці в клінічних результатах між обома методами досягнення цієї експериментально доведеної комбінації. Однак ретроспективний аналіз дослідження CIBIS III показав, що титрування будь-якої терапії принаймні до напівмаксимальної дози було більш ефективним для лікування, яке було призначено першим, що свідчить про необхідність оптимізації терапії серцевої недостатності [80].
Дослідження впливу застосування небівололу на результати й повторну госпіталізацію в людей похилого віку із серцевою недостатністю (SENIORS) оцінювало вплив небівололу в пацієнтів літнього віку із серцевою недостатністю (табл. 3) [78, 81]. Рандомізація в групи небівололу і плацебо протягом 21 місяця значно знизила ризик первинної комбінованої кінцевої точки (смерть з усіх причин або госпіталізація з приводу серцево-судинних захворювань) порівняно з плацебо, але цей ефект не залежав від статі, віку або ФВ ЛШ. Однак суттєвого впливу на смерть з усіх причин, вторинну кінцеву точку, не спостерігалось. Субаналізи SENIORS показали, що небіволол однаково поліпшував клінічні результати у хворих з порушенням функції нирок середнього ступеня тяжкості та без нього [81] або з низьким систолічним АТ на вихідному рівні, що є фактором ризику несприятливих клінічних результатів у цій популяції [82].
Бісопролол і небіволол при ішемічній хворобі серця
Рандомізовані дослідження результатів
У жодному дослідженні результатів не порівнювали бісопролол і небіволол безпосередньо у хворих на ІХС. У дослідженні загального ішемічного навантаження бісопрололу 330 хворих на ІХС (зі стабільною стенокардією, позитивним результатом тесту з фізичним навантаженням і при ≥ 2 транзиторних епізодах ішемії міокарда протягом 48-годинної ЕКГ) було рандомізовано в групу бісопрололу або ніфедипіну [83, 84]. Бісопролол зменшив кількість епізодів ішемії порівняно з ніфедипіном через 4 тижні. Подальше спостереження через рік виявило нижчу частоту значних серцево-судинних ускладнень (ЗССУ; серцева і несерцева смерть, нефатальний гострий інфаркт міокарда, госпіталізація з приводу нестабільної стенокардії або реваскуляризації) у групі бісопрололу (22 %) і ніфедипіну (22 та 33 %, р = 0,03).
Інші рандомізовані дослідження
Рандомізоване дослідження показало, що лікування бісопрололом поліпшило виживання міокарда (оцінено за допомогою поглинання метокси-ізобутил-ізонітрилу, міченого Tc-99m) у хворих на стенокардію [85]. Рандомізовані дослідження показали, що ефективність бісопрололу в лікуванні нападів стенокардії порівнянна з ефективністю атенололу [86–90] або верапамілу [91].
Підйом сегмента ST на ЕКГ був значно нижчим після рандомізації в групу небівололу та атенололу у хворих на підтверджену ІХС, які проходили тест із фізичним навантаженням у рамках рандомізованого дослідження [92]. Однорічне рандомізоване дослідження оцінювало небіволол порівняно з метопрололом і карведилолом у 172 хворих на гострий ІМ на фоні дисфункції лівого шлуночка [93]. Загальний результат нефатального інфаркту міокарда, серцево-судинної смерті, госпіталізації з приводу нестабільної стенокардії або серцевої недостатності, інсульту або реваскуляризації був значно нижчим у групі небівололу і метопрололу (14,5 і 31,5 %; p = 0,03), без значущої (p > 0,05) тенденції щодо користі небівололу й карведилолу (14,5 і 20,3 %), карведилолу і метопрололу (20,3 і 31,5 %; p > 0,05).
Бісопролол і небіволол при артеріальній гіпертензії
Прямі дослідження порівняння і метааналізи
Подібні величини зниження артеріального тиску спостерігались у пацієнтів (N = 273), рандомізованих у групу бісопрололу (середня зміна –16/–7 мм рт.ст.) або небівололу (середня зміна –16/–6 мм рт.ст.) протягом 12 тижнів у рандомізованому простому сліпому дослідженні (дослідження NEBIS) [59]. В іншому невеликому рандомізованому перехресному дослідженні порівнювали вплив небівололу і бісопрололу на функцію ендотелію у 25 хворих на артеріальну гіпертензію [94]. Вплив на функцію ендотелію (вазодилатація передпліччя, викликана потоком) був вищим у групі небівололу, що узгоджується з його додатковим механізмом посиленого синтезу NO в судинній системі (див. вище). Однак це не призвело до статистично значущої різниці між групами щодо впливу на АТ: середній АТ знизився з 152/99 мм рт.ст. на вихідному рівні до 132/82 мм рт.ст. для небівололу і до 130/83 мм рт.ст. для бісопрололу. Клінічні результати після однорічного лікування оцінювали в іншому прямому дослідженні порівняння бісопрололу й небівололу, проведеному за участю 1056 хворих на артеріальну гіпертензію [95]. Рандомізація в групу небівололу і бісопрололу була пов’язана з невеликими й статистично незначущими різницями між групами щодо загальної смертності (9,8 і 11,5 %), смертності від серцево-судинних ускладнень (5,4 і 7,0 %), госпіталізації з будь-якої причини (14,4 і 16,3 %) і госпіталізації з приводу серцево-судинних захворювань (9,8 і 12,1 %).
Метааналіз показав, що частка пацієнтів, які досягли цільових показників АТ, була подібною для небівололу та інших β-блокаторів [49]. У цьому аналізі статистично вірогідно вищий відсоток пацієнтів, які досягли цих цілей, спостерігався для небівололу порівняно з інгібіторами АПФ і БРА [96].
Зниження частоти серцевих скорочень у стані спокою є важливим показником поліпшення прогнозу в пацієнтів із ризиком несприятливих серцево-судинних результатів, які отримують кардіоселективні β-блокатори [97]. Прямі докази впливу цих β-блокаторів на частоту серцевих скорочень відсутні. Однак у рандомізованому дослідженні NEBIS спостерігалася сильна тенденція (p = 0,06) до більшого зниження частоти серцевих скорочень через 3 години після введення бісопрололу (середня зміна –24 уд/хв) порівняно з небівололом (середня зміна –15 уд/хв) [58].
Обмеження цих прямих досліджень порівняння у хворих на артеріальну гіпертензію включали відносно короткий термін (16 тижнів або менше) [58, 93] або невелику популяцію пацієнтів (25 або менше) [94]. Рандомізоване дослідження результатів, у якому порівнювали ці засоби, проводили в єдиному центрі з коротким терміном спостереження (один рік), а різниця в індексі маси тіла на вихідному рівні між групами могла певною мірою вплинути на результати [95]. Хворі на артеріальну гіпертензію потребують більш тривалих і ефективних досліджень порівняння бісопрололу і небівололу.
Метааналіз показав, що небіволол ефективно знижує АТ у різних вікових групах, хоча з дещо меншою ефективністю в пацієнтів похилого віку [20]. Небіволол також виявися ефективним у афроамериканців з артеріальною гіпертензією, які були ідентифіковані як популяція, що менше реагує на β-блокатори, ніж люди інших етнічних груп [136]. Клінічні фармакологічні дослідження показали, що небіволол поліпшував функцію великих [124, 137] або малих [138] артерій більше, ніж атенолол, незважаючи на подібний загальний вплив на АТ, що відповідає результатам клінічного дослідження порівняння з бісопрололом, описаним вище [58]. Однак такий ефект не спостерігався в рандомізованому дослідженні порівняння з використанням метопрололу [139]. Інше дослідження механізму дії показало, що небіволол, на відміну від метопрололу, знижував АТ у хворих на артеріальну гіпертензію з вегетативною недостатністю, станом, при якому організм реагує на NO [140].
Небіволол і бісопролол ефективні в комбінації з іншими антигіпертензивними засобами для лікування артеріальної гіпертензії, як і інші лікарські засоби, що застосовуються для цієї мети [141–146]. Повний звіт про такі дослідження виходить за рамки цього огляду.
Обговорення
Чим відрізняються β-блокатори другого і третього покоління?
Застосування як бісопрололу, так і небівололу для лікування СН ЗФВ ЛШ підтверджується результатами рандомізованих плацебо-контрольованих досліджень результатів (програма дослідження CIBIS для бісопрололу і дослідження SENIORS для небівололу). Ми не проводили прямих досліджень результатів цих лікарських засобів за цим (або будь-яким іншим) показанням, хоча в одному з таких досліджень було виявлено незначну різницю між ними з точки зору впливу на клінічно важливі й часто вимірювані параметри серцевої недостатності [72]. Мережевий метааналіз програми досліджень CIBIS і SENIORS не виявив жодних ознак клінічно або статистично значущої різниці в результатах серцевої недостатності між цими засобами (рис. 1) [76].
β-блокатори міцно закріпились у лікуванні СН ЗФВ ЛШ, і бісопролол, і небіволол (разом з карведилолом і метопрололом) є експериментально доведеними засобами для лікування в основних європейських настановах щодо лікування СН ЗФВ ЛШ [147], тоді як бісопролол належить до поширених лікарських засобів для лікування СН ЗФВ ЛШ у настановах США [148]. Подібним чином β-блокатори є рекомендованими засобами першої лінії при хронічній ІХС і після гострого коронарного синдрому в Європі [149–151] і США [152]. У цих настановах не вказано жодного окремого β-блокатора, тому ефективність β-блокаторів по суті розглядається як класовий ефект. Подібним чином у настановах щодо лікування артеріальної гіпертензії зазначено, що β-блокатори загалом знижують ризик ЗССУ [153], що узгоджується з висновком великого метааналізу про те, що величина зниження АТ сама по собі може бути основною рушійною силою в зниженні ризику ЗССУ [154]. У європейських настановах вказано, що ні бісопролол, ні небіволол на сьогодні не застосовуються в дослідженнях серцево-судинних результатів [151].
Отже, у цій статті ми по змозі зосередилися на доказах із рандомізованих досліджень результатів і не розглядали докази з реальної практики, які впливають на оцінку ефектів терапії під час стандартного лікування. Один аналіз з реальної практики, проведений за участю понад 7500 хворих на артеріальну гіпертензію, які отримували лікування протягом 14 років, виявив, що лікування бісопрололом було пов’язане зі зниженням частоти смертності порівняно з об’єднаними даними про інші β-блокатори (ВР 0,45 (95% ДІ 0,34–0,61)) або об’єднаними даними про терапію без β-блокаторів (ВР 0,50 (95% ДІ 0,38–0,66)) [155]. Більш детальний розгляд доказів з реальної практики у цій галузі був би цікавим питанням для подальшого огляду.
Прогалини в знаннях і питання, не вирішені в рамках дослідження
Єдине надійне порівняння впливу двох лікарських засобів на певне захворювання проводиться в рамках прямого рандомізованого клінічного дослідження. Ми провели лише одне невелике дослідження, у якому порівнювали бісопролол і небіволол при СН ЗФВ ЛШ [72], і не проводили таких досліджень у хворих на ІХС або артеріальну гіпертензію. Доказова база щодо поліпшення клінічних результатів при застосуванні бісопрололу й небівололу є найсильнішою у хворих на СН ЗФВ ЛШ, і потрібна додаткова інформація про вплив цих результатів на хворих з ІХС і особливо з артеріальною гіпертензією. Крім того, роль β-блокаторів при серцевій недостатності зі збереженою фракцією викиду залишається супе-
речливою: на сьогодні дані досліджень β-блокаторів у цих пацієнтів були суперечливими [156], хоча нещодавнє реєстраційне дослідження продемонструвало користь від цього підходу [157]. Потрібні подальші дослідження цих пацієнтів.
Висновки
Високий рівень селективності β1-адренорецеп-торів впливає на ефективність β-блокаторів у лікуванні артеріальної гіпертензії і серцево-судинних захворювань. Це буде особливо актуально за межами контрольованих клінічних досліджень, коли в пацієнтів можуть виникнути (або розвинутися із часом) супутні захворювання, такі як дисглікемія, обструктивне захворювання легень або еректильна дисфункція. Бісопролол і небіволол є висококардіоселективними β-блокаторами, що робить їх придатними для багатьох пацієнтів з такими супутніми захворюваннями порівняно з неселективними β-блокаторами (першого покоління). Небіволол, β-блокатор третього покоління, має додаткові судинорозширювальні дії, пов’язані з посиленням вивільнення NO у стінці судин, порівняно з бісопрололом, лікарським засобом другого покоління. Додаткова дія небівололу на вивільнення NO може лежати в основі повідомлень про поліпшення еректильної функції в пацієнтів, які отримували цей лікарський засіб. Наявні дані, узагальнені в цьому огляді, не надають доказів ані кращого впливу на клінічні результати СН ЗФВ ЛШ, ані більшого впливу на АТ при артеріальній гіпертензії для небівололу порівняно з бісопрололом, хоча прямі дослідження не проводились.
Конфлікт інтересів. Waleed AlHabeeb повідомляє про отримання гонорару від компаній Merck Serono Middle East FZ LTD, Novo Nordisk, Sanofi Aventis, Boehringer-ingelheim, Servier, крім поданої статті. Ahmed Adel Ibrahim Abdelsalam та Sanaa Mrabeti є співробітниками компанії Merck Serono Middle East FZ-LLC, філіалу Merck KGaA, Німеччина.
Оригінал статті надрукований у
Cardiovascular Drugs and Therapy. 2022. 36. 959-971.
https://doi.org/10.1007/s10557-021-07205-y
Список литературы
1. Andreka P., Aiyar N., Olson L.C. et al. Bucindolol displays intrinsic sympathomimetic activity in human myocardium. Circulation. 2002. 105. 2429-34.
2. Poirier L., Tobe S.W. Contemporary use of β-blockers: clinical relevance of subclassification. Can. J. Cardiol. 2014. 30 (5 Suppl.). S9-15.
3. MacCarthy E.P., Bloomfield S.S. Labetalol: a review of its pharmacology, pharmacokinetics, clinical uses and adverse effects. Pharmacotherapy. 1983. 3. 193-219.
4. Nawarskas J.J., Cheng-Lai A., Frishman W.H. Celiprolol: a unique selective adrenoceptor modulator. Cardiol. Rev. 2017. 25. 247-53.
5. National Institute for Health and Care Excellence. Beta-adrenoceptor blocking drugs. Overview. https://bnf.nice.org.uk/treatment-summary/beta-adrenoceptor-blocking-drugs.html.
6. Freemantle N., Cleland J., Young P., Mason J., Harrison J. Beta Blockade after myocardial infarction: systematic review and meta regression analysis. BMJ. 1999. 318. 1730-7.
7. Cruickshank J.M. Are we misunderstanding beta-blockers. Int. J. Cardiol. 2007. 120. 10-27.
8. Marwood J.F., Stokes G.S. Studies on the vasodilator actions of bucindolol in the rat. Clin. Exp. Pharmacol. Physiol. 1986. 13. 59-68.
9. Farzam K. Beta-blockers. Stat Pearls. https://www.statpearls.com/kb/viewarticle/18241.
10. Maffei A., Lembo G. Nitric oxide mechanisms of nebivolol. Ther. Adv. Cardiovasc. Dis. 2009. 3. 317-27.
11. Ritter J.M. Nebivolol: endothelium-mediated vasodilating effect. J. Cardiovasc. Pharmacol. 2001. 38 (Suppl. 3). S13-6.
12. Fongemie J., Felix-Getzik E. A review of nebivolol pharmacology and clinical evidence. Drugs. 2015. 75. 1349-71.
13. Stoschitzky K. Individual beta-blockers for individual patients. e-journal of the ESC Council for Cardiology Practice. 2008. 6. 15 Jan 2008. https://www.escardio.org/Journals/E-Journal-of-Cardiology-Practice/Volume-6/Individual-beta-blockers-for-individual-patients-Title-Individual-beta-blocke.
14. Koracevic G., Micic S., Stojanovic M. et al. Compelling indications should be listed for individual beta-blockers (due to diversity), not for the whole class [published online ahead of print, 2020 May 18]. Curr. Vasc. Pharmacol. 2021. 19. 343-46.
15. Sinagra G., Corrà U., Contini M. et al. Choosing among β-blockers in heart failure patients according to β-receptors’ location and functions in the cardiopulmonary system. Pharmacol. Res. 2020. 156. 104785.
16. Marshall A.J., Roberts C.J., Barritt D.W. Raynaud’s phenomenon as side effect of beta-blockers in hypertension. Br. Med. J. 1976. 1. 1498-9.
17. Fonseca V.A. Effects of beta-blockers on glucose and lipid metabolism. Curr. Med. Res. Opin. 2010. 26. 615-29.
18. Hirst J.A., Farmer A.J., Feakins B.G., Aronson J.K., Stevens R.J. Quantifying the effects of diuretics and β-adrenoceptor blockers on glycaemic control in diabetes mellitus — a systematic review and meta-analysis. Br. J. Clin. Pharmacol. 2015. 79. 733-43.
19. Van de Ven L.L., Van Leeuwen J.T., Smit A.J. The influence of chronic treatment with betablockade and angiotensin converting enzyme inhibition on the peripheral blood flow in hypertensive patients with and without concomitant intermittent claudication. A comparative cross-over trial. Vasa. 1994. 23. 357-62.
20. Germino F.W., Lin Y., Pejovic V., Bowen L. Efficacy and tolerability of nebivolol: does age matter? A retrospective analysis of three randomized, placebo-controlled trials in stage I-II hypertension. Ther. Adv. Cardiovasc. Dis. 2012. 6. 185-99.
21. Barron A.J., Zaman N., Cole G.D., Wensel R., Okonko D.O., Francis D.P. Systematic review of genuine versus spurious side-effects of beta-blockers in heart failure using placebo control: recommendations for patient information. Int. J. Cardiol. 2013. 168. 3572-9.
22. Shen L., Shah B.R., Reyes E.M. et al. Role of diuretics, β blockers, and statins in increasing the risk of diabetes in patients with impaired glucose tolerance: reanalysis of data from the NAVIGATOR study. BMJ. 2013. 347. f6745.
23. Dhakam Z., Yasmin, McEniery C.M., Burton T., Brown M.J., Wilkinson I.B. A comparison of atenolol and nebivolol in isolated systolic hypertension. J. Hypertens. 2008. 26. 351-6.
24. Wai B., Kearney L.G., Hare D.L., Ord M., Burrell L.M., Srivastava P.M. Beta blocker use in subjects with type 2 diabetes mellitus and systolic heart failure does not worsen glycaemic control. Cardiovasc. Diabetol. 2012. 11. 14.
25. Janka H.U., Ziegler A.G., Disselhoff G., Mehnert H. Influence of bisoprolol on blood glucose, glucosuria, and haemoglobin A1 in noninsulin-dependent diabetics. J. Cardiovasc. Pharmacol. 1986. 8 (Suppl. 11). S96-9.
26. Van Bortel L.M. Efficacy, tolerability and safety of nebivolol in patients with hypertension and diabetes: a post-marketing surveillance study. Eur. Rev. Med. Pharmacol. Sci. 2010. 14. 749-58.
27. Ayers K., Byrne L.M., DeMatteo A., Brown N.J. Differential effects of nebivolol and metoprolol on insulin sensitivity and plasminogen activator inhibitor in the metabolic syndrome. Hypertension. 2012. 59. 893-8.
28. Deedwania P., Shea J., Chen W., Brener L. Effects of add-on nebivolol on blood pressure and glucose parameters in hypertensive patients with prediabetes. J. Clin. Hypertens. (Greenwich). 2013. 15. 270-8.
29. Marketou M., Gupta Y., Jain S., Vardas P. Differential metabolic effects of beta-blockers: an updated systematic review of nebivolol. Curr. Hypertens. Rep. 2017. 19. 22.
30. Lipworth B., Wedzicha J., Devereux G., Vestbo J., Dransfield M.T. Beta-blockers in COPD: time for reappraisal. Eur. Respir. J. 2016. 48. 880-8.
31. Morales D.R., Lipworth B.J., Donnan P.T., Jackson C., Guthrie B. Respiratory effect of beta-blockers in people with asthma and cardiovascular disease: population-based nested case control study. BMC Med. 2017. 15. 18.
32. Bennett M.R., Chang C.L., Tuffery C., Hopping S., Hancox R.J. The impact of regular bisoprolol on the response to salbutamol in asthma: a double-blind randomized placebo-controlled crossover trial. Respirology. 2021. 26. 225-32.
33. Lim K.P., Loughrey S., Musk M., Lavender M., Wrobel J.P. Beta-blocker under-use in COPD patients. Int. J. Chron. Obstruct. Pulmon. Dis. 2017. 12. 3041-6.
34. Espinola-Klein C., Weisser G., Jagodzinski A. et al. β-Blockers in patients with intermittent claudication and arterial hypertension: results from the nebivolol or metoprolol in arterial occlusive disease trial. Hypertension. 2011. 58. 148-54.
35. Mustafaev I.I., Nurmamedova G.S. Effect of monotherapy with nebivolol, bisoprolol, carvedilol on the state of vegetative nervous system and sexual function in men with arterial hypertension. Kardiologiia. 2013. 53. 48-54.
36. Broekman C.P., Haensel S.M., Van de Ven L.L., Slob A.K. Bisoprolol and hypertension: effects on sexual functio-ning in men. J. Sex Marital. Ther. 1992. 18. 325-31.
37. Riva N., Lip G.Y. Nebivolol for the treatment of heart failure. Expert Opin. Investig. Drugs. 2011. 20. 1733-46.
38. Brixius K., Middeke M., Lichtenthal A., Jahn E., Schwin-ger R.H. Nitric oxide, erectile dysfunction and beta-blo-cker treatment (MR NOED study): benefit of nebivolol versus metoprolol in hypertensive men. Clin. Exp. Pharmacol. Physiol. 2007. 34. 327-31.
39. Gür Ö., Gurkan S., Yumun G., Turker P. The comparison of the effects of nebivolol and metoprolol on erectile dysfunction in the cases with coronary artery bypass surgery. Ann. Thorac. Cardiovasc. Surg. 2017. 23. 91-5.
40. Boydak B., Nalbantgil S., Fici F. et al. A randomised comparison of the effects of nebivolol and atenolol with and without chlorthalidone on the sexual function of hypertensive men. Clin. Drug Investig. 2005. 25. 409-16.
41. Cordero A., Bertomeu-Martínez V., Mazón P. et al. Erectile dysfunction in high-risk hypertensive patients treated with beta-blockade agents. Cardiovasc. Ther. 2010. 28. 15-22.
42. Doumas M., Tsakiris A., Douma S. et al. Beneficial effects of switching from beta-blockers to nebivolol on the erectile function of hypertensive patients. Asian J. Androl. 2006. 8. 177-82.
43. Sharp R.P., Gales B.J. Nebivolol versus other beta blo-ckers in patients with hypertension and erectile dysfunction. Ther. Adv. Urol. 2017. 9. 59-63.
44. Aydin K., Gôkçen K., Yildirim Ş., Bagcivan Ì., Parlak M., Gôkçe G. In vitro evaluation of nebivolol effects on nonadrenergic non-cholinergic responses in rabbit corpus cavernosum. Andrologia. 2018. 50. e13062.
45. Martínez-Salamanca J.I., La Fuente J.M. et al. Nebivolol potentiates the efficacy of PDE5 inhibitors to relax corpus cavernosum and penile arteries from diabetic patients by enhancing the NO/cGMP pathway. J. Sex Med. 2014. 11. 1182-92.
46. Brixius K., Bundkirchen A., Bölck B., Mehlhorn U., Schwinger R.H. Nebivolol, bucindolol, metoprolol and carvedilol are devoid of intrinsic sympathomimetic activity in human myocardium. Br. J. Pharmacol. 2001. 133. 1330-8.
47. Bundkirchen A., Brixius K., Bölck B., Nguyen Q., Schwinger R.H. Beta 1-adrenoceptor selectivity of nebivolol and bisoprolol. A comparison of [3H]CGP 12.177 and [125I]iodocyanopindolol binding studies. Eur. J. Pharmacol. 2003. 460. 19-26.
48. Nuttall S.L., Routledge H.C., Kendall M.J. A comparison of the beta1-selectivity of three beta1-selective beta-blockers. J. Clin. Pharm. Ther. 2003. 28. 179-86.
49. Maack C., Tyroller S., Schnabel P. et al. Characterization of beta(1)-selectivity, adrenoceptor-G(s)-protein interaction and inverse agonism of nebivolol in human myocardium. Br. J. Pharmacol. 2001. 132. 1817-26.
50. Baker J.G. The selectivity of beta-adrenoceptor antagonists at the human beta1, beta2 and beta3 adrenoceptors. Br. J. Pharmacol. 2005. 144. 317-22.
51. Schnabel P., Maack C., Mies F., Tyroller S., Scheer A., Böhm M. Binding properties of beta-blockers at recombinant beta1-, beta2-, and beta3-adrenoceptors. J. Cardiovasc. Pharmacol. 2000. 36. 466-71.
52. Lymperopoulos A., Rengo G., Koch W.J. Adrenergic nervous system in heart failure: pathophysiology and therapy. Circ. Res. 2013. 113. 739-53.
53. Feldman D.S., Carnes C.A., Abraham W.T., Bristow M.R. Mechanisms of disease: beta-adrenergic receptors-alterations in signal transduction and pharmacogenomics in heart failure. Nat. Clin. Pract. Cardiovasc. Med. 2005. 2. 475-83.
54. Grassi G. Sympathomodulatory effects of antihypertensive drug treatment. Am. J. Hypertens. 2016. 29. 665-75.
55. Cruickshank J. Nebivolol, a third generation beta-blo-cker. J. Signs Symptoms. 2014. 3. 380-91.
56. Oliver E., Mayor F. Jr, D’Ocon P. Beta-blockers: historical perspective and mechanisms of action. Rev. Esp. Cardiol. (Engl Ed). 2019. 72. 853-62.
57. Cruickshank J. Nebivolol, a third generation beta-blo-cker. J. Symptoms Signs. 2014. 3. 380-91.
58. Czuriga I., Riecansky I., Bodnar J. et al. Comparison of the new cardioselective beta-blocker nebivolol with bisoprolol in hypertension: the Nebivolol, Bisoprolol Multicenter Study (NEBIS). Cardiovasc. Drugs Ther. 2003. 17. 257-63.
59. Khilnani G., Khilnani A.K. Inverse agonism and its therapeutic significance. Indian J. Pharmacol. 2011. 43. 492-501.
60. Cheymol G., Woestenborghs R., Snoeck E. et al. Pharmacokinetic study and cardiovascular monitoring of nebivolol in normal and obese subjects. Eur. J. Clin. Pharmacol. 1997. 51. 493-8.
61. Leopold G., Pabst J., Ungethüm W., Bühring K.U. Basic pharmacokinetics of bisoprolol, a new highly beta 1-selective adrenoceptor antagonist. J. Clin. Pharmacol. 1986. 26. 616-21.
62. Hilas O., Ezzo D. Nebivolol (bystolic), a novel Beta blo-cker for hypertension. P. T. 2009. 34. 188-92.
63. Briciu C., Neag M., Muntean D. et al. Phenotypic differences in nebivolol metabolism and bioavailability in healthy vo-lunteers. Clujul Med. 2015. 88. 208-13.
64. Momcilovic S., Jovanovic A., Radojkovic D. et al. Population pharmacokinetic analysis of bisoprolol in type 2 diabetic patients with hypertension. Eur. J. Clin. Pharmacol. 2020. 76. 1539-46.
65. Momcilovic S., Milovanovic J.R., Jankovic S.M. et al. Population pharmacokinetic analysis of bisoprolol in patients with acute coronary syndrome. J. Cardiovasc. Pharmacol. 2019. 73. 136-42.
66. Âgesen F.N., Weeke P.E., Tfelt-Hansen P., Tfelt-Hansen J. Pharmacokinetic variability of beta-adrenergic blocking agents used in cardiology. Pharmacol. Res. Perspect. 2019. 7. e00496.
67. Singh S., Warren H.R., Hiltunen T.P. et al. Genome-wide metaanalysis of blood pressure response to βΐ-blockers: results from ICAPS (International Consortium of Antihypertensive Pharmacogenomics Studies). J. Am. Heart Assoc. 2019. 8. e013115.
68. Gong Y., McDonough C.W., Beitelshees A.L. et al. PTPRD gene associated with blood pressure response to atenolol and resistant hypertension. J. Hypertens. 2015. 33. 2278-85.
69. Ingram A., Valente M. Genetic variation of hepatic enzymes influence on β-blocker dose in patients with reduced ejection fraction heart failure. J. Pharm. Pract. 2020. 33. 96-8.
70. Hiltunen T.P., Donner K.M., Sarin A.P. et al. Pharmacogenomics of hypertension: a genome-wide, placebo-controlled cross-over study, using four classes of antihypertensive drugs. J. Am. Heart Assoc. 2015. 4. e001521.
71. Rau T., Düngen H.D., Edelmann F. et al. Impact of the β1-adrenoceptor Arg389Gly polymorphism on heart-rate responses to bisoprolol and carvedilol in heart-failure patients. Clin. Pharmacol. Ther. 2012. 92. 21-8.
72. Contini Apostolo A., Cattadori G. et al. Multiparametric comparison of CARvedilol, vs. NEbivolol, vs. BIsoprolol in moderate heart failure: the CARNEBI trial. Int. J. Cardiol. 2013. 168. 2134-40.
73. De Cree J., Van Nueten L., Geukens H., Verhaegen H. Comparative cardiac haemodynamics of bisoprolol, celiprolol, carvedilol and nebivolol in normal volunteers. Int. J. Clin. Pharmacol. Res. 1992. 12. 159-63.
74. Chatterjee S., Biondi-Zoccai G., Abbate A. et al. Benefits of β blockers in patients with heart failure and reduced ejection fraction: network meta-analysis. BMJ. 2013. 346. f55.
75. CIBIS Investigators and Committees. A randomized trial of betablockade in heart failure. The Cardiac Insufficiency Bisoprolol Study (CIBIS). Circulation. 1994. 90. 1765-73.
76. CIBIS Investigators. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet. 1999. 353. 9-13.
77. Willenheimer R., van Veldhuisen D., Silke B. et al. Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence: results of the randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation. 2005. 112. 2426-35.
78. Flather M.D., Shibata M.C., Coats A.J., Van Veldhui-sen D.J., Parkhomenko A., Borbola J., et al., for the SENIORS Investigators. Randomized trial to determine the effect of nebivolol on mortality and cardiovascular hospital admission in elderly patients with heart failure (SENIORS). Eur. Heart J. 2005. 26. 215-25.
79. Erdmann E., Lechat P., Verkenne P., Wiemann H. Results from post-hoc analyses of the CIBIS II trial: effect of bisoprolol in high-risk patient groups with chronic heart failure. Eur. J. Heart Fail. 2001. 3. 469-79.
80. Funck-Brentano C., van Veldhuisen D.J., van de Ven L.L. et al. Influence of order and type of drug (bisoprolol vs. enalapril) on outcome and adverse events in patients with chronic heart failure: a post hoc analysis of the CIBIS-III trial. Eur. J. Heart Fail. 2011. 13. 765-72.
81. Cohen-Solal A., Kotecha D., van Veldhuisen D.J. et al. Efficacy and safety of nebivolol in elderly heart failure patients with impaired renal function: insights from the SENIORS trial. Eur. J. Heart Fail. 2009. 11. 872-80.
82. Montero-Perez-Barquero M., Flather M., Roughton M. et al. Influence of systolic blood pressure on clinical outcomes in elderly heart failure patients treated with nebivolol: data from the SENIORS trial. Eur. J. Heart Fail. 2014. 16. 1009-15.
83. Von Arnim T. Prognostic significance of transient ischemic episodes: response to treatment shows improved prognosis. Results of the Total Ischemic Burden Bisoprolol Study (TIBBs) follow-up. J. Am. Coll. Cardiol. 1996. 28. 20-4.
84. Von Arnim T. Medical treatment to reduce total ischemic burden: total ischemic burden bisoprolol study (TIBBS), a multicenter trial comparing bisoprolol and nifedipine. The TIBBS Investigators. J. Am. Coll. Cardiol. 1995. 25. 231-8.
85. Lin Z.P., Dong M., Liu J. Bisoprolol improved endothelial function and myocardium survival of hypertension with stable angina: a randomized double-blinded trial. Eur. Rev. Med. Pharmacol. Sci. 2013. 17. 794-801.
86. de Muinck E.D., Buchner-Moell D., van de Ven L.L., Lie K.I. Comparison of the safety and efficacy of bisoprolol versus atenolol in stable exercise-induced angina pectoris: a Multicenter International Randomized Study of Angina Pectoris (MIRSA). J. Cardiovasc. Pharmacol. 1992. 19. 870-5.
87. Dorow P., Thalhofer S., Bethge H., Disselhoff G., Wagner G. Long-term treatment of angina pectoris with bisoprolol or atenolol in patients with chronic obstructive bronchitis: a rando-mized, double-blind crossover study. J. Cardiovasc. Pharmacol. 1990. 16 (Suppl. 5). S36-44.
88. Maltz M.B., Dymond D.S., Nathan A.W., Camm A.J. A comparison of once daily bisoprolol, 5 and 10 mg, and atenolol 100 mg in the treatment of angina pectoris. Eur. Heart J. 1987. 8 Suppl. M. 37-42.
89. Kohli R.S., Lahiri A., Raftery E.B. Management of chronic stable angina with once-daily bisoprolol or atenolol and long-term efficacy of bisoprolol. J. Cardiovasc. Pharmacol. 1986. 8 (Suppl. 11). S148-53.
90. Kohli R.S., Khurmi N.S., Kardash M.M., Hughes L.O., Lahiri A., Raftery E.B. Efficacy of once daily bisoprolol in stable angina pectoris: an objective comparison with atenolol and long term follow-up. Eur. Heart J. 1985. 6. 845-50.
91. De Divitiis O., Liguori V., Di Somma S. et al. Bisoprolol in the treatment of angina pectoris: a double blind comparison with verapamil. Eur. Heart J. 1987. 8 Suppl. M. 43-54.
92. Ruf G., Trenk D., Jähnchen E., Roskamm H. Determination of the anti-ischemic activity of nebivolol in comparison with atenolol. Int. J. Cardiol. 1994. 43. 279-85.
93. Ozaydin M., Yucel H., Kocyigit S. et al. Nebivolol versus carvedilol or metoprolol in patients presenting with acute myocardial infarction complicated by left ventricular dysfunction. Med. Princ. Pract. 2016. 25. 316-22.
94. Simova I.I., Todorova-Konstantinova R.R., Denchev S.V. Effects of nebivolol versus bisoprolol on endothelial function in hypertensive patients. Exp. Clin. Cardiol. 2009. 14. 45-9.
95. Kumar R., Mal K., Begum J., Shaukat F. Comparison of nebivolol and bisoprolol for cardiovascular mortality in hypertensive patients. Cureus. 2019. 11. e6453.
96. Van Bortel L.M., Fici F., Mascagni F. Efficacy and tolerability of nebivolol compared with other antihypertensive drugs: a meta-analysis. Am. J. Cardiovasc. Drugs. 2008. 8. 35-44.
97. Chen Y.D., Yang X.C., Pham V.N. et al. Resting heart rate control and prognosis in coronary artery disease patients with hypertension previously treated with bisoprolol: a subgroup analysis of the BISO-CAD study. Chin. Med. J. (Engl.). 2020. 133. 1155-65.
98. Bouvier J.M., Rabot D., Herrero G. Effect of bisoprolol and acebutolol on resting blood pressure and on exercise blood pressure profile in hypertensive patients: a comparative, single-blind study. J. Cardiovasc. Pharmacol. 1990. 16 (Suppl. 5). S179-83.
99. Zhou W.J., Wang R.Y., Li Y. et al. A randomized controlled study on the effects of bisoprolol and atenolol on sympathetic nervous activity and central aortic pressure in patients with essential hypertension. PLoS One. 2013. 8. e72102.
100. Wheeldon N.M., MacDonald T.M., Prasad N., Maclean D., Peebles L., McDevitt D.G. A double-blind comparison of bisoprolol and atenolol in patients with essential hypertension. QJM. 1995. 88. 565-70.
101. Leeman M., van de Borne P., Collart F. et al. Bisoprolol and atenolol in essential hypertension: effects on systemic and renal hemodynamics and on ambulatory blood pressure. J. Cardiovasc. Pharmacol. 1993. 22. 785-91.
102. Neutel J.M., Smith D.H., Ram C.V., Lefkowitz M.P., Kazempour M.K., Weber M.A. Comparison of bisoprolol with
atenolol for systemic hypertension in four population groups (young, old, black and nonblack) using ambulatory blood pressure monitoring. Bisoprolol Investigators Group. Am. J. Cardiol. 1993. 72. 41-6.
103. Lithell H., Selinus I., Hosie J., Frithz G., Weiner L. Efficacy and safety of bisoprolol and atenolol in patients with mild to moderate hypertension: a double-blind, parallel group international multicentre study. Eur. Heart J. 1987. 8 Suppl. M. 55-64.
104. Neutel J.M., Smith D.H., Ram C.V. et al. Application of ambulatory blood pressure monitoring in differentiating between antihypertensive agents. Am. J. Med. 1993. 94. 181-7.
105. Lewis R., Maclean D., Ioannides C., Johnston A., McDevitt D.G. A comparison of bisoprolol and atenolol in the treatment of mild to moderate hypertension. Br. J. Clin. Pharmacol. 1988. 26. 53-9.
106. Bühler F.R., Berglund G., Anderson O.K. et al. Double-blind comparison of the cardioselective beta-blockers bisoprolol and atenolol in hypertension: the Bisoprolol International Multi-center Study (BIMS). J. Cardiovasc. Pharmacol. 1986. 8 (Suppl. 11). S122-7.
107. Dixon M.S., Thomas P., Sheridan D.J. A randomized double-blind study of bisoprolol versus atenolol in mild to mode-rate essential hypertension. Eur. J. Clin. Pharmacol. 1990. 38. 21-4.
108. Eguchi K., Hoshide S., Kario K. Effects of celiprolol and bisoprolol on blood pressure, vascular stiffness, and baroreflex sensitivity. Am. J. Hypertens. 2015. 2. 858-67.
109. Yang T., Jiang Y., Hao Y. et al. Comparison of bisoprolol to a metoprolol CR/ZOK tablet for control of heart rate and blood pressure in mild-to-moderate hypertensive patients: the CREATIVE study. Hypertens. Res. 2017. 40. 79-86.
110. Haasis R., Bethge H. Exercise blood pressure and heart rate reduction 24 and 3 hours after drug intake in hypertensive patients following 4 weeks of treatment with bisoprolol and metoprolol: a randomized multicentre double-blind study (BISOMET). Eur. Heart J. 1987. 8 Suppl. M. 103-13.
111. Bracchetti D., Gradnik R., Alberti A. et al. A double-blind comparison of bisoprolol and captopril for treatment of essential hypertension in the elderly. Cardiovasc. Drugs Ther. 1990. 4. 261-4.
112. Vaïsse B., Herpin D., Asmar R. et al. Assessment of antihypertensive effect by blood pressure monitoring: applications to bisoprolol and lisinopril in a double-blind study. J. Cardiovasc. Pharmacol. 1997. 29. 612-7.
113. Saku K., Liu K., Takeda Y., Jimi S., Arakawa K. Effects of lisinopril and bisoprolol on lipoprotein metabolism in patients with mild-to-moderate essential hypertension. Clin. Ther. 1995. 17. 1136-46.
114. Gosse P., Roudaut R., Herrero G., Dallocchio M. Beta-blockers vs. angiotensin-converting enzyme inhibitors in hypertension: effects on left ventricular hypertrophy. J. Cardiovasc. Pharmacol. 1990. 16 (Suppl. 5). S145-50.
115. Liu G., Li M., Shi X. et al. Efficacy of domestic bisoprolol, enalapril and nifedipine retard in mild to moderate hypertension: a randomized double-blind multicenter clinical trial in China. Zhonghua Nei Ke Za Zhi. 2002. 41. 450-2.
116. Radchenko G.D., Sirenko Y.M., Kushnir S.M., Torbas O.O., Dobrokhod A.S. Comparative effectiveness of a fixed-dose combination of losartan + HCTZ versus bisoprolol + HCTZ in patients with moderate-to-severe hypertension: results of the 6-month ELIZA trial. Vasc. Health Risk Manag. 2013. 9. 535-49.
117. Parrinello G., Paterna S., Torres D. et al. One-year renal and cardiac effects of bisoprolol versus losartan in recently diagnosed hypertensive patients: a randomized, double-blind study. Clin. Drug Investig. 2009. 29. 591-600.
118. Oliván Martinez J., Garcia M.J., Rodriguez Botaro A., Pizarro J.L., Carretero J., Garrido M. Bisoprolol and nifedipine SR in the treatment of hypertension in the elderly. J. Cardiovasc. Pharmacol. 1990. 16 (Suppl. 5). S95-9.
119. Amabile G., Serradimigni A. Comparison of bisoprolol with nifedipine for treatment of essential hypertension in the elderly: comparative double-blind trial. Eur. Heart J. 1987. 8 Suppl. M. 65-9.
120. Bueno J., Amiguet J.A., Carasusan J., Cebollada J., Carretero J. Bisoprolol vs. chlorthalidone: a randomized, double-blind, comparative study in arterial hypertension. J. Cardiovasc. Pharmacol. 1990. 16 Suppl. 5. S189-92.
121. Williams B., MacDonald T.M., Morant S., et al. Spironolactone versus placebo, bisoprolol, and doxazosin to determine the optimal treatment for drug-resistant hypertension (PATHWAY-2): a randomised, double-blind, crossover trial. Lancet. 2015. 386. 2059-68.
122. Van Nueten L., Taylor F.R., Robertson J.I. Nebivolol vs atenolol and placebo in essential hypertension: a double-blind randomised trial. J. Hum. Hypertens. 1998. 12. 135-40.
123. Simon G., Johnson M.L. Comparison of antihypertensive and beta 1-adrenoceptor antagonist effect of nebivolol and atenolol in essential hypertension. Clin. Exp. Hypertens. 1993. 15. 501-9.
124. Badar V.A., Hiware S.K., Shrivastava M.P., Thawani V.R., Hardas M.M. Comparison of nebivolol and atenolol on blood pressure, blood sugar, and lipid profile in patients of essential hypertension. Indian J. Pharmacol. 2011. 43. 437-40.
125. Fogari R., Zoppi A., Lazzari P. et al. Comparative effects of nebivolol and atenolol on blood pressure and insulin sensitivity in hypertensive subjects with type II diabetes. J. Hum. Hypertens. 1997. 11. 753-7.
126. Arosio E., De Marchi S., Prior M., Zannoni M., Lechi A. Effects of nebivolol and atenolol on small arteries and microcirculatory endothelium-dependent dilation in hypertensive patients undergoing isometric stress. J. Hypertens. 2002. 20. 1793-7.
127. Erdogan O., Ertem B., Altun A. et al. Comparison of antihypertensive efficacy of carvedilol and nebivolol in mild-to-moderate primary hypertension: a randomized trial. Anadolu Kardiyol. Derg. 2011. 11. 310-3.
128. Grassi G., Seravalle G., Brambilla G. et al. Multicenter randomized double-blind comparison of nebivolol plus HCTZ and Irbesartan plus HCTZ in the treatment of isolated systolic hypertension in elderly patients: results of the NEHIS study. Adv. Ther. 2017. 33. 2173-87.
129. Heitmann J., Greulich T., Reinke C. et al. Comparison of the effects of nebivolol and valsartan on BP reduction and sleep apnoea activity in patients with essential hypertension and OSA. Curr. Med. Res. Opin. 2010. 26. 1925-32.
130. Rosei E.A., Rizzoni D., Comini S. et al. Evaluation of the efficacy and tolerability of nebivolol versus lisinopril in the treatment of essential arterial hypertension: a randomized, multicentre, double-blind study. Blood Press. Suppl. 2003. 1. 30-5.
131. Van Nueten L., Rishøj Nielsen M., Vertommen C. et al. Nebivolol versus enalapril in essential hypertension: a long-term double-blind comparative trial. Acta Clin. Belg. 1999. 54. 19-25.
132. Van Nueten L., Schelling A., Vertommen C., Dupont A.G., Robertson J.I. Nebivolol vs enalapril in the treatment of essential hypertension: a double-blind randomised trial. J. Hum. Hypertens. 1997. 11. 813-9.
133. Mazza A., Gil-Extremera B., Maldonato A., Toutouzas T., Pessina A.C. Nebivolol vs amlodipine as first-line treatment of essential arterial hypertension in the elderly. Blood Press. 2002. 11. 182-8.
134. Lacourcière Y., Poirier L., Lefebvre J., Provencher P., Arnott W. Comparative effects of a new cardioselective beta-blocker nebivolol and nifedipine sustained-release on 24-hour ambulatory blood pressure and plasma lipoproteins. J. Clin. Pharmacol. 1992. 32. 660-6.
135. Van Nueten L., Lacourcière Y., Vyssoulis G., et al. Nebivolol versus nifedipine in the treatment of essential hypertension: a double-blind, randomized, comparative trial. Am. J. Ther. 1998. 5. 237-43.
136. Saunders E., Smith W.B., DeSalvo K.B., Sullivan W.A. The efficacy and tolerability of nebivolol in hypertensive African American patients. J. Clin. Hypertens. (Greenwich). 2007. 9. 866-75.
137. Tzemos N., Lim P.O., MacDonald T.M. Nebivolol reverses endothelial dysfunction in essential hypertension: a randomized, double-blind, crossover study. Circulation. 2001. 104. 511-4.
138. Duprez D.A., Florea N., Duval S., Koukol C., Cohn J.N. Effect of nebivolol or atenolol vs. placebo on cardiovascular health in subjects with borderline blood pressure: the EVIDENCE study. J. Hum. Hypertens. 2017. 32. 20-5.
139. Hayek S.S., Poole J.C., Neuman R. et al. Differential effects of nebivolol and metoprolol on arterial stiffness, circulating progenitor cells, and oxidative stress. J. Am. Soc. Hypertens. 2015. 9. 206-13.
140. Okamoto L.E., Gamboa A., Shibao C.A. et al. Nebivolol, but not metoprolol, lowers blood pressure in nitric oxide-sensitive human hypertension. Hypertension. 2014. 64. 1241-7.
141. Lacourcière Y., Arnott W. Placebo-controlled comparison of the effects of nebivolol and low-dose hydrochlorothiazide as monotherapies and in combination on blood pressure and lipid profile in hypertensive patients. J. Hum. Hypertens. 1994. 8. 283-8.
142. Lacourcière Y., Lefebvre J., Poirier L., Archambault F., Arnott W. Treatment of ambulatory hypertensives with nebivolol or hydrochlorothiazide alone and in combination. A randomized, double-blind, placebo-controlled, factorial-design trial. Am. J. Hypertens. 1994. 7. 137-45.
143. Papademetriou V. Comparison of Nebivolol monotherapy versus Nebivolol in combination with other antihypertensive therapies for the treatment of hypertension. Am. J. Cardiol. 2009. 103. 273-8.
144. Neutel J.M., Smith D.H., Gradman A.H. Adding nebivolol to ongoing antihypertensive therapy improves blood pressure and response rates in patients with uncontrolled stage I-II hypertension. J. Hum. Hypertens. 2010. 24. 64-73.
145. Frishman W.H., Bryzinski B.S., Coulson L.R. et al. A multifactorial trial design to assess combination therapy in hypertension. Treatment with bisoprolol and hydrochlorothiazide. Arch. Intern. Med. 1994. 154. 1461-8.
146. Frishman W.H., Burris J.F., Mroczek W.J. et al. First-line therapy option with low-dose bisoprolol fumarate and low-dose hydrochlorothiazide in patients with stage I and stage II systemic hypertension. J. Clin. Pharmacol. 1995. 35. 182-8.
147. Ponikowski P., Voors A.A., Anker S.D. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur. Heart J. 2016. 37. 2129-200.
148. Yancy C.W., Jessup M., Bozkurt B. et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. Circulation. 2017. 136. e137-61.
149. Knuuti J., Wijns W., Saraste A., Capodanno D. et al. 2019 ESC Guidelines for the diagnosis and management of chro-nic coronary syndromes. Eur. Heart J. 2020. 41. 407-77.
150. Roffi M., Patrono C., Collet J.P. et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: task force for the management of acute coronary syndromes in patients presen-ting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur. Heart J. 2016. 14(37). 267-315.
151. Ibanez B., James S., Agewall S. et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC). Eur. Heart J. 2018. 39. 119-77.
152. O’Gara P.T., Kushner F.G., Ascheim D.D. et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2013. 127. e362-425.
153. Williams B., Mancia G., Spiering W. et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur. Heart J. 2018. 39. 3021-104.
154. Law M.R., Morris J.K., Wald N.J. Use of blood pressure lowering drugs in the prevention of cardiovascular disease: meta-analysis of 147 randomised trials in the context of expectations from prospective epidemiological studies. BMJ. 2009. 338. b1665.
155. Sabidó M., Thilo H., Guido G. Long-term effectiveness of bisoprolol in patients with angina: a real-world evidence study. Pharmacol. Res. 2019. 139. 106-12.
156. Cho J.Y. Beta-blockers in heart failure with preserved ejection fraction: could their use be vindicated as an acceptable option in the future treatment guideline? Korean Circ J. 2019. 49. 249-51.
157. Kim S.H., Yun S.C., Park J.J. et al. Beta-blockers in patients with heart failure with preserved ejection fraction: results from the Korea Acute Heart Failure (KorAHF) registry. Korean Circ. J. 2019. 49. 238-48.
/52_2.jpg)

/50.jpg)
/52.jpg)
/53.jpg)
/55.jpg)