Журнал «Почки» Том 12, №1, 2023
Вернуться к номеру
Використання препарату ритуксимаб у педіатричній нефрологічній практиці
Авторы: Лагодич Є.К.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Версия для печати
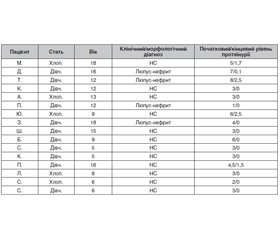
Матеріали та методи. У статті наведені результати аналізу історій хвороби 16 дітей із гломерулопатіями, які отримували лікування ритуксимабом згідно зі встановленими діагнозами. Вік дітей від 5 до 18 років, розподіл за статтю — 5 хлопчиків (31,3 %), 11 дівчаток (68,8 %). 12 дітей (75 %) отримували ритуксимаб з приводу часто рецидивуючого/стероїдзалежного нефротичного синдрому (FRNS/SDNS) та 4 дитини (25 %) — з приводу вовчакового нефриту. Результати. У деяких випадках ритуксимаб призначався на фоні прийому per os глюкокортикоїдів. Під час введення ритуксимабу використовувався протокол, у якому передбачено попереднє введення метилпреднізолону у дозі 1 мг/кг або гідрокортизону 100 мг, з подальшим введенням ритуксимабу у дозі 15 мг/кг зі швидкістю приблизно 50 мл/годину за допомогою інфузомату, попередньо розведеного фізіологічним розчином 1 мг/мл, з постійним моніторингом за станом дитини. Частота інфузій ритуксимабу була як мінімум двічі з інтервалом у два тижні. За потреби, після контролю рівня CD20 у сироватці крові, за наявності будь-якої кількості клітин або при збереженні активного процесу ритуксимаб вводився повторно через 6 міс. після останнього введення. У дні лікування ритуксимабом діти, які отримували глюкокортикоїди per os, їх не отримували, але наступного дня після інфузії прийом стероїдів per os продовжувався в тій самій дозі. 9 дітей отримували супроводжувальну терапію per os інгібітором ангіотензинперетворюючого ферменту у ренопротективній дозі, яка не відмінялась у дні проведення інфузії ритуксимабу. Під час введення ритуксимабу у 2 дітей відмічались побічні реакції у вигляді зниження артеріального тиску і тахікардії, які зазвичай виникали на тлі збільшення швидкості введення і після припинення інфузії та подальшого зменшення її швидкості усувалися. У всіх інших дітей переносимість ритуксимабу була доброю. Проводилась оцінка ефективності терапії ритуксимабом за рівнем протеїнурії, який на початку лікування становив у середньому 4,0 г/л, а після введення ритуксимабу — 0,5 г/л. Висновки. На сьогодні, в умовах військового стану в Україні та обмежених ресурсів, використання ритуксимабу відкриває нові можливості у лікуванні нефрологічної патології у дітей, виступаючи альтернативою тривалого використання глюкокортикоїдів, спрощуючи лікування та знижуючи кількість побічних дій, особливо у дітей з FRNS/SDNS та при патологія-опосередкованих АТ (вовчаковий нефрит). Але важливо додержуватись протоколу введення ритуксимабу та особливо швидкості введення через часті побічні інфузійні реакції.
Materials and methods. The article presents the data on the analysis of case histories in 16 children with glomerulopathies who received treatment with rituximab in accordance with the diagnoses. Age of patients was 5 to 18 years, distribution by sex — 5 boys (31.3 %), 11 girls (68.8 %). Twelve children (75 %) received rituximab for frequently relapsing/steroid-dependent nephrotic syndrome (FRNS/SDNS) and 4 (25 %) children for lupus nephritis. Results. In some cases, rituximab was prescribed against the background of glucocorticoids per os. Rituximab therapy followed a protocol with pre-administration of 1 mg/kg methylprednisolone or 100 mg hydrocortisone, followed by 15 mg/kg rituximab at a rate of approximately 50 ml/h using an infusion pump, which had previously been diluted with saline 1 mg/ml, with constant monitoring of the child’s condition. Rituximab was administered at least twice, two weeks apart. If necessary, after monitoring the level of CD20 in the blood serum, and in the presence of any number of cells or the preservation of the activity of the process, rituximab was administered again 6 months after the last injection. During treatment with rituximab, children who received glucocorticoids per os did not receive them, and the next day after the infusion they continued to receive them at the same dose. Nine children received concomitant therapy per os with an angiotensin-converting enzyme inhibitor at a renoprotective dose, which was not canceled on the days of rituximab infusion. During the administration of rituximab, two children reported adverse reactions in the form of a decreased blood pressure and tachycardia, which most likely occurred against the background of an increased rate of administration, and after stopping the infusion and a subsequent decrease in its rate, they disappeared. All other children tolerated rituximab well. The effectiveness of rituximab therapy was evaluated by the level of proteinuria, which at the baseline averaged 4.0 g/l, and after rituximab infusion, it averaged 0.5 g/l. Conclusions. Today, in the conditions of martial law in Ukraine and limited resources, the use of rituximab opens new opportunities in the treatment of nephrological pathology in children, acting as an alternative to the long-term use of glucocorticoids, simplifying treatment and reducing the number of side effects, especially in children with FRNS/SDNS and pathology-mediated AT (lupus nephritis). However, it is important to adhere to the protocol for rituximab administration and especially the rate of administration due to frequent adverse infusion reactions.
ритуксимаб; дитяча нефрологія; нефротичний синдром; вовчаковий нефрит
rituximab; pediatric nephrology; nephrotic syndrome; lupus nephritis
Вступ
Матеріали та методи
Результати та обговорення
Використання ритуксимабу (RTX) у дитячій нефрології
Висновки
- Bosch X., Ramos-Casals M., Khamashta M.A. Drugs Targe–ting B-Cells in Autoimmune Diseases. Springer Science & Business Media, 2013. Р. 1-4. Archived from the original on 5 November 2017.
- Sinha R., Agrawal N., Xue Y., et al. Use of rituximab in pae–diatric nephrology. Archives of Disease in Childhood. 2021. 106. 1058-1065.
- Salles G., Barrett M., Foà R., et al. Rituximab in B-cell hematologic malignancies: a review of 20 years of clinical experience. Adv. Ther. 2017. 34. 2232-73. 10.1007/s12325-017-0612-x.
- Вакуленко Л.І., Литвинова О.М., Посмітюха І.В. Застосування ритуксимабу в лікуванні дітей з нефротичним синдромом. Нирки. 2022. № 11(2). DOI: 10.22141/2307-1257.11.2.2022.365.
- Іванов Д.Д., Дядик О.О., Ротова С.О., Іванова М.Д. 10-річний особистий досвід застосування ритуксимабу в нефрологічних пацієнтів. Нирки. 2020. № 9(2). С. 99-104. DOI: 10.22141/2307-1257.9.2.2020.203409.
- Іванов Д.Д., Завальна І.М. Інфузійні реакції на введення ритуксимабу: алгоритм дій. Нирки. 2022. № 1. С. 49-53.
- Wang W., Erbe A.K., Hank J.A. Nk cell-mediated antibody-dependent cellular cytotoxicity in cancer immunotherapy. Front. Immunol. 2015. 6. 368. 10.3389/fimmu.2015.00368.
- Weiner G.J. Rituximab: mechanism of action. Semin. Hematol. 2010. 47. 115-23. 10.1053/j.seminhematol.2010.01.011.
- Mélet J., Mulleman D., Goupille P., et al. Rituximab-Induced T cell depletion in patients with rheumatoid arthritis: association with clinical response. Arthritis Rheum. 2013. 65. 2783-90. 10.1002/art.38107.
- Fornoni A., Sageshima J., Wei C., et al. Rituximab targets podocytes in recurrent focal segmental glomerulosclerosis. Sci. Transl. Med 2011. 3. 85ra46. 10.1126/scitranslmed.3002231.
- Benz K., Dötsch J., Rascher W., et al. Change of the course of steroid-dependent nephrotic syndrome after rituximab therapy. Pediatr. Nephrol. 2004. 19. 794-7. 10.1007/s00467-004-1434-z.
- Wei C., Trachtman H., Li J., et al. Circulating suPAR in two cohorts of primary FSGS. J. Am. Soc. Nephrol. 2012. 23. 2051-9. 10.1681/ASN.2012030302.
- Wang C.-S., Liverman R.S., Garro R., et al. Ofatumumab for the treatment of childhood nephrotic syndrome. Pediatr. Nephrol. 2017. 32. 835-41. 10.1007/s00467-017-3621-8.
- Trautmann A., Vivarelli M., Samuel S., et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr. Nephrol. 2020. 35. 1529-61. 10.1007/s00467-020-04519-1.
- Boumediene A., Vachin P., Sendeyo K., Oniszczuk J., Zhang S.Y., Henique C., et al. NEPHRUTIX: a randomized, double-blind, placebo vs Rituximab-controlled trial assessing –T-cell subset changes in Minimal Change Nephrotic Syndrome. J. Autoimmun. 2018 Mar. 88. 91-102. doi: 10.1016/j.jaut.2017.10.006.
- Basu B., Sander A., Roy B., Preussler S., Barua S., Mahapatra T.K.S., et al. Efficacy of rituximab vstacrolimus in pediatric corticosteroid-dependent nephrotic syndrome: a randomized clinical trial. JAMA Pediatr. 2018 Aug 1. 172(8). 757-764. doi: 10.1001/jamapediatrics.2018.1323.
- Ahn Y.H., Kim S.H., Han K.H., Choi H.J., Cho H., Lee J.W., et al. Efficacy and safety of rituximab in childhood-onset, difficult-to-treat nephrotic syndrome: a multicenter open-label trial in Korea. Medicine (Baltimore). 2018 Nov. 97(46). e13157. doi: 10.1097/MD.0000000000013157.
- Ravani P., Rossi R., Bonanni A., Quinn R.R., Sica F., Bodria M., et al. Rituximab in children with steroid-dependent nephrotic syndrome: A multicenter, open-label, noninferiority, randomized controlled trial. J. Am. Soc. Nephrol. 2015 Sep. 26(9). 2259-66. doi: 10.1681/ASN.2014080799.
- Iijima K., Sako M., Nozu K., Mori R., Tuchida N., Kamei K., et al. Rituximab for childhoodonset, complicated, frequently relapsing nephrotic syndrome or steroid-dependent nephrotic syndrome: a multicentre, double-blind, randomised, placebo-controlled trial. Lancet. 2014 Oct 4. 384(9950). 1273-81. doi: 10.1016/S0140-6736(14)60541-9.
- Ravani P., Magnasco A., Edefonti A., Murer L., Rossi R., Ghio L., et al. Short-term effects of rituximab in children with steroid- and calcineurin-dependent nephrotic syndrome: a randomized controlled trial. Clin. J. Am. Soc. Nephrol. 2011 Jun. 6(6). 1308-15. doi: 10.2215/CJN.09421010.
- Kallash M., Smoyer W.E., Mahan J.D. Rituximab use in the management of childhood nephrotic syndrome. Front. Pediatr. 2019. 7. 178. 10.3389/fped.2019.00178.
- Sinha R., Banerjee S., Mukherjee A., et al. Impact of rituximab on anthropometric indices among childhood steroid-dependent nephrotic syndromes. Arch. Dis. Child. 2021. 106. 283-5. 10.1136/archdischild-2019-318019.
- Lee J.J.Y., Alsaleem A., Chiang G.P.K., et al. Hallmark trials in ANCA-associated vasculitis (AAV) for the pediatric rheumatologist. Pediatr. Rheumatol. Online J. 2019. 17. 31. 10.1186/s12969-019-0343-4.
- Marks S.D., Patey S., Brogan P.A., et al. B lymphocyte depletion therapy in children with refractory systemic lupus erythematosus. Arthritis Rheum. 2005. 52. 3168-74. 10.1002/art.21351.
- Basu B., Roy B., Babu B.G. Efficacy and safety of rituximab in comparison with common induction therapies in pediatric active lupus nephritis. Pediatr. Nephrol. 2017. 32. 1013-21. 10.1007/s00467-017-3583-x.
- Cheng D.R., Barton R., Greenway A., et al. Rituximab and protection from vaccine preventable diseases: applying the evidence to pediatric patients. Expert Rev. Vaccines. 2016. 15. 1567-74. 10.1080/14760584.2016.1193438.
- KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases.
- Chan E.Y., Webb H., Yu E., et al. Both the rituximab dose and maintenance immunosuppression in steroid-dependent/frequently-relapsing nephrotic syndrome have important effects on outcomes. Kidney Int. 2020. 97. 393-401. 10.1016/j.kint.2019.09.033.
- Trautmann A., Vivarelli M., Samuel S., et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr. Nephrol. 2020. 35. 1529-61. 10.1007/s00467-020-04519-1.
- Rituximab Genentech. Available: https://www.accessdata.fda.gov/drugsatfda_docs/label/1997/ritugen112697-lab.pdf [Acces–sed 30 Sep 2020].
- Topaloglu R., Gülhan B., Çelegen K. et al. Rituximab for Children With Difficult-to-Treat Nephrotic Syndrome: Its Effects on Disease Progression and Growth. Front. Pediatr. 2019. 7. 313. doi: 10.3389/fped.2019.00313.

/48.jpg)
/49.jpg)