Журнал «Здоровье ребенка» Том 18, №2, 2023
Вернуться к номеру
Окремі імунологічні біомаркери тяжкості перебігу неонатального сепсису в немовлят при різній запальній відповіді організму
Авторы: Колоскова О.К., Богуцька Н.К., Власова О.В., Тарнавська С.І., Шахова О.О.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
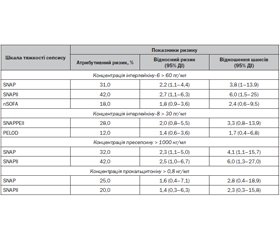
Мета дослідження: для поліпшення результатів лікування хворих на неонатальний сепсис немовлят з альтернативним вмістом у сироватці крові С-реактивного білка вивчити діагностичну цінність і показники клініко-епідеміологічного ризику окремих імунологічних біомаркерів як показників тяжкості клінічного перебігу захворювання. Матеріали та методи. Проведено комплексне клініко-параклінічне обстеження 56 дітей, хворих на неонатальний сепсис. Тяжкість клінічного перебігу неонатального сепсису визначена за допомогою констеляційно-діагностичних шкал поліорганної дисфункції SNAPII, SNAРPЕII, PELOD, SOFA, nSOFA, PEMOD, SCRIB, NEOMOD. Усім новонародженим проведено комплексне імунологічне дослідження з визначенням вмісту імуноглобулінів A, G, M у сироватці крові, С-реактивного білка, пресепсину, прокальцитоніну, інтерлейкінів-6, -8, -10. Сформовано 2 клінічні групи. До І клінічної групи увійшли 25 немовлят, хворих на неонатальний сепсис, з рівнем у сироватці крові С-реактивного білка < 20 мг/л (частка хлопчиків — 52,0 %, мешканці міста — 80,0 %, середній вміст С-реактивного білка — 8,80 ± 0,41 мг/л). ІІ клінічну групу сформувала 31 дитина з неонатальним сепсисом і концентрацією С-реактивного білка в сироватці крові > 20 мг/л (частка хлопчиків — 62,8 % (р > 0,05), мешканці міста — 57,1 % (р > 0,05), середній вміст С-реактивного білка — 29,70 ± 1,89 мг/л (р < 0,05)). За основними клінічними характеристиками групи спостереження були порівнянними. Результати. Проведені дослідження показали, що тяжкість клінічного перебігу неонатального сепсису, визначена за допомогою констеляційно-діагностичних шкал поліорганної дисфункції SNAPII, SNAPРЕII, PELOD, SOFA, nSOFA, PEMOD, SCRIB, NEOMOD, у групах порівняння не мала вірогідних відмінностей. Встановлено, що в новонароджених з умістом С-реактивного білка < 20 мг/л порівняно з представниками ІІ клінічної групи концентрація ІЛ-6 була в 1,7 раза, ІЛ-8 — у 1,5 раза, ІЛ-10 — в 1,8 раза нижчою. Отже, у пацієнтів ІІ групи встановлено ризик зростання вмісту ІЛ-6 у сироватці крові > 31,4 пг/мл (відносний ризик (ВР) 1,7 (95% довірчий інтервал (ДІ) 1,3–2,2) при співвідношенні шансів (СШ) 2,8 (95% ДІ 1,6–5,1)), ІЛ-10 > 18 пг/мл (ВР 1,7 (95% ДІ 1,1–2,4) при СШ 2,9 (95% ДІ 1,6–5,3)), ІЛ-8 > 24,0 пг/мл (ВР 1,9 (95% ДІ 1,2–3,1) при СШ 4,7 (95% ДІ 2,5–8,8)). Серед вивчених імунологічних біомаркерів концентрація пресепсисну > 1000 нг/мл мала найкращі показники клініко-епідеміологічного ризику тяжкого сепсису за даними констеляційно-діагностичних шкал поліорганної дисфункції (СШ 4,3–6,0; відносний ризик 2,3–2,5; атрибутивний ризик 32,0–42,0 %). Висновки. Підвищений вміст окремих маркерів неонатального сепсису (пресепсин, прокальцитонін) та інтерлейкінів (ІЛ-6, ІЛ-8) може вважатися біомаркером тяжкого перебігу неонатального сепсису з імовірним розвитком поліорганної дисфункції.
Background. Objective: to study the diagnostic value and indicators of clinical and epidemiological risk of some immunological biomarkers as indicators of the severity of the clinical course of neonatal sepsis in order to improve treatment outcomes in newborns with neonatal sepsis with an alternative serum content of C-reactive protein. Materials and methods. A comprehensive clinical and paraclinical examination of 56 children with neonatal sepsis was conducted. The severity of neonatal sepsis was determined using the constellation-diagnostic scales of multiple organ dysfunction such as SNAPII, SNAPРЕII, PELOD, SOFA, nSOFA, PEMOD, SCRIB, NEOMOD. The comprehensive immunological examination with evaluation of immunoglobulin A, G, M, C-reactive protein, presepsin, procalcitonin, interleukins (IL) 6, 8, 10 content in blood serum was conducted in all newborns. Two clinical groups were formed. The clinical group I included 25 infants with neonatal sepsis with a serum level of C-reactive protein < 20 mg/l (boys — 52.0 %, city residents — 80.0 %, the average content of C-reactive protein — 8.80 ± 0.41 mg/l). The clinical group II was formed by 31 children with neonatal sepsis and C-reactive protein blood concentration > 20 mg/l (with 62.8 % of boys, p > 0.05; 57.1 % of city residents, p > 0.05; the average content of C-reactive protein — 29.70 ± 1.89 mg/l, р < 0.05). According to the main clinical characteristics, the observation groups were comparable. Results. The conducted studies showed that the severity of the clinical course of neonatal sepsis, determined using the constellation-diagnostic scales of multiple organ dysfunction (SNAPII, SNAPРЕII, PELOD, SOFA, nSOFA, PEMOD, SCRIB, NEOMOD), did not reveal any significant differences in the comparison groups. It was found that in newborns with a C-reactive protein content < 20 mg/l, compared to representatives of the clinical group II, the concentration of IL-6, IL-8 and IL-10 was lower by 1.7, 1.5 and 1.8 times, respectively. Thus, patients of the group II had the risk of increasing serum content of IL-6 > 31.4 pg/ml (relative risk (RR) 1.7 (95% confidence interval (CI): 1.3–2.2) with an odds ratio (OR) 2.8 (95% CI: 1.6–5.1)), IL-10 > 18 pg/ml (RR 1.7 (95% CI: 1.1–2.4) with an OR 2.9 (95% CI: 1.6–5.3)), and IL-8 > 24.0 pg/ml (RR 1.9 (95% CI: 1.2–3.1) with an OR 4.7 (95% CI: 2.5–8.8)). Among the studied immunological biomarkers, the concentration of presepsin > 1,000 ng/ml was accompanied by the best indicators of the clinical and epidemiological risk of severe sepsis according to the constellation-diagnostic scales of multiple organ dysfunction (odds ratio 4.3–6.0, relative risk 2.3–2.5, attributable risk 32.0–42.0 %). Conclusions. Elevated content of some markers of neonatal sepsis (presepsin, procalcitonin) and interleukins (IL-6, IL-8) can be considered a biomarker of a severe course of neonatal sepsis with probable development of multiple organ dysfunction.
неонатальний сепсис; С-реактивний білок; пресепсин
neonatal sepsis; C-reactive protein; presepsin
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Aydemir C., Aydemir H., Kokturk F., Kulah C., Mungan A.G. The cut-off levels of procalcitonin and C-reactive protein and the kinetics of mean platelet volume in preterm neonates with sepsis. BMC Pediatr. 2018. 18(1). 253- 256. doi: 10.1186/s12887-018-1236-2.
- Beudeker C.R., Vijlbrief D.C., van Montfrans J.M., Rooijakkers S.H., van der Flier M. Neonatal sepsis and transient immunodeficiency: Potential for novel immunoglobulin therapies? Front. Immunol. 2022. 13. 1016877. doi: 10.3389/fimmu.2022.1016877.
- Celik I.H., Hanna M., Canpolat F.E., Pammi M. Diagnosis of neonatal sepsis: the past, present and future. Pediatr. Res. 2021. 10. doi: 1038/s41390-021-01696-z.
- Eschborn S., Weitkamp J.H. Procalcitonin versus C-reactive protein: review of kinetics and performance for diagnosis of neonatal sepsis. J. Perinatol. 2019. 39(7). 893-903. doi: 10.1038 s41372-019-0363-4.
- Hofer N., Zacharias E., Müller W., Resch B. An update on the use of C-reactive protein in early-onset neonatal sepsis: current insights and new tasks. Neonatology. 2012. 102. 25-36. doi: 10.1159/000336629.
- Khaertynov K.S., Boichuk S.V., Khaiboullina S.F., Anokhin V.A., Andreeva A.A., Lombardi V.C. et al. Comparative Assessment of Cytokine Pattern in Early and Late Onset of Neonatal Sepsis. J. Immunol. Res. 2017. 8601063. doi: 10.1155/2017/8601063.
- Kozlovski T., Yochpaz S., Shachar I., Friedman N., Marom R. Does the delivery mode affect post-birth neonatal serum C-reactive protein levels? A causal effect analysis. J. Paediatr. Child Health. 2022. 58(8). 1330-1336. doi: 10.1111/jpc.15975.
- Lobo B.B., Marba S.T., Machado H.C., Caldas J.S. Neonatal Sequential Organ Failure Assessment as a late-onset sepsis mortality predictor in very low birth weight newborns: a Brazilian cohort study. Eur. J. Pediatr. 2022. 181(10). 3767-3774. doi: 10.1007/s00431-022-04583-9.
- Liang D., Kotadia N., English L., Kissoon N., Ansermino J.M., Kabakyenga J. Predictors of mortality in neonates and infants hospita–lized with sepsis or serious infections in developing countries: a systematic review. Front. Pediatr. 2018. 6. 277.
- Machado J.R., Soave D.F., da Silva M.V., de Menezes L.B., Etchebehere R.M., Monteiro M.L. et al. Neonatal sepsis and inflammatory mediators. Mediators Inflamm. 2014. 269681. doi: 10.1155/2014/269681.
- Memar M.Y., Alizadeh N., Varshochi M., Kafil H.S. Immunologic biomarkers for diagnostic of early-onset neonatal sepsis. J. Matern. Fetal Neonatal Med. 2019. 32(1). 143-153. doi: 10.1080/14767058.2017.1366984.
- National Institute for Health and Care Excellence. Neonatal infection: antibiotics for prevention and treatment. National Institute for Health and Care Excellence. 2021. https://www.nice.org.uk/guidance/ng195.
- O’Reilly D., Murphy C.A., Drew R., El-Khuffash A., Maguire P.B., Ainle F.N., McCallion N. Platelets in pediatric and neonatal sepsis: novel mediators of the inflammatory cascade. Pediatr. Res. 2022. 91(2). 359-367. doi: 10.1038/s41390-021-01715-z.
- Ruan L., Chen G.Y., Liu Z., Zhao Y., Xu G.Y., Li S.F. et al. The combination of procalcitonin and C-reactive protein or presepsin alone improves the accuracy of diagnosis of neonatal sepsis: a meta-analysis and systematic review. Crit. Care. 2018. 22(1). 316-322. doi: 10.1186/s13054-018-2236-1.
- Sankar J., Dhochak N., Kumar K., Singh M., Sankar M.J., Lodha R. Comparison of International Pediatric Sepsis Consensus Confe–rence Versus Sepsis-3 Definitions for Children Presenting With Septic Shock to a Tertiary Care Center in India: A Retrospective Study. Pediatr. Crit. Care Med. 2019. 20(3). 122-129. doi: 10.1097/PCC.0000000000001864.
- Shane A.I., Sanchez P.J., Stoll B.J. Neonatal sepsis. Lancet. 2017. 390. 1770-1780.
- Schlapbach L.J., Straney L., Bellomo R., MacLaren G., Pilcher D. Prognostic accuracy of age-adapted SOFA, SIRS, PELOD-2, and qSOFA for in-hospital mortality among children with suspected infection admitted to the intensive care unit. Intensive Care Med. 2018. 44(2). 179-188.
- Singer M., Deutschman C.S., Seymour C.W., Shankar-Hari M., Annane D., Bauer M. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA. 2016. 315(8). 801-810.
- Sullivan B.A., Fairchild K.D. Vital signs as physiomarkers of neonatal sepsis. Pediatr. Res. 2022 Jan. 91(2). 273-282. doi: 10.1038/s41390-021-01709-x.
- Weiss S.L. Delayed antimicrobial therapy increases mortality and organ dysfunction duration in pediatric sepsis. Crit. Care Med. 2014. 42. 2409-2417.
- Wong H.R. Pediatric sepsis biomarkers for prognostic and predictive enrichment. Pediatr. Res. 2022. 91. 283-288. doi: 10.1038/s41390-021-01620-5.
- Zeigler A.C., Ainsworth J.E., Fairchild K.D., Wynn J.L., Sullivan B.A. Sepsis and Mortality Prediction in Very Low Birth Weight Infants: Analysis of HeRO and nSOFA. Am. J. Perinatol. 2021. 10:10. 1055/s-0041-1728829. doi: 10.1055/s-0041-1728829.