Журнал "Гастроэнтерология" Том 57, №2, 2023
Вернуться к номеру
Особливості мікробіому кишечника в пацієнтів із глютенчутливими захворюваннями, які дотримуються безглютенової дієти
Авторы: O.Yu. Gubska (1), A.A. Kuzminets (1), O.R. Denesyuk (1), O.K. Koliada (2), V.V. Moseyko (2), O.A. Dolko (1)
(1) — Bogomolets National Medical University, Kyiv, Ukraine
(2) — DIAGEN Genetic Laboratory, Kyiv, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
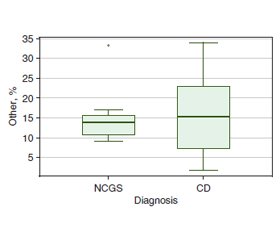
Актуальність. Кишковий дисбіоз пов’язаний із порушенням як кількісного, так і якісного складу мікробіоти кишечника, що призводить до шлунково-кишкових розладів. До них належать функціональні розлади травлення, органічні захворювання та особливі стани, якими вважаються реакції харчового несприйняття злакових, а саме непереносимість глютену без целіакії (НГБЦ) та целіакія. Безглютенова дієта (БГД) — це єдиний дієвий метод лікування целіакії та НГБЦ. Окремим питанням, що підлягає вивченню, є особливості кишкового мікробіому (КМ) у пацієнтів із глютензалежними захворюваннями та зв’язок останніх із БГД. Мета дослідження: дослідити особливості кишкового мікробіому в осіб із глютенчутливими захворюваннями, які перебувають на БГД. Матеріали та методи. У дослідження увійшли 25 осіб із непереносимістю глютену, 14 (56 %) із них мали целіакію та 11 (44 %) — НГБЦ, усі дотримувались агліадинової дієти. Уміст у калі Bacteroidetes, Firmicutes, Actinobacteria, інших представників кишкового мікробіому (показник «інші» відображає загальний відсоток усієї бактеріальної ДНК, крім представників, наведених вище) визначали методом полімеразної ланцюгової реакції в реальному часі в генетичній лабораторії Діаген (Київ). Також підраховували співвідношення Firmicutes/Bacteroidetes (F/B). Результати. Уміст бактерій типу Bacteroidetes становив 28.4 (Q1-Q3 9,195–37,83) % у хворих на целіакію та 24,98 (Q1-Q3 9,615–30,597) % у пацієнтів із НГБЦ, p = 0.565; Firmicutes — 53,47 (Q1-Q3 49,98–56,798) та 53,0 (Q1-Q3 48,12–68,53) %, відповідно, p = 0,763; типу Actinobacteria — 4,8 (Q1-Q3 3,82–6,84) й 5,37 (Q1-Q3 4,09–7,77) %, p = 0,572. Було знайдено позитивну кореляцію середньої сили цього показника з тривалістю перебування на агліадиновій дієті (p = 0,397, p = 0,03). Співвідношення F/B дорівнювало 1,996 (Q1-Q3 1,35–6,85) у осіб із целіакією та 2,0 (Q1-Q3 1,65–7,58) у пацієнтів із НГБЦ. Вміст «інших» типів кишкової мікрофлори становив 15,39 (Q1-Q3 7,44–22,33) % у хворих із целіакією та 13,78 (Q1-Q3 10,65–15,58) у пацієнтів із НГБЦ, p = 0.936. Висновки. В осіб із целіакією та НГБЦ спостерігаються суттєві зміни КМ в бік підвищення вмісту Bacteroidetes за рахунок зниження рівнів Firmicutes й Actinobacteria. Співвідношення F/B виявилося настільки ж показовим, наскільки показовою є різниця між його складовими. Ступінь змін у КМ прямо залежить від часу перебування на агліадиновій дієті. Виявлені зміни КМ, найімовірніше, є наслідком особливостей харчування таких хворих, а саме побічним ефектом дотримання БГД.
Background. Intestinal dysbiosis is associated with violating both quantitative and qualitative intestinal microbiome (IM) composition. It accompanies different gastrointestinal disorders, including non-celiac gluten sensitivity (NCGS) and celiac disease (CD). A gluten-free diet is the only existing treatment for CD and NCGS. One of the questions of interest is the characteristics of the IM of patients with gluten-related diseases and its relationship with diet therapy. Materials and methods. The study included 25 adults, 14 (56 %) with CD and 11 (44 %) with NCGS; all were on agliadin diet. We determined the faecal content of the Bacteroidetes, Firmicutes, and Actinobacteria and the rest bacterial DNA (“other” indicator) using the real-time polymerase chain reaction. Results. The Bacteroidetes content was 28.4 (Q1-Q3 9.195–37.83) % in CD and 24.98 (Q1-Q3 9.615–30.597) % in NCGS patients, p = 0.565. Firmicutes content was 53.47 (Q1-Q3 49.98–56.798) % in CD patients and 53.0 (Q1-Q3 48.12–68.53) % in NCGS, p = 0.763. The Actinobacteria content was 4.8 (Q1-Q3 3.82–6.84) % in CD patients and 5.37 (Q1-Q3 4.09–7.77) % in NCGS, p = 0.572. There was a moderate positive correlation with the diet duration (p = 0.397, p = 0.03). The Firmicutes/Bacteroidetes ratio was 1.996 (Q1-Q3 1.35–6.85) in CD patients and 2.0 (Q1-Q3 1.65–7.58) in NCGS patients, p = 0.681. The content of “other” types of IM was 15.39 (Q1-Q3 7.44–22.33) % in CD patients and 13.78 (Q1-Q3 10.65–15.58) % in NCGS patients, p = 0.936. Conclusions. We found similar intestinal microbiome features in patients with celiac disease and non-celiac gluten sensitivity. The detected intestinal microbiome changes are most likely to be a consequence of dietary features in such patients, namely the side effect of maintaining an agliadin diet.
целіакія; безглютенова дієта; непереносимість глютену без целіакії; мікробіом
celiac disease; gluten-free diet; gluten intolerance without celiac disease; microbiome
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Shewry P.R., Hey S.J. The contribution of wheat to human diet and health. Food and Energy Security. 2015. 4(3). 178-202. doi: 10.1002/fes3.64.
- Al-Toma A. et al. European Society for the Study of Coeliac Disease (ESsCD) guideline for coeliac disease and other gluten-related disorders. United European Gastroenterology Journal. 2019. 7(5). 583-613. doi: 10.1177/2050640619844125.
- Губська О.Ю. Способи та алгоритми діагностики та лікування целіакії з урахуванням сучасних діагностичних можливостей регіонів України (Bogomolets National Medical University, 2019). URL: http://ir.librarynmu.com/ handle/123456789/852.
- Губська О.Ю. Целiакiя: поширенiсть, особливостi клiнiчного перебiгу, дiагностики, лiкування та одужання хворих: Дис... д-ра мед. наук: 14.01.36 / Олена Юрiївна Губська. Київ, 2009. 378 с. (Bogomolets National Medical University, 2009).
- Catassi C. et al. Diagnosis of Non-Celiac Gluten Sensitivity (NCGS): The Salerno Experts’ Criteria. Nutrients. 2015. 7(6). 4966-4977. doi: 10.3390/nu7064966.
- Singh P. et al. Global Prevalence of Celiac Disease: Systematic Review and Meta-analysis. Clinical Gastroenterology and Hepatology. 2018. 16(6). 823-836.e2. doi: 10.1016/j.cgh.2017.06.037.
- Cianferoni A. Wheat allergy: diagnosis and management. Journal of Asthma and Allergy. 2016. 13. doi: 10.2147/jaa.s81550.
- Vasagar B. et al. World epidemiology of non-celiac gluten sensitivity. Minerva Gastroenterology. 2017. 63(1). doi: 10.23736/s1121-421x.16.02338-2.
- Bai J.C., Ciacci C. World Gastroenterology Organisation Global Guidelines. Journal of Clinical Gastroenterology. 2017. 51(9). 755-768. doi: 10.1097/mcg.0000000000000919.
- D’Argenio V., Salvatore F. The role of the gut microbiome in the healthy adult status. Clinica Chimica Acta. 2015. 451. 97-102. doi: 10.1016/j.cca.2015.01.003.
- Wang Z.-K. Upper gastrointestinal microbiota and digestive diseases. World Journal of Gastroenterology. 2013. 19(10). 1541. doi: 10.3748/wjg.v19.i10.1541.
- Cukrowska B. et al. Intestinal epithelium, intraepithelial lymphocytes and the gut microbiota — key players in the pathogenesis of celiac disease. World Journal of Gastroenterology. 2017. 23(42). 7505-7518. doi: 10.3748/wjg.v23.i42.7505.
- Bonder M.J. et al. The influence of a short-term gluten-free diet on the human gut microbiome. Genome Medicine. 2016. 8(1). doi: 10.1186/s13073-016-0295-y.
- Zhang B.-W. et al. A Widely Applicable Protocol for DNA Isolation from Fecal Samples. Biochemical Genetics. 2006. 44(11–12). 494-503. doi: 10.1007/s10528-006-9050-1.
- Koliada A. et al. Association between body mass index and Firmicutes/Bacteroidetes ratio in an adult Ukrainian population. BMC Microbiology. 2017. 17(1). doi: 10.1186/s12866-017- –1027-1.
- Kanda Y. Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplantation. 2012. 48(3). 452-458. doi: 10.1038/bmt.2012.244.
- Sanz Y. Microbiome and Gluten. Annals of Nutrition and Metabolism. 2015. 67 (Suppl. 2). 27-42. doi: 10.1159/000440991.
- Transeth E.L., Dale H.F., Lied G.A. Comparison of gut microbiota profile in celiac disease, non-celiac gluten sensitivity and irritable bowel syndrome: a systematic review. Turkish Journal of Gastroentero–logy. 2020. 31(11). 735-745. doi: 10.5152/tjg.2020.19551.
- Garcia-Mazcorro J. et al. First Insights into the Gut Micro–biota of Mexican Patients with Celiac Disease and Non-Celiac Gluten Sensitivity. Nutrients. 2018. 10(11). 1641. doi: 10.3390/nu10111641.
- Dieterich W. et al. Influence of low FODMAP and gluten-free diets on disease activity and intestinal microbiota in patients with non-celiac gluten sensitivity. Clinical Nutrition. 2019. 38(2). 697-707. doi: 10.1016/j.clnu.2018.03.017.