Журнал «Здоровье ребенка» Том 18, №3, 2023
Вернуться к номеру
VEGF-A як маркер ендотеліальної дисфункції в дітей із гострою лімфобластною лейкемією та легеневими ускладненнями
Авторы: N.I. Makieieva (1), V.A. Koval (1), T.A. Kondratiuk (2), T.V. Gorbach (1)
(1) — Kharkiv National Medical University, Kharkiv, Ukraine
(2) — Massachusetts General Hospital, Boston, USA
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
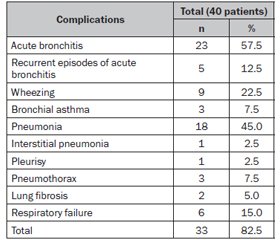
Актуальність. Ендотеліальна дисфункція (ЕД) є характерним патологічним станом у пацієнтів із гострою лейкемією. Оцінка стану ЕД має значення для більш детального розуміння патологічних процесів у легенях дітей із гострою лімфобластною лейкемією (ГЛЛ). Мета: оцінити рівні судинного ендотеліального фактора росту А (VEGF-A) у сироватці крові та його прогностичне значення щодо легеневих ускладнень у дітей із ГЛЛ. Матеріали та методи. Обстежено 40 пацієнтів із ГЛЛ віком 6–17 років. Перша група включала дітей з уперше діагностованою ГЛЛ (n = 18), до 2-ї увійшли пацієнти з ГЛЛ, які закінчили повний курс хіміотерапії (n = 22). Контрольну групу становили 15 здорових дітей. Рівень VEGF-A оцінювали методом імуноферментного аналізу. Результати. В обстежених дітей із ГЛЛ були поширеними легеневі ускладнення: гострий бронхіт (23), повторні епізоди гострого бронхіту (5), пневмонія (18), обструктивний бронхіт (9), бронхіальна астма (3), інтерстиціальна пневмонія (1), плеврит (1), пневмоторакс (3), фіброз легень (2), дихальна недостатність (6). Частота легеневих ускладнень становила 82,5 % під час хіміотерапії та 20,0 % у період ремісії після повного курсу хіміотерапії. Виявлено статистично вірогідне підвищення рівня VEGF-A в 1-й (180,41 (158,16; 200,00) пг/мл) та 2-й групах (165,61 (131,65; 198,45) пг/мл) порівняно з контрольною (130,65 (129,45; 132,15) пг/мл) (p1-К = 0,000011; p2-К= 0,007009). Вірогідних відмінностей у рівнях VEGF-А між 1-ю та 2-ю групами не визначено (p1–2 = 0,338394). За даними проведеного ROC-аналізу, рівень VEGF-A > 198,34 пг/мл після повного завершення курсу хіміотерапії прогностично значущий щодо формування легеневих ускладнень у дітей із ГЛЛ у тривалій ремісії (AUC 0,965; чутливість 100,00 %; специфічність 89,47 %). Висновки. Діти з ГЛЛ мають значну ЕД. Рівень сироваткового VEGF-A може бути прогностичним фактором щодо розвитку легеневих ускладнень у дітей у період ремісії ГЛЛ після завершення повного курсу хіміотерапії.
Background. Endothelial dysfunction (ED) is common in acute leukemia patients. The study of ED can provide more information about pathological processes in lungs of children with acute lymphoblastic leukemia (ALL). The purpose of the study is to assess the levels of vascular endothelial growth factor A (VEGF-A) and its prognostic value for pulmonary complications in children with ALL. Materials and methods. We examined 40 children with ALL aged 6–17 years. Group 1 included children with newly diagnosed ALL (n = 18), group 2 involved ALL survivors, who had completed the total course of chemotherapy (n = 22). The control group consisted of 15 healthy children. The level of VEGF-A in serum was assessed by enzyme-linked immunosorbent assay. Results. Pulmonary complications were common in the examined children with ALL, among them: аcute bronchitis (23), recurrent episodes of acute bronchitis (5), pneumonia (18), wheezing (9), bronchial asthma (3), interstitial pneumonia (1), pleurisy (1), pneumothorax (3), lung fibrosis (2), respiratory failure (6). The frequency of pulmonary complications was 82.5 % during chemotherapy protocols and 20.0 % in ALL survivors after a complete course of chemotherapy. Statistically significant increase in VEGF-A level in groups 1 (180.41 (158.16; 200.00) pg/ml) and 2 (165.61 (131.65; 198.45) pg/ml) compared to controls (130.65 (129.45; 132.15) pg/ml) has been detected (p1-C = 0.000011; p2-C = 0.007009). There were no significant differences in VEGF-А levels between children from experimental groups (p1–2 = 0.338394). According to receiver operator characteristic (ROC) analysis, the level of VEGF-A > 198.34 pg/ml after the complete course of chemotherapy can predict the presence of pulmonary complication in ALL survivors (area under the ROC curve 0.965; sensitivity 100.00 %; specificity 89.47 %). Conclusions. Children with ALL have significant ED. The level of serum VEGF-A can be predictive for pulmonary complications in ALL survivors.
ендотеліальна дисфункція; судинний ендотеліальний фактор росту; легеневі ускладнення; лейкемія; діти
endothelial dysfunction; vascular endothelial growth factor; pulmonary complications; leukemia; children
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Namayandeh S.M., Khazaei Z., Lari Najafi M., Goodarzi E., Moslem A. GLOBAL Leukemia in Children 0–14 Statistics 2018, Incidence and Mortality and Human Development Index (HDI): GLOBOCAN Sources and Methods. Asian Pac. J. Cancer Prev. 2020 May 1. 21(5). 1487-1494. doi: 10.31557/APJCP.2020.21.5.1487.
- Miller K.D., Fidler-Benaoudia M., Keegan T.H., Hipp H.S., Jemal A., Siegel R.L. Cancer statistics for adolescents and young adults 2020. CA: Cancer J. Clin. 2020 Nov. 70(6). 443-459. doi: 10.3322/caac.21637.
- Hunger S.P., Lu X., Devidas M., Camitta B.M., Gaynon P.S. et al. Improved survival for children and adolescents with acute lymphoblastic leukemia between 1990 and 2005: a report from the children’s oncology group. J. Clin. Oncol. 2012 May 10. 30(14). 1663-9. doi: 10.1200/JCO.2011.37.8018.
- Berkman A.M., Andersen C.R., Cuglievan B., McCall D.C., Lupo P.J. et al. Long-Term Outcomes among Adolescent and Young Adult Survivors of Acute Leukemia: A Surveillance, Epidemiology, and End Results Analysis. Cancer Epidemiol. Biomarkers Prev. 2022 Jun 1. 31(6). 1176-1184. doi: 10.1158/1055-9965.EPI-21-1388.
- Canbolat Ayhan A., Timur C., Kalaycik O. A retrospective analysis of complications observed in children with acute lymphoblastic leukemia during chemotherapy. Minerva Pediatr. 2017 Apr. 69(2). 95-105. doi: 10.23736/S0026-4946.16.04239-0.
- Hough R., Vora A. Crisis management in the treatment of childhood acute lymphoblastic leukemia: putting right what can go wrong (emergency complications of disease and treatment). Hematology Am. Soc. Hematol. Educ. Program. 2017 Dec 8. 2017(1). 251-258. doi: 10.1182/asheducation-2017.1.251.
- Stecher S.S., Lippl S., Stemmler H.J., Schreiber J. Lung involvement in hematologic systemic diseases. Internist (Berlin). 2018 Sep. 59(9). 886-897. doi: 10.1007/s00108-018-0471-9 (in German).
- Liu C.Y., Li C. Clinical Features and Risk Factors of Severe Pneumonia in Children With Acute Lymphoblastic Leukemia. Front. Pediatr. 2022 May 6. 10. 813638. doi: 10.3389/fped.2022.813638.
- Evans S.E., Ost D.E. Pneumonia in the neutropenic cancer patient. Curr. Opin. Pulm. Med. 2015 May. 21(3). 260-71. doi: 10.1097/MCP.0000000000000156.
- Choi M.H., Jung J.I., Chung W.D., Kim Y.J., Lee S.E. et al. Acute pulmonary complications in patients with hematologic malignancies. Radiographics. 2014 Oct. 34(6). 1755-68. doi: 10.1148/rg.346130107.
- Abla O., Angelini P., Di Giuseppe G., Kanani M.F., Lau W. et al. Early Complications of Hyperleukocytosis and Leukapheresis in Childhood Acute Leukemias. J. Pediatr. Hematol. Oncol. 2016. 38. 111-117. doi: 10.1097/MPH.0000000000000490.
- Inaba H., Pei D., Wolf J., Howard S.C., Hayden R.T. et al. Infection-related complications during treatment for childhood acute lymphoblastic leukemia. Ann. Oncol. 2017 Feb 1. 28(2). 386-392. doi: 10.1093/annonc/mdw557.
- Mairuhu A.M., Andarsini M.R., Setyoningrum R.A., Cahyadi A., Larasati M.C.S. et al. Hospital acquired pneumonia risk factors in children with acute lymphoblastic leukemia on chemotherapy. Heliyon. 2021 Jun 6. 7(6). e07209. doi: 10.1016/j.heliyon.2021.e07209.
- Vaezi M., Gharib C., Souri M., Ghavamzadeh A. Late complications in acute leukemia patients following HSCT: a single center experience. Int. J. Hematol. Oncol. Stem Cell Res. 2016 Jan 1. 10(1). 1-6.
- Dietz A.C., Chen Y., Yasui Y., Ness K.K., Hagood J.S. et al. Risk and impact of pulmonary complications in survivors of childhood cancer: a report from the Childhood Cancer Survivor Study. Cancer. 2016 Dec 1. 122(23). 3687-3696. doi: 10.1002/cncr.30200.
- Armenian S.H., Landier W., Francisco L., Herrera C., Mills G. et al. Long-term pulmonary function in survivors of childhood cancer. J. Clin. Oncol. 2015 May 10. 33(14). 1592-600. doi: 10.1200/JCO.2014.59.8318..
- Vion A.C., Rautou P.E., Durand F., Boulanger C.M., Valla D.C. Interplay of Inflammation and Endothelial Dysfunction in Bone Marrow Transplantation: Focus on Hepatic Veno-Occlusive Disease. Semin. Thromb. Hemost. 2015 Sep. 41(6). 629-43. doi: 10.1055/s-0035-1556728.
- Doroszko A., Niedzielska E., Jakubowski M., Porwolik J., Turek-Jakubowska A. et al. Endothelial Function in Children with Acute Lymphoblastic Leukemia (ALL) May Reflect the Clinical Outcome. Biomed. Res. Int. 2018 Nov 11. 2018. 7918091. doi: 10.1155/2018/7918091.
- Hagag A.A., Abdel-Lateef A.E., Aly R. Prognostic value of plasma levels of thrombomodulin and von Willebrand factor in Egyptian children with acute lymphoblastic leukemia. J. Oncol. Pharm. Pract. 2014 Oct. 20(5). 356-61. doi: 10.1177/1078155213508439.
- Odynets Y.V., Kondratiuk T.O., Koida M.L. Markers of endothelial dysfunction and their prognostic value in children with acute lymphoblastic leukemia. Inter. Collegas. 2020. 7(1). 10-16.
- Masopustová A., Jehlička P., Huml M., Votava T., Trefil L. et al. Plethysmographic and biochemical markers in the diagnosis of endothelial dysfunction in pediatric acute lymphoblastic leukemia survivors — new applications. Physiol. Res. 2018 Dec 18. 67(6). 903-909. doi: 10.33549/physiolres.933754.
- Sadurska E., Zaucha-Prazmo A., Brodzisz A., Kowalczyk J., Ben-Skowronek I. Premature atherosclerosis after treatment for acute lymphoblastic leukemia in childhood. Ann. Agric. Environ. Med. 2018. 25. 71-76. doi: 10.5604/12321966.1230680.
- Morel S., Léveillé P., Samoilenko M., Franco A., England J. et al. Biomarkers of cardiometabolic complications in survivors of childhood acute lymphoblastic leukemia. Sci. Rep. 2020 Dec 9. 10(1). 21507. doi: 10.1038/s41598-020-78493-x.
- Bruzzi P., Bigi E., Felici F., Lami F., Cano Garcinuno M.D.C. et al. Markers of Inflammation and Endothelial Dysfunction in Young Survivors from Acute Lymphoblastic Leukemia. J. Adolesc. Young Adult Oncol. 2021 Oct. 10(5). 599-605. doi: 10.1089/jayao.2020.0114.
- Sherief L.M., Abd El-Khalek E.R., Libda I.A., Gaber O.A., Kamal N.M. et al. Serum endocan and endothelial dysfunction in childhood acute lymphoblastic leukemia survivors: a tertiary center experience. Ther. Adv. Chronic Dis. 2021 May 25. 12. 20406223211015963. doi: 10.1177/20406223211015963.
- Knudsen L., Ochs M. The micromechanics of lung alveoli: structure and function of surfactant and tissue components. Histochem. Cell. Biol. 2018 Dec. 150(6). 661-676. doi: 10.1007/s00418-018-1747-9.
- El Basset Abo El Ezz A.A., Abd El Hafez M.A., El Amrousy D.M., El Momen Suliman G.A. The predictive value of Von Willebrand factor antigen plasma levels in children with acute lung injury. Pediatr. Pulmonol. 2017 Jan. 52(1). 91-97. doi: 10.1002/ppul.23518.
- Zinter M.S., Delucchi K.L., Kong M.Y., Orwoll B.E., Spicer A.S. et al. Early Plasma Matrix Metalloproteinase Profiles. A Novel Pathway in Pediatric Acute Respiratory Distress Syndrome. Am. J. Respir. Crit. Care Med. 2019 Jan 15. 199(2). 181-189. doi: 10.1164/rccm.201804-0678OC.
- Makieieva N., Malakhova V., Vasylchenko Y., Biriukova M. Is Willebrand Factor Indicative of Chronic Inflammation in Children with Asthma? Turk. Thorac. J. 2020 Nov. 21(6). 362-366. doi: 10.5152/TurkThoracJ.2019.19051.
- Makieieva N., Biriukova M., Alekseeva N. et al. Relationship of inflammatory endothelial markers with the severity of asthma in children. Med. J. (Krag.). 2019. 53(2). 49-54. doi: 10.5937/mckg53-19737.
- Acute Lymphoblastic Leukaemia Intensive Chemotherapy Berlin Frankfurt Munich 2009. A Randomized Trial of the I-BFM-SG for the Management of Childhood non-B Acute Lymphoblastic Leukemia. Final Version of Therapy Protocol from August-14-2009. Available from: http://www.bialaczka.org/wp-content/uploads/2016/10/ALLIC_BFM_2009.pdf.
- Erdur B., Yilmaz S., Oren H., Demircioğlu F., Cakmakç H., Irken G. Evaluating pulmonary complications in childhood acute leukemias. J. Pediatr. Hematol. Oncol. 2008 Jul. 30(7). 522-6. doi: 10.1097/MPH.0b013e31816916e4.
- Landier W., Armenian S.H., Lee J., Thomas O., Wong F.L. et al. Yield of screening for long-term complications using the children’s oncology group long-term follow-up guidelines. J. Clin. Oncol. 2012 Dec 10. 30(35). 4401-8. doi: 10.1200/JCO.2012.43.4951.
- Park S.A., Jeong M.S., Ha K.T., Jang S.B. Structure and function of vascular endothelial growth factor and its receptor system. BMB Rep. 2018 Feb. 51(2). 73-78. doi: 10.5483/bmbrep.2018.51.2.233.
- Song M., Wang H., Ye Q. Increased circulating vascular endothelial growth factor in acute myeloid leukemia patients: a systematic review and meta-analysis. Syst. Rev. 2020 May 6. 9(1). 103. doi: 10.1186/s13643-020-01368-9.