Журнал «Здоровье ребенка» Том 18, №3, 2023
Вернуться к номеру
Значення маркера S100β у дітей із COVID-19
Авторы: I. Seriakova
Bogomolets National Medical University, Kyiv, Ukraine
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
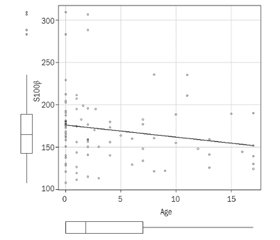
Мета: визначити рівень протеїну S100β у дітей із COVID-19 і дослідити кореляційний зв’язок цього нейробіомаркера з тяжкістю COVID-19 та віком пацієнтів. Матеріали та методи. Проведено ретроспективне когортне обсерваційне постреєстраційне дослідження. Обстежено 88 дітей віком від 1 місяця до 17 років із лабораторно підтвердженим COVID-19, які проходили стаціонарне лікування в КНП «Київська міська дитяча клінічна інфекційна лікарня» у 2021–2022 рр. За перебігом захворювання пацієнтів розділили на дві групи: контрольну, у якій спостерігався ускладнений перебіг COVID-19, та основну групу без ускладнень. Також ми провели розподіл за віковими групами: 0–12 місяців, 1–6, 6–10 та 10–17 років. Враховували основні лабораторні показники, дані анамнезу та об’єктивного обстеження. Під час комплексного рутинного обстеження хворих протягом першої доби перебування в стаціонарі була зібрана сироватка крові з метою її подальшого дослідження щодо рівня нейробіомаркера S100β методом імуноферментного аналізу. Застосовували набір CanAg S100 EIA kit компанії Fujirebio з робочим діапазоном вимірювань 1–3500 нг/л для маркера S100β. Дослідження виконано відповідно до принципів Гельсінської декларації. Протокол дослідження ухвалено локальним етичним комітетом зазначеної в роботі установи. Отримано інформовану згоду батьків та дітей. Під час роботи були використані статистичні й аналітичні методи, метод емпіричного дослідження. Результати. При порівнянні основної та контрольної груп за віком значимим показником виявився вік пацієнтів від народження до 12 місяців (44,8 % в основній групі проти 23,3 % у контрольній), p = 0,049. При проведенні дослідження кореляції нейробіомаркера S100β з D-димером був виявлений лінійний кореляційний зв’язок (r = 0,141; 95% ДІ –1... 0,311; p < 0,1), а також негативний лінійний кореляційний зв’язок — з протромбіновим індексом (r = –0,204; 95% ДІ –1... 0,0131; p = 0,03) та віком (r = –0,184; 95% ДІ –1... 0,0077; р = 0,04). Висновки. Виявлено кореляційний зв’язок між нейробіомаркером S100β, віком та тяжкістю COVID-19. Вищі показники відмічались у групи пацієнтів з ускладненим перебігом захворювання. Виявлено тенденцію до вищого рівня протеїну S100 при меншому віці пацієнтів, а також лінійний зв’язок нейромаркерів із протромбіновим індексом та D-димером.
Background. The purpose of the work was to determine the level of S100β protein in children with COVID-19 and to investigate the correlation of this neurobiomarker with the severity of COVID-19 and the age of the patients. Materials and methods. We conducted a retrospective, cohort, observational, post-registration study. We examined 88 children aged 1 month to 17 years with laboratory-confirmed COVID-19 who underwent inpatient treatment at the Kyiv City Children’s Clinical Infectious Diseases Hospital (Kyiv, Ukraine) in 2021–2022. Children were divided according to the course of the disease into two groups: the control group, which had a complicated course of COVID-19, and the main group without complications. We also made a division by age groups: 0–12 months, 1–6, 6–10 and 10–17 years. The main laboratory indicators, data of anamnesis and objective examination were taken into account. During the comprehensive routine examination of the patients on the first day of their stay in the hospital, the blood serum was collected for further examination for the level of S100β neurobiomarker by enzyme immunoassay. CanAg S100 EIA kit (Fujirebio) with a working measurement range of 1–3500 ng/L for S100β marker was used. The research was carried out in accordance with the Declaration of Helsinki principles. The research protocol was approved by the Local Ethics Committee of the institution mentioned in the work. Informed consent of parents and children was obtained. In the study, we used statistical research, analytical methods, and the method of empirical research. Results. When comparing the main and control groups by age, the age of patients from birth to 12 months was a significant indicator (44.8 % in the main group vs. 23.3 % in controls), p = 0.049. When conducting a study on S100β correlation with D-dimer, a linear correlation was found (r = 0.141; 95% CI –1... 0.311; p < 0.1), as well as a negative linear correlation with prothrombin index (r = –0.204; 95% CI –1... 0.0131; p = 0.03) and age (r = –0.184; 95% CI –1... 0.0077; p = 0.04). Conclusions. A correlation between S100β neurobiomarker, age and severity of COVID-19 was revealed. Higher indicators were noted in the group of patients with a complicated course of the disease. A tendency towards a higher level of protein S100 at a younger age was revealed, as well as a linear relationship of neuromarkers with prothrombin index and D-dimer.
коронавірусна інфекція; COVID-19; нейромаркер; S100β; біомаркер; діти
coronavirus infection; COVID-19; neuromarker; S100β; biomarker; children