Международный эндокринологический журнал Том 19, №3, 2023
Вернуться к номеру
Вплив нанодисперсного оксиду церію на розвиток оксидативного стресу та продукцію оксиду азоту в крові хворих на цукровий діабет 2-го типу
Авторы: Z.O. Shayenko (1, 2), O.E. Akimov (1), K.S. Neporada (1), O.V. Ligonenko (1), M.Ya. Spivak (3)
(1) — Poltava State Medical University, Poltava, Ukraine
(2) — Second City Clinical Hospital of the Poltava City Council, Poltava, Ukraine
(3) — D.K. Zabolotny Institute of Microbiology and Virology of the National Academy of Sciences of Ukraine, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
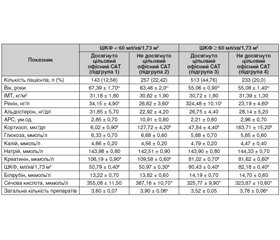
Актуальність. У патогенезі ускладнень цукрового діабету (ЦД) провідну роль, окрім глюкотоксичності, відіграє розвиток оксидативного стресу. З огляду на те, що оксидативний стрес є одним із ключових механізмів виникнення ЦД та призводить до метаболічних порушень в організмі, розглядаються різні підходи до його корекції. Важливими завданнями сучасної діабетології залишаються пошук та впровадження в практичну діяльність патогенетичних лікарських засобів, що можуть впливати на основні ланки ЦД та попереджати його негативні наслідки. Мета дослідження: визначити вплив нанодисперсного оксиду церію (НОЦ) на продукцію оксиду азоту, активність антиоксидантних ферментів та інтенсивність перекисного окиснення ліпідів у крові хворих на цукровий діабет 2-го типу. Матеріали та методи. Дослідження проведене за участі 72 осіб віком від 36 до 66 років, середній вік 55,20 ± 6,82 року, які проходили лікування в КП «Друга міська клінічна лікарня» м. Полтави в період з липня по грудень 2022 року. Пацієнти були розподілені на дві групи: контрольну (n = 35), до якої увійшли особи без цукрового діабету, та експериментальну (n = 37), що включала хворих із діагностованим ЦД 2-го типу. Результати. Використання НОЦ у пацієнтів із ЦД 2-го типу вірогідно знижує активність iNOS у крові на 34,70 % та активність аргіназ на 52,17 % порівняно з рівнем до лікування. Активність супероксиддисмутази за умов застосування нанодисперсного оксиду церію для лікування ЦД 2-го типу зростає на 102,74 %, а активність каталази — на 103,04 % порівняно з цими показниками в експериментальній групі до терапії. Уміст малонового діальдегіду в крові пацієнтів за цих умов вірогідно зменшується (у 2,35 раза) порівняно з показником до лікування. Висновки. Застосування НОЦ у хворих на ЦД 2-го типу приводить до підвищення антиоксидантного захисту та зниження інтенсивності перекисного окиснення ліпідів у крові. НОЦ зменшує продукцію оксиду азоту з індуцибельної ізоформи NO-синтази та послаблює конкуренцію між NO-синтазами й аргіназами за субстрат реакції. Отримані результати дослідження обґрунтовують необхідність включення антиоксидантів у патогенетичну терапію цукрового діабету та його ускладнень.
Background. In the pathogenesis of complications of diabetes mellitus (DM), in addition to glucotoxicity, the development of oxidative stress plays a leading role. Antioxidants have been of great interest for physicians in recent years. Contemporary diabetology have been focused on the search and practical implementation of pathogenetic medications that can affect the main chains of DM and prevent its negative consequences. Purpose of the study is to determine the effect of nanodispersed cerium oxide (NCO) on the production of nitric oxide (NO), the activity of antioxidant enzymes and the intensity of lipid peroxidation in the blood of patients with type 2 diabetes mellitus. Materials and methods. Seventy-two patients aged 36 to 66 years, average age of 55.20 ± 6.82 years, who received treatment at the Municipal Clinical Hospital 2 in Poltava from July to December 2022 have been involved in the study. They have been divided into 2 groups: controls (n = 35), which included people without diabetes; experimental group (n = 37), which consisted of patients diagnosed with type 2 DM. Results. The use of NCO in patients with type 2 DM significantly reduces the activity of inducible NO synthase in the blood by 34.70 % and the activity of arginases by 52.17 % compared to the levels before treatment. The use of nanodispersed cerium oxide in the treatment of type 2 DM increases the activity of superoxide dismutase in the blood by 102.74 %, and the activity of catalase by 103.04 % compared to same indicators in the experimental group before therapy. Notably, blood malondialdehyde was significantly lower (by 2.35 times) compared to the same indicator before treatment. Conclusions. The use of NCO in patients with type 2 diabetes mellitus leads to an increase in antioxidant protection and a decrease in the intensity of lipid peroxidation in blood. NCO reduces the production of nitric oxide from the inducible NO synthase and weakens the competition between NO synthases and arginases for the reaction substrate. The findings of the study justify the need to include antioxidants in the pathogenetic therapy of diabetes mellitus and its complications.
цукровий діабет; нанодисперсний оксид церію; оксидативний стрес; оксид азоту
diabetes mellitus; nanodispersed cerium oxide; oxidative stress; nitric oxide
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Sun H., Saeedi P., Karuranga S., Pinkepank M., Ogurtsova K., Duncan B.B., Stein C. et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022 Jan. 183. 109119. doi: 10.1016/j.diabres.2021.109119.
- Harding J.L., Pavkov M.E., Magliano D.J., Shaw J.E., Gregg E.W. Global trends in diabetes complications: a review of current evidence. Diabetologia. 2019 Jan. 62(1). 3-16. doi: 10.1007/s00125-018-4711-2.
- Sokolova L., Pushkarev V., Pushkarev V., Kovzun O., Tronko M. Diabetes mellitus and atherosclerosis. The role of inflammatory processes in pathogenesis (literature review). International Journal of Endocrinology (Ukraine). 2017. 13(7). 486-498. doi: 10.22141/2224-0721.13.7.2017.115747.
- Tisi A., Pulcini F., Carozza G., Mattei V., Flati V., Passacantando M., Antognelli C. et al. Antioxidant Properties of Cerium Oxide Nanoparticles Prevent Retinal Neovascular Alterations In Vitro and In Vivo. Antioxidants (Basel). 2022 Jun 9. 11(6). 1133. doi: 10.3390/antiox11061133.
- Pérez-Torres I., Manzano-Pech L., Rubio-Ruíz M.E., Soto M.E., Guarner-Lans V. Nitrosative Stress and Its Association with Cardiometabolic Disorders. Molecules. 2020 May 31. 25(11). 2555. doi: 10.3390/molecules25112555.
- Singh A., Kukreti R., Saso L., Kukreti S. Mechanistic Insight into Oxidative Stress-Triggered Signaling Pathways and Type 2 Diabetes. Molecules. 2022 Jan 30. 27(3). 950. doi: 10.3390/molecules27030950.
- Chekalina N.I., Kazakov Y.M., Mamontova T.V., Vesnina L.E., Kaidashev I.P. Resveratrol more effectively than quercetin reduces endothelium degeneration and level of necrosis factor α in patients with coronary artery disease. Wiad. Lek. 2016. 69(3, pt 2). 475-479.
- Skrypnyk I., Maslova G., Lymanets T., Gusachenko I. L-arginine is an effective medication for prevention of endothelial dysfunction, a predictor of anthracycline cardiotoxicity in patients with acute leukemia. Exp. Oncol. 2017 Dec. 39(4). 308-311.
- Saifi M.A., Seal S., Godugu C. Nanoceria, the versatile nanoparticles: promising biomedical applications. J. Control. Release. 2021 Oct 10. 338. 164-189. doi: 10.1016/j.jconrel.2021.08.033.
- Gasparova I., Kubatka P., Opatrilova R., Caprnda M., Filipova S., Rodrigo L., Malan L. et al. Perspectives and challenges of antioxidant therapy for atrial fibrillation. Naunyn Schmiedebergs Arch. Pharmacol. 2017 Jan. 390(1). 1-14. doi: 10.1007/s00210-016-1320-9.
- Khurana A., Tekula S., Godugu C. Nanoceria suppresses multiple low doses of streptozotocin-induced type 1 diabetes by inhibition of Nrf2/NF-κB pathway and reduction of apoptosis. Nanomedicine (London). 2018 Aug 1. 13(15). 1905-1922. doi: 10.2217/nnm-2018-0085.
- Chen Y.H., Rao Z.F., Liu Y.J., Liu X.S., Liu Y.F., Xu L.J., Wang Z.Q. et al. Multifunctional Injectable Hydrogel Loaded with Cerium-–Containing Bioactive Glass Nanoparticles for Diabetic Wound Hea–ling. Biomolecules. 2021 May 8. 11(5). 702. doi: 10.3390/biom11050702.
- Yelins’ka A.M., Akimov O.Y., Kostenko V.O. Role of AP-1 transcriptional factor in development of oxidative and nitrosative stress in periodontal tissues during systemic inflammatory response. Ukr. Biochem. J. 2019. 91(1). 80-85. doi: 10.15407/UBJ91.01.080.
- Gérard-Monnier D., Erdelmeier I., Régnard K., Moze-Henry N., Yadan J.C., Chaudière J. Reactions of 1-methyl-2-phenylindole with malondialdehyde and 4-hydroxyalkenals. Analytical applications to a colorimetric assay of lipid peroxidation. Chem. Res. Toxicol. 1998 Oct. 11(10). 1176-83. doi: 10.1021/tx9701790.
- Ren Y., Li Z., Li W., Fan X., Han F., Huang Y., Yu Y. et al. Arginase: Biological and Therapeutic Implications in Diabetes Mellitus and Its Complications. Oxid. Med. Cell. Longev. 2022 Oct 26. 2022. 2419412. doi: 10.1155/2022/2419412.
- Kaltschmidt C., Greiner J.F.W., Kaltschmidt B. The Transcription Factor NF-κB in Stem Cells and Development. Cells. 2021 Aug 10. 10(8). 2042. doi: 10.3390/cells10082042.
- Casals E., Zeng M., Parra-Robert M., Fernández-Varo G., Morales-Ruiz M., Jiménez W., Puntes V., Casals G. Cerium Oxide Nanoparticles: Advances in Biodistribution, Toxicity, and Preclinical Exploration. Small. 2020 May. 16(20). e1907322. doi: 10.1002/smll.201907322.
- Bashandy M.M., Saeed H.E., Ahmed W.M.S., Ibrahim M.A., Shehata O. Cerium oxide nanoparticles attenuate the renal injury induced by cadmium chloride via improvement of the NBN and Nrf2 gene expressions in rats. Toxicol. Res. (Camb.). 2022 Apr 1. 11(2). 339-347. doi: 10.1093/toxres/tfac009.
- Chen G., Xu Y. Biosynthesis of cerium oxide nanoparticles and their effect on lipopolysaccharide (LPS) induced sepsis mortality and associated hepatic dysfunction in male Sprague Dawley rats. Mater. Sci Eng. C. Mater. Biol. Appl. 2018 Feb 1. 83. 148-153. doi: 10.1016/j.msec.2017.11.014.
- Sulak M., Turgut G.C., Sen A. Cerium Oxide Nanoparticles Biosynthesized Using Fresh Green Walnut Shell in Microwave Environment and their Anticancer Effect on Breast Cancer Cells. Chem. Biodivers. 2022 Aug. 19(8). e202200131. doi: 10.1002/cbdv.202200131.
- Li L., Mao Y., Zhao L., Li L., Wu J., Zhao M., Du W. et al. p53 regulation of ammonia metabolism through urea cycle controls polyamine biosynthesis. Nature. 2019 Mar. 567(7747). 253-256. doi: 10.1038/s41586-019-0996-7.