Вступ
Серед сучасних медико-соціальних проблем –однією з найактуальніших залишається патологія щитоподібної залози (ЩЗ). Це пов’язано, з одного боку, зі значною поширеністю цієї патології, а з іншого — з впливом на всі органи й системи організму у випадку дисгормональних проявів. Так, у структурі ендокринної патології серед дорослого населення міста Києва дифузний нетоксичний зоб I–II ст. становить 35 %, вузловий еути–реоїд–ний зоб — 5 %, дифузний токсичний зоб — 1 %, гіпо–тиреоз — 2 %, тиреоїдити — 4 % [1]. Крім того, рівень захворюваності на дифузний нетоксичний, змішаний і вузловий нетоксичний зоб у нашій країні й усьому світі постійно збільшується [1, 2].
Тиреоїдні розлади поліетіологічні, пов’язані з нестачею йоду в довкіллі, аномалією розвитку, автоімунною патологією, запальним процесом у тканині ЩЗ, природженим дефектом ферментних систем, медикаментозною терапією, впливом несприятливих умов (Чорнобильська катастрофа), особливостей харчування (вживання струмогенних продуктів), дефіцитом мікроелементів та іншими причинами.
Про значну поширеність захворювань ЩЗ свідчить той факт, що при фізикальному обстеженні (пальпації) лікарем-ендокринологом вузли виявляють приблизно в 3–7 % населення. У той же час за допомогою ультразвукового дослідження (УЗД) вдається виявити клінічно невизначені тиреоїдні вузли в 20–76 % людей [3]. Схожі дані отримані й при автопсійних дослідженнях [4].
Епідеміологи відзначають приріст випадків вузлового зоба в США (у 300 000 хворих діагностується щорічно) [5].
Медико-соціальне значення гіпотиреозу визначається не тільки його поширеністю в популяції та тенденцією до подальшого зростання кількості хворих, але також і тим, що гіпофункція ЩЗ призводить до різних органних і нервово-психічних порушень, зниження інтелектуального потенціалу населення і порушення репродуктивної функції в жінок [6].
Більшість вітчизняних та іноземних дослідників пов’язують поширеність захворюваності з хронічним дефіцитом надходження йоду в організм [7]. На жаль, на даний час у нашій країні практично відсутні регіони з адекватним вживанням йоду [8].
Дефіцит йоду і селену сприяє зниженню утворення тиреоїдних гормонів, функціонування тиреоцитів порушується, змінюється їх форма з кубічної на трапецієподібну. Йодний дефіцит змінює співвідношення активних лівообертальних форм тироксину і трийодтироніну на біологічно неактивні правообертальні, що є основою розвитку як субклінічного гіпотиреозу, так і пухлинних і гіперпластичних захворювань ЩЗ. Нестача селену, вітаміну D, заліза призводить до дисфункції імунної системи та сприяє активації генетично детермінованої автоімунної патології, наприклад автоімунного тиреоїдиту або хвороби Грейвса, частота яких завжди вища в дефіцитних регіонах [9].
Загальновідомо, що йод надзвичайно важливий для повноцінного функціонування ЩЗ. Дані численних фундаментальних досліджень з біології, фармакології та клінічної медицини дають підстави стверджувати, що в профілактиці й терапії йододефіцитних станів необхідно враховувати нерозривний зв’язок метаболізму йоду з метаболізмом інших мікроелементів, насамперед селену, що є основним молекулярним синергістом йоду [10].
Важливе значення для функціонування ЩЗ має саме поєднаний прийом йоду і селену. Доведено, що коли йод виступає будівельним матеріалом для гормонів ЩЗ, селен забезпечує їх активацію [11]. За наявності дефіциту інших мікроелементів, у тому числі заліза і цинку, спостерігається гормональний дисбаланс у ЩЗ. Селен корисний і для імунітету, він є природним антиоксидантом, який запобігає окисному стресу [12].
Дефіцит селену асоціюється з такими патологічними змінами ЩЗ, як збільшення її об’єму, зміни ехогенності, виникнення вузлових утворень, а також призводить до зниження її антиоксидантного захисту [9].
Інтенсивність метаболізму йоду також залежить від забезпечення організму цинком [13]. Дефіцит цинку впливає на функцію ЩЗ, і навпаки, гормони ЩЗ впливають на метаболізм цинку. Крім того, дослідження показали, що транспортери цинку наявні в гіпоталамусі, гіпофізі та ЩЗ, однак їх значення залишається нез’ясованим [14]. Оскільки цинк входить до складу понад двох тисяч різних білків, молекулярні механізми його впливу на ЩЗ досить різноманітні. При цьому слід підкреслити, що цинк входить до складу рецептора до трийодтироніну. У структурі цього рецептора були виявлені так звані цинкові пальці — спеціалізовані фрагменти білка, що хелатують цинк [15]. Цинковмісний фермент супероксиддисмутаза забезпечує антиоксидантний захист ЩЗ, а зниження активності цього ферменту збільшує ризик її гіперплазії [16]. Отже, дефіцит селену і цинку посилюється на тлі хронічної йодної недостатності. Адекватне надходження зазначених мікроелементів — важливий аспект профілактики й лікування тиреоїдних захворювань.
Основна мета при лікуванні гіперпластичних захворювань ЩЗ — зупинка росту вузлів; лікування гіпотиреозу (за його наявності); запобігання гормональній «автономізації»; нормалізація розмірів ЩЗ.
Попри значний прогрес у науковому розумінні фі–зіологічних і патологічних процесів, молекулярно-–генетичних механізмів розвитку тиреоїдних захворювань, нехірургічний лікувальний арсенал на сьогодні досить обмежений — препарати гормонів ЩЗ, йоду, селену, тиреостатики та в окремих випадках — глюкокортикоїди.
При цьому загальновідомо, що тиреостатичні засоби (наприклад, тіамазол, карбімазол) мають низку побічних ефектів, що відображено в інструкціях з використання препаратів. У більшості пацієнтів тиреотоксикоз достатньо швидко рецидивує після припинення прийому тиреостатичної терапії (частота становить близько 60 %).
Американська асоціація клінічних ендокринологів підкреслює, що замісна й супресивна гормональна терапія не позбавлена обмежень і небажаних ефектів (підвищений ризик розвитку аритмій серця, остеопорозу тощо) [10]. Згідно із сучасними європейськими рекомендаціями [15], рутинне застосування левотироксину на даний час не рекомендується для пацієнтів з нетоксичним багатовузловим зобом, оскільки підтримка концентрації тиреотропного гормону (ТТГ) біля нижньої межі норми пов’язана з підвищеним ризиком остеопорозу в жінок після менопаузи, а також підвищує виникнення фібриляції передсердь, особливо у хворих віком понад 60 років.
Одним з перспективних засобів у комбінованій терапії дифузного і змішаного доброякісного зоба з гіпотиреозом, еутиреозом чи тиреотоксикозом є фітотерапія. Найчастіше при захворюваннях ЩЗ використовується рослинний препарат на основі кореня перстачу білого (Polentilla alba L.), який на ринку України присутній як дієтична добавка Пантірокс. Окрім перстачу білого, Пантірокс ще містить у своєму складі мікроелементи селен і цинк.
Перстач білий (Potentilla alba L.) має помітну ефективність стосовно впливу на структуру і функцію ЩЗ. Біологічно активна сполука альбінін, що міститься в підземній частині рослини, проявляє тиреотропну й гонадотропну активність, впливає на вироблення ТТГ, який за механізмом зворотного зв’язку впливає на синтез гормонів ЩЗ. Кореневище перстачу білого містить елементарний йод і аніон йодистої кислоти, є природним концентратом мікро- і макроелементів (мідь, цинк, селен, залізо тощо), біологічно активних компонентів, таких як флавоноїди, фенолкарбонові кислоти і сапоніни, що нормалізують обмінні процеси в організмі [16].
Завдяки біофлавоноїду кверцетину, який має виражену антиоксидантну й мембраностабілізуючу активність, забезпечується ефект стабілізації мембран тиреоцитів, регулюється проникність клітин ЩЗ, забезпечується їх захист від шкідливої дії автоантитіл і вільних радикалів, відновлюється рецепторна й гормоновидільна функції мембран тиреоцитів. Основні біологічні діючі речовини перстачу білого мають виражену антиоксидантну, протизапальну, цитостатичну, імуномодулюючу дії, а також покращують мікроциркуляцію крові в тканинах [17].
Вдалою є комбінація фітозасобу перстачу білого із селеном, який є необхідним компонентом для біо–синтезу тиреоїдних гормонів. Селен ефективно знижує рівень антитіл до тиреоїдної пероксидази у хворих на автоімунний тиреоїдит, покращує якість життя пацієнтів з ендокринною орбітопатією.
Крім того, вдалою є комбінація фітозасобу перстачу білого з мінералом селеном, який є необхідним компонентом для біосинтезу тиреоїдних гормонів і коферментом тиреопероксидази [23]. Селен — мікроелемент, що входить до складу ферментів, які відіграють важливу роль у роботі щитоподібної залози, репродуктивної, імунної систем. Селен входить до складу селеновмісних дейодиназ, які перетворюють гормон щитоподібної залози тироксин (Т4) в активну форму трийодтиронін (Т3). Селен бере участь в антиоксидантному захисті організму, активації тиреоїдних гормонів, інгібує процеси апоптозу, моделює імунітет, справляє захисний вплив на цитоплазматичні мембрани, перешкоджає порушенню хромосомного матеріалу, тобто має антимутагенні властивості [23]. Селен ефективно знижує рівень антитіл до тиреопероксидази у хворих з автоімунним тиреоїдитом, поліпшує якість життя пацієнтів з ендокринною офтальмопатією. Мікроелемент входить до складу білкових сполук — селенопротеїнів, які забезпечують адекватне функціонування щитоподібної залози [23].
Мікроелемент цинк входить до складу білкових сполук, що мають різноманітні молекулярні механізми впливу на щитоподібну залозу, у тому числі є компонентом ядерного рецептора гормону трийодтироніну (входить до складу рецептора до Т3), що пояснює необхідність цього мікроелемента для реалізації біологічного ефекту тиреоїдних гормонів. Цинк регулює як синтез, так і механізм дії тиреоїдних гормонів. Концентрація цинку в сироватці крові також впливає на рівень Т3, Т4 і ТТГ у крові [23, 24]. Фермент супероксиддисмутаза, який містить цинк, забезпечує антиоксидантний захист щитоподібної залози [24].
Мета дослідження — оцінка ефективності, безпеки й переносимості фітопрепарату Пантірокс пацієнтами з дифузним і змішаним зобом на фоні лікування левотироксином (при гіпотиреозі) чи тиреостатичної терапії (при тиреотоксикозі), а також порівняння отриманих даних з показниками групи хворих, які отримували виключно традиційну терапію.
Крім того, метою даної роботи було оцінити ефективність монотерапії фітопрепаратом Пантірокс у хворих з еутиреоїдним дифузним та змішаним доброякісним зобом, порівнюючи з групою пацієнтів, які знаходяться під спостереженням без застосування протокольної терапії.
Матеріали та методи
Під спостереженням перебувало дві групи хворих. Основна група — 126 хворих на дифузний і змішаний зоб (31 — дифузний зоб, еутиреоз; 21 — дифузний зоб, гіпотиреоз; 52 — змішаний зоб, еутиреоз; 22 — дифузний зоб, тиреотоксикоз). Середній вік хворих становив 42,21 ± 2,12 року (від 19 до 74 років). Усім пацієнтам було проведено УЗД на апараті Toshiba 240S TOSBEE (Японія) у динаміці: враховувалися об’єм ЩЗ, наявність і розмір вузлів. При УЗД досліджували динаміку вказаних параметрів з плином часу для аналізу ефективності проведеної терапії. Усім пацієнтам з вузловими утвореннями ЩЗ за показаннями проводилася тонкоголкова аспіраційна пункційна біопсія (ТАПБ) вузлів для підтвердження доброякісного генезу вогнищевих утворень. Хворі з малігнізованими чи підозрілими вузлами виключалися з дослідження і спрямовувалися для подальшого хірургічного лікування. Усім пацієнтам проводилося вивчення гормонального статусу ЩЗ: рівень вільного тироксину, вільного трийодтироніну, ТТГ, антитіл до тиреоглобуліну і тиреоїдної пероксидази в крові. Хворі з підвищеним рівнем антитіл з дослідження виключалися.
Проводили оцінку ефективності проведеної терапії за такими критеріями:
— стабільність еутиреоїдного стану і швидкість його досягнення;
— швидкість компенсації гіпотиреозу й тиреотоксикозу;
— контроль рівнів вільного тироксину, вільного трийодтироніну, ТТГ.
Для компенсації гіпотиреозу використовували препарати левотироксину в середній дозі 1,46 мкг/кг/добу. При лікуванні тиреотоксикозу застосовували препарати метилтіоурацилу, тіамазолу, карбімазолу.
В основній групі хворим призначали препарат Пантірокс (одна капсула містить 350 мг чистого екстракту перстачу білого; 70 мкг елементарного селену в перерахунку з натрію селеніту; 12 мг цинку бісгліцинату) по одній капсулі двічі на добу незалежно від прийому їжі загальним курсом лікування 2 місяці.
До контрольної групи увійшли 270 пацієнтів: 45 пацієнтів з дифузним зобом, еутиреозом (динамічне спостереження); 45 — зі змішаним зобом, еутиреозом (динамічне спостереження); 45 — з дифузним зобом, еутиреозом (терапія левотироксином); 45 — з гіпотиреозом (замісна терапія левотироксином); 45 — зі змішаним зобом, еутиреозом (терапія левотироксином); 45 — із хворобою Грейвса (тиреостатична терапія). Динамічне спостереження за вищевказаними показниками проводилося на початку дослідження і через 2,5 місяця.
Результати та обговорення
Під впливом проведеного лікування відбулися зміни в клінічній симптоматиці в основній і контрольних групах. Так, у пацієнтів з гіпотиреозом при відновленні тиреоїдного статусу зменшувалися млявість, швидка втомлюваність, сонливість, сухість шкіри, набряки обличчя, випадіння волосся; покращувалася пам’ять. У пацієнтів з хворобою Грейвса зменшувалися тремор, пітливість, покращився емоційний стан.
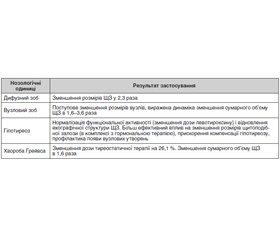
При аналізі основної та контрольних груп з дифузним зобом, гіпотиреозом відзначалася компенсація гіпотиреозу в 90,5 і 84,4 % хворих відповідно (p > 0,05). Але при порівнянні динаміки розмірів зоба було виявлено вірогідно більш значне зменшення сумарного об’єму ЩЗ (у 2,3 раза) в основній групі порівняно з контрольною: 3,5 ± 0,3 см3 і 1,5 ± 0,2 см3 відповідно (p < 0,05). Отже, додавання в схему традиційної терапії препарату Пантірокс (перстач білий, селен і цинк) у хворих на дифузний зоб, гіпотиреоз дозволяє більш ефективно зменшувати розміри зоба при однаково ефективній компенсації гіпотиреозу. У групі пацієнтів з дифузним зобом у стані еутиреозу при динамічному спостереженні було виявлено більш значне зменшення об’єму ЩЗ в основній групі порівняно з контрольною, але без статистичної вірогідності через невелику кількість хворих основної групи — 2,6 ± 1,2 см3 і 1,1 ± 0,6 см3 відповідно (p > 0,05). З іншого боку, порівняння основної і контрольної груп пацієнтів з дифузним зобом в стані еутиреозу, які отримували терапію левотироксином, виявило, що в основній групі лікування було вірогідно більш ефективним щодо нормалізації розмірів ЩЗ: 3,9 ± 0,4 см3 і 2,9 ± 0,2 см3 відповідно (p < 0,05).
Також слід відзначити, що в половини хворих після лікування покращилась ехографічна структура тканини ЩЗ.
Отже, доповнення традиційної терапії дифузного зоба фітопрепаратом Пантірокс приводить до зменшення розмірів зоба і сприяє поліпшенню суб’єктивного самопочуття хворих.
У групі хворих зі змішаним зобом в стані еути–реозу, які приймали тільки препарат Пантірокс, отримано вірогідно значиме зменшення сумарного об’єму ЩЗ порівняно з контрольною групою: 2,9 ± 0,6 см3 і 0,8 ± 0,2 см3 відповідно (p < 0,05). Але розміри вогнищевих утворень за 2,5–3 місяці спостережень не змінювалися.
Аналогічні дані були отримані і в групі хворих зі змішаним зобом у стані еутиреозу, які приймали терапію левотироксином. Зменшення сумарного розміру ЩЗ за даними УЗД в основній групі було більш вираженим: 4,0 ± 0,6 см3 і 2,5 ± 0,4 см3 відповідно (p < 0,05). Також, як і в попередній групі пацієнтів, вірогідної зміни вогнищевих утворень не знайдено.
Отже, фітопрепарат перстачу білого із селеном і цинком Пантірокс викликав вірогідно більш значиме зменшення розмірів ЩЗ у пацієнтів зі змішаним зобом в стані еутиреозу порівняно з пацієнтами, які знаходилися виключно під спостереженням чи застосовували терапію левотироксином. Роль і місце використання фітопрепарату перстачу білого із селеном і цинком для зменшення вогнищевих утворень у ЩЗ потребує подальшого вивчення на більшій групі пацієнтів, а також, за нашу думку, період спостереження у 2,5–3 місяці є недостатнім для кінцевих і більш вірогідних висновків.
У групі пацієнтів із хворобою Грейвса, які отримували традиційну терапію одночасно з препаратами перстачу білого із селеном і цинком (Пантірокс), частина пацієнтів, яка досягала компенсації, була вірогідно більшою, ніж у контрольній групі хворих, які прий–мали виключно тиреостатичну терапію: 77,2 ± 9,7 % і 51,1 ± 6,1 % відповідно (p < 0,05). Крім того, в основній групі відбулося вірогідно більш значне зменшення розмірів зоба порівняно з контрольною групою: 4,3 ± 0,7 см3 і 2,7 ± 0,4 см3 відповідно (p < 0,05). Отже, доповнення традиційної тиреостатичної терапії в па–цієнтів із хворобою Грейвса фітопрепаратом, що містить перстач білий із селеном і цинком, прискорює досягнення компенсації тиреотоксикозу й полегшує перебіг захворювання як щодо гормональних характеристик, так і щодо зменшення розмірів зоба.
Результати використання фітопрепарату Пантірокс наведені в табл. 1.
Додавання препарату Пантірокс є невід’ємною частиною дієтичних рекомендацій для комплексного протокольного лікування доброякісної тиреоїдної патології. Пантірокс є природним джерелом йоду і потрібних мікроелементів, селену і цинку. Ефективний як у профілактиці патології ЩЗ, так і в комплексному лікуванні хворих з вузловим і багатовузловим зобом, дифузним зобом, гіпотиреозом, тиреотоксикозом.
Основним патофізіологічним поясненням такої ефективності впливу комплексу біофлавоноїдів і мікроелементів є стабілізація мембран тиреоцитів.
Висновки
1. У результаті проведеного аналізу отримано вірогідний позитивний лікувальний ефект у групі хворих, які застосовували фітопрепарат Пантірокс, що містить раціональне співвідношення коріння перстачу білого, селену і цинку. Експертна думка полягає в тому, що Пантірокс сприяє нормалізації функціонального стану і збереженню балансу гормонів щитоподібної залози. Під впливом дієтичного фітокомплексу у хворого значно поліпшується симптоматика тиреотоксикозу (зменшується розмір щитоподібної залози, зникає тремор пальців рук і поліпшується емоційний стан пацієнта).
2. Фітопрепарат перстачу білого із селеном і цинком Пантірокс при використанні не викликає жодної серйозної побічної дії упродовж всього курсу лікування, що є демонстрацією високого профілю безпеки й можливості його використання у хворих для тривалого лікування як дієтичної добавки.
3. Фітопрепарат перстачу білого із селеном і цинком Пантірокс може бути рекомендований для монотерапії чи комбінованої консервативної терапії дифузного та змішаного еутиреоїдного зоба, а також у комплексному лікуванні хвороби Грейвса і гіпотиреозу як дієтична добавка.
4. З огляду на відносно невелику кількість хворих у нашій серії та невеликий період спостереження, на нашу думку, є раціональним подальше вивчення застосування даної комбінації перстачу білого з селеном і цинком для оптимізації ведення хворих і вивчення найбільш ефективних схем лікування за допомогою фітопрепаратів на основі перстачу білого.
Конфлікт інтересів. Не заявлений.
Отримано/Received 16.04.2023
Рецензовано/Revised 04.05.2023
Прийнято до друку/Accepted 09.05.2023

/51.jpg)