Вступ
Контроль больового синдрому й запалення в ортопедо-травматологічних пацієнтів є важливою та багатокомпонентною проблемою, що вимагає індивідуального підходу з урахуванням патогенетичних механізмів виникнення болю, дотримання принципів ефективності, безпеки й адекватності лікування. Неадекватний підхід до лікування гострого больового синдрому часто призводить до хронізації болю і формування вогнища патологічного больового збудження в центральній нервовій системі (ЦНС) [1–3].
Відповідно до існуючих класифікацій болю післятравматичний і післяопераційний біль може бути гострим, ноцицептивним і полімодальним, він включає соматичну, вісцеральну й нейрогенну складові. Це визначає необхідність застосування мультимодальної фармакотерапії з метою гальмування аферентного потоку больової імпульсації на різних рівнях її поширення шляхом використання лікарських засобів, що впливають на різні ланки ноцицептивної системи. Препаратами, які доцільно включати в комбіновані схеми знеболювання в пацієнтів із посттравматичним больовим синдромом, є місцеві анестетики, нестероїдні протизапальні препарати (НПЗП) з переважно периферичним і/або центральним механізмом дії, наркотичні аналгетики, кетамін у субнаркотичних дозах, психотропні препарати, антиконвульсанти. Традиційне застосування опіатів і опіоїдів у сучасній хірургічній практиці є ефективним, однак зумовлює ризик розвитку таких побічних ефектів, як депресія дихання, пригнічення моторики шлунково-кишкового тракту, жовчовивідних шляхів і сечового міхура. У лікуванні слабкого соматогенного больового синдрому ефективними є НПЗП, що мають периферичний механізм дії і справляють ефект у зоні первинного пошкодження і/або запалення, але вони можуть викликати гастропатичний та ульцерогенний вплив і навіть у терапевтичних дозах можуть виявляти нефротоксичність і гепатотоксичність. Також інтенсивніший больовий синдром часто не може бути адекватно усунутим за допомогою виключно НПЗП з периферичним механізмом дії, що вимагає застосування ад’ювантних аналгетичних засобів [1–3].
Питання адекватного знеболювання в післяопераційному періоді залишається актуальним [1, 5]. За даними літератури, від значного й помірного больового синдрому в післяопераційному періоді страждають майже 75 % усіх прооперованих пацієнтів [2, 6]. При цьому біль після оперативних втручань на кістках і суглобах за інтенсивністю посідає друге місце після операцій на органах черевної порожнини, а неадекватна аналгезія спостерігається в 30–50 % пацієнтів [1, 6]. Вищевказане призводить до продовження періоду іммобілізації та терміну перебування пацієнта в стаціонарі, віддаляє його активізацію, збільшує частоту повторних госпіталізацій і підвищує ризик виникнення інфекційних ускладнень і розвитку хронічного больового синдрому. Крім того, важливо зазначити, що неадекватна аналгезія зводить нанівець усі переваги дорогих сучасних малоінвазивних хірургічних втручань [1–3].
Згідно із сучасною фізіологічною класифікацією болю виділяють ноцицептивний біль, що поділяється на соматичний і вісцеральний, невропатичний біль, або комплексний регіонарний больовий синдром І і ІІ типу (периферичний і центральний), а також психогенний біль. У пацієнтів із травматичними пошкодженнями опорно-рухового апарату, а також після перенесених хірургічних втручань має місце саме ноцицептивний соматичний больовий синдром. Ноцицептивний біль — це гострий біль, що виникає внаслідок подразнення периферичних больових рецепторів при травмі, а також може виникати de novo як результат дегенеративного ураження, запалення, ішемії або метаболічних змін [2, 3].
Сучасні тенденції післяопераційної аналгезії характеризуються обмеженням традиційного призначення опіоїдних аналгетиків, що обумовлено не тільки підвищенням вимог до суворого обліку наркотичних аналгетиків, але й наявністю побічних ефектів (особливо в осіб похилого і старечого віку), що виявляються в пригніченні дихання, гіподинамії, нудоті, блюванні, затримці сечі, шкірному свербінні, лікарській залежності. Упродовж останніх 10 років спостерігається широке застосування сучасних, найбільш ефективних неопіоїдних аналгетиків, нестероїдних протизапальних препаратів з центральним і периферичним механізмом дії і внутрішньовенного парацетамолу. Частота їх застосування варіює від 45 до 99 % [1–3, 5, 10]. На сьогодні значного поширення набула методика періопераційної мультимодальної аналгезії, а також комплексне післяопераційне знеболювання з одночасним призначенням декількох знеболювальних препаратів і ад’ювантних засобів для впливу на різні механізми формування больового синдрому і профілактики побічних реакцій з боку аналгетиків. Розроблені методики з вибором оптимальних поєднань аналгетиків і ад’ювантних засобів дозволяють суттєво зменшити токсичну дію НПЗП, парацетамолу, опіатів [2].
Згідно із сучасними уявленнями, існує 4 провідних механізми формування болю.
Трансдукція, або формування імпульсу в больових рецепторах. За відсутності пошкодження тканин больові рецептори «мовчать». Пошкодження тканин викликає активацію цих рецепторів і виділення комплексу медіаторів запалення і болю, що відіграють провідну роль у формуванні больової імпульсації. Повторна активація больових рецепторів викликає зміни як у центральній, так і в периферичній нервовій системі.
Трансмісія, або передача больового імпульсу по безмієлінових С-волокнах і тонких мієлінових Аd-волокнах у задні роги спинного мозку. Перервавши передачу імпульсу на якомусь з етапів від тканин до спинного мозку, можна не допустити інформацію про біль у ЦНС.
Модуляція, або сприйняття і модифікація больового імпульсу в спинному й головному мозку. Це складний і багаторівневий процес, завдяки цьому механізму інформація про больовий імпульс кваліфікується за ступенем важливості для організму і спрямовується в численні центри спинного й головного мозку для подальшого формування поведінкової відповіді. Велика кількість центрів ЦНС втягується в роботу як при нетривалій, але інтенсивній больовій імпульсації, так і при тривалому збереженні больової імпульсації.
Перцепція, або формування почуття болю, що відбувається в головному мозку.
Зв’язки між дійовими центрами, що виникли в ЦНС у відповідь на біль, можуть функціонувати досить довго. Навіть після того, як пошкоджена тканина давно загоїлася, складний комплекс відповіді на біль продовжує функціонувати, а в разі формування хронічного больового синдрому це відбувається роками.
На різні етапи формування больового синдрому можуть впливати різні групи препаратів. Етап формування імпульсу (трансдукція) — точка прикладання нестероїдних протизапальних засобів з переважним периферичним механізмом дії (кеторолаку трометамін). Етап передачі імпульсу (трансмісія) — місцеві анестетики, що покликані не допустити поширення больового сигналу в ЦНС. Це один з найбільш пато-
гномонічних і ефективних шляхів знеболювання — не пригнічувати вже діючі центри болю в ЦНС, а перешкоджати їх формуванню. Етап модуляції — опіоїдні аналгетики, НПЗП з переважним центральним впливом і парацетамол. Змінюючи сприйняття болю, вони, однак, не можуть усунути вже існуючі осередки збудження в ЦНС, а відповідно, і формування патологічних механізмів відповіді на больову імпульсацію. На формування почуття болю (перцепція) впливають психотропні препарати, антиконвульсанти і, певною мірою, опіоїдні аналгетики.
Одним з ефективних засобів контролю й лікування больового синдрому помірної інтенсивності в пацієнтів у ранньому післяопераційному періоді є кеторолаку трометамін. Кеторолаку трометамін інгібує синтез простагландинів і вважається аналгетиком переважно периферичної дії, ефективність якого при больовому синдромі помірної інтенсивності можна порівняти з наркотичними аналгетиками. Крім того, за даними деяких досліджень було показано, що кеторолаку трометамін також впливає на рецептори в ЦНС і на процеси модуляції болю, що забезпечує потужний аналгетичний ефект [8–10]. При цьому кеторолак не має відомого впливу на опіатні рецептори. Після застосування кеторолаку трометаміну в контрольованих клінічних дослідженнях не спостерігалося явищ, які б свідчили про пригнічення дихання, препарат не спричиняє звуження зіниць.
Мета роботи: оцінити ефективність аналгетичної дії ін’єкційної форми кеторолаку трометаміну (Кетанікс) у травматологічних пацієнтів у ранньому післяопераційному періоді порівняно із застосуванням наркотичного аналгетика в ідентичної категорії пацієнтів.
Матеріали та методи
Дослідження проводилось на базі кафедри травматології та ортопедії Національного медичного університету імені О.О. Богомольця у ДУ «Інститут травматології та ортопедії НАМН України» у двох клінічних групах пацієнтів. За дизайном клінічне дослідження було проспективним нерандомізованим, відкритим у паралельних групах. У межах даного дослідження було проведено комплексне лікування й обстеження 40 пацієнтів. Проведення дослідження ухвалено на засіданні комісії з біоетики (протокол № 4 від 12.03.2023).
Досліджувані групи пацієнтів були ідентичні за статевим і віковим складом, тяжкістю первинної травми й хірургічного втручання. Післяопераційний больовий синдром у пацієнтів у групах спостереження також був подібним, а саме помірної та помірно-високої інтенсивності за оцінкою за візуальною аналоговою шкалою болю (ВАШ).
Перед включенням до груп спостереження всі пацієнти надавали поінформовану згоду щодо участі в клінічному дослідженні.
У першій групі пацієнтів, основній групі клінічного спостереження (n1 = 20: закритий перелом кісточок гомілки (тип 44 В і С), стан після відкритої репозиції і стабільно-функціонального (СФ) металоостеосинтезу (МОС) — 10 пацієнтів; стан після відновлення латеральної групи зв’язок гомілковостопного суглоба — 10 пацієнтів), базове знеболювання в післяопераційному періоді упродовж 3–5 діб проводилося із застосовуванням в/м ін’єкційної форми кеторолаку трометаміну (Кетанікс) 30 мг/1 мл через кожні 10–12 годин, а як ад’ювантний препарат було застосовано парацетамол в/в 1000 мг 1 раз на добу (табл. 1).
/33.jpg)
У другій групі пацієнтів, групі порівняння (n2 = 20: закритий перелом кісточок гомілки типу 44 В і С, стан після відкритої репозиції та СФ МОС — 10 пацієнтів; стан після відновлення латеральної групи зв’язок гомілковостопного суглоба — 10 пацієнтів), базове знеболювання в післяопераційному періоді упродовж 3–5 діб проводилося із застосовуванням ін’єкційної форми промедолу 20 мг/1 мл 1 раз на добу, а як ад’ювантний препарат, аналогічно до основної групи, було застосовано парацетамол з відповідним дозуванням і режимом уведення (табл. 1).
Тривалість дослідження становила 5 діб.
Клінічне обстеження пацієнтів проводилося щоденно (пацієнти перебували на стаціонарному лікуванні) до початку застосування препарату й упродовж 1–5-ї доби лікування з фіксацією таких критеріїв і параметрів оцінки болю:
— оцінка болю за числовою рейтинговою шкалою (NRS), аналог візуальної аналогової шкали, з фіксацією інтенсивності болю через 3–4 год після застосування препарату, але перед застосуванням ад’ювантного засобу (парацетамолу);
— оцінка швидкості настання знеболювального ефекту;
— оцінка тривалості знеболювального ефекту (час до наступної вимоги аналгетика);
— оцінка тривалості застосування знеболювання;
— облік побічних ефектів і небажаних проявів при застосуванні препарату.
Критерії включення пацієнтів у дослідження були такими:
1. Вік пацієнтів 25–60 років.
2. Відсутність алергічних реакцій або гіперчутливості до кеторолаку трометаміну, ацетамінофену або компонентів цих препаратів.
3. Відсутність у момент обстеження активної пептичної виразки або нещодавньої шлунково-кишкової кровотечі на фоні виразкової хвороби в анамнезі.
4. Відсутність бронхіальної астми в анамнезі, активної бронхіальної астми, риніту, ангіоневротичного набряку або кропив’янки, спричинених застосуванням ацетилсаліцилатів або інших НПЗП.
5. Відсутність помірних або тяжких форм серцево-судинної недостатності, ниркової, печінкової недостатності, коагулопатії.
6. Відсутність застосування інших НПЗП або знеболювальних препаратів.
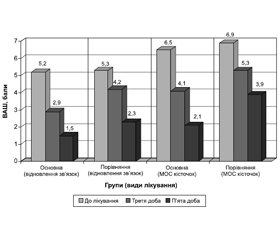
7. Больовий синдром помірної та помірно-високої інтенсивності в пацієнтів після травми або хірургічного втручання, що за оцінкою ВАШ становить 40–70 мм (рис. 1).
Методика проведення знеболювання в післяопераційному періоді. Застосування препаратів в основній групі відбувалось у такій послідовності. Після закінчення операції та відновлення чутливості в кінцівках кожні 10–12 годин пацієнту призначався Кетанікс у дозі 30 мг/1 мл в/м, а в проміжках між його застосуванням внутрішньовенно вводили парацетамол у дозі 1000 мг. Кеторолаку трометамін (Кетанікс) застосовували двічі на добу, парацетамол — 1–2 рази на добу, Отже, добова доза кеторолаку трометаміну (Кетанікс) становила 60 мг, парацетамолу — 1000–2000 мг.
У групі порівняння застосування препаратів відбувалося за такою схемою. Один раз на добу пацієнтам призначався наркотичний аналгетик Промедол-ЗН у дозі 20 мг/1,0 мл в/м. У проміжках між його застосуванням внутрішньовенно вводили парацетамол у дозі 1000 мг, отже, добова доза парацетамолу становила 1000–2000 мг.
У групі плацебо-контролю пацієнтам тричі на добу вводили парацетамол у дозі 1000 мг, а інтраназально застосовували плацебо за аналогічною до основної групи схемою.
Результати та обговорення
Ефективність застосування післяопераційного знеболювання в групах порівняння оцінювали за динамікою зменшення інтенсивності больового синдрому, що визначалася за NRS, а також за швидкістю настання знеболювального ефекту, тривалістю знеболювального ефекту (час до наступної вимоги аналгетика), тривалістю застосування знеболювання (в межах 5 діб), наявністю небажаних побічних проявів. Зведені показники оцінки в групах порівняння подані в табл. 2.
/35.jpg)
Оцінка результатів лікування пацієнтів за NRS засвідчила, що в основній групі пацієнтів, у якій у складі післяопераційної аналгезії застосовувався кеторолаку трометамін (Кетанікс), динаміка зменшення больового синдрому упродовж 5 діб була вірогідно кращою (p < 0,05), ніж у групі порівняння. Так, в основній групі середній показник інтенсивності болю в підгрупі відновного лікування латеральної групи зв’язок гомілковостопного суглоба становив 2,5 ± 0,6 бала, що в 1,4 раза менше, ніж в аналогічній підгрупі групи порівняння. Подібна ситуація була і в підгрупах пацієнтів, яким виконувався стабільно-функціональний остеосинтез з приводу перелому кісточок гомілки (табл. 2, рис. 2).
При оцінюванні швидкості настання знеболювального ефекту в основній групі пацієнтів відносно групи порівняння статистично вірогідних відмінностей виявлено не було (p > 0,05). При цьому середній термін настання знеболювального ефекту в обох клінічних групах становив 27,0 ± 1,5 хв, що в цілому відповідає результатам інших клінічних досліджень і спостережень (табл. 2).
Щодо тривалості знеболювання, що визначалася часом, через який пацієнт потребував повторного введення аналгетика, то в основній групі пацієнтів відносно групи порівняння визначено статистично вірогідну різницю (p < 0,05) з переважанням тривалості знеболювального ефекту. Варто зазначити, що в день хірургічного втручання, а також упродовж першої та другої доби тривалість знеболювального ефекту була дещо меншою, ніж на третю-п’яту добу. Така тенденція визначалася в усіх підгрупах і є логічною, оскільки в перші дні больовий синдром природно є інтенсивнішим, а отже, і тривалість знеболювання може бути меншою. При цьому, оскільки статистичної різниці між тривалістю знеболювання щодобово ми не отримали, порівняння даного параметра оцінки проводили за середніми значеннями, що отримали за весь період спостереження (5 діб). Так, у підгрупах пацієнтів, у яких виконувалося хірургічне відновлення латеральної групи зв’язок, застосування ін’єкційної форми кеторолаку трометаміну (Кетанікс) в основній групі забезпечувало знеболювальний ефект середньою тривалістю 7,9 ± 0,8 год, тоді як при застосуванні наркотичного аналгетика в групі порівняння середній час комфортного знеболювання становив 5,6 ± 0,8 год. У підгрупах пацієнтів, яким виконували металоостеосинтез із приводу перелому кісточок гомілки зі зміщенням, через більшу інтенсивність больового синдрому, тяжкість травми і травматичність операції тривалість знеболювання в основній групі була меншою — 7,2 ± 0,9 год, тоді як у групі порівняння середня тривалість знеболювання становила 5,4 ± 0,7 год. Отже, за тривалістю знеболювання в досліджених категорій пацієнтів з больовим синдромом помірної інтенсивності кращий ефект має кеторолаку трометамін порівняно з промедолом (табл. 2, рис. 3).
/36.jpg)
Оцінка тривалості застосування післяоперацйної аналгезії в групах порівняння засвідчила, що в основній групі загальний час потреби пацієнтів у знеболюванні був незначно меншим, ніж у пацієнтів групи порівняння, однак статистичної різниці в групах виявлено не було. Середній термін знеболювання, якого потребували пацієнти в групах спостереження, становив 4,0 ± 0,3 доби в основній групі та 4,4 ± 0,3 доби в групі порівняння (табл. 2). У подальшому в пацієнтів обох груп необхідності в систематичному знеболюванні не було. За потреби пацієнтам призначали пероральні знеболювальні препарати з групи НПЗП на вимогу.
/36_2.jpg)
Аналіз частоти і характеру виникнення побічних ефектів і небажаних проявів застосування аналгетичних препаратів у порівнюваних групах виявив, що при застосуванні ін’єкційної форми кеторолаку трометаміну (Кетанікс) упродовж 5-денного курсу лікування в основній групі в 3 (15 %) пацієнтів спостерігалися такі явища, як диспепсія та біль у животі, сонливість, а також підвищена кровоточивість з боку післяопераційної рани в одного пацієнта. У групі порівняння побічні ефекти й небажані явища спостерігалися в 5 (25 %) пацієнтів. Вони були переважно пов’язані з диспептичними розладами (нудота), сонливістю і головним болем, а також випадками порушення сечовипускання. Зафіксовані пацієнтами побічні прояви зумовили відмову від подальшого застосування обраного методу знеболювання у 2 двох пацієнтів в основній групі на п’яту добу лікування. Водночас у групі порівняння аналогічна ситуація (відмова від подальшого застосування знеболювання через побічні небажані явища) виникла в 5 пацієнтів: в 1 пацієнта на третю добу, у 3 пацієнтів — на четверту добу і ще в одного пацієнта — на 5-ту добу лікування (табл. 3).
Висновки
1. Аналіз отриманих результатів показав, що застосування ін’єкційної форми кеторолаку трометаміну в ортопедо-травматологічних пацієнтів у ранньому післяопераційному періоді дозволяє досягти ефективного рівня знеболювання за такими критеріями, як вираженість аналгезії, швидкість настання ефекту і його тривалість.
2. Засвідчено переваги застосування ін’єкційної форми кеторолаку трометаміну перед наркотичним аналгетиком промедолом у складі комплексної аналгезії, в аспекті ефективності й тривалості знеболювання. Водночас за критеріями швидкості настання знеболювального ефекту й необхідного терміну лікування кеторолаку трометамін не відрізняється від наркотичних аналгетиків. Це пов’язано з доведеною потужною протизапальною та знеболювальною дією кеторолаку як на периферії, у вогнищі патологічного процесу (вплив на процес трансдукції), так і на рівні ЦНС (вплив на процеси модуляції болю).
3. Аналіз побічних ефектів і небажаних явищ в групах клінічного спостереження показав меншу частоту і вираженість даних ефектів при застосуванні кеторолаку трометаміну порівняно з наркотичним аналгетиком промедолом, що доводить перевагу його застосування в ортопедо-травматологічних пацієнтів у разі больового синдрому помірної вираженості та за умови відсутності протипоказань.
4. Вибір схеми і підбір препаратів для ефективної і безпечної післяопераційної аналгезії повинні виконуватися індивідуально, з урахуванням зони оперативного втручання, вираженості больового синдрому, часового періоду знеболювання, коморбідності та інших особливостей пацієнта.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.
Матеріал призначений для співробітників сфери охорони здоров’я.
Отримано/Received 31.07.2023
Рецензовано/Revised 11.08.2023
Прийнято до друку/Accepted 16.08.2023
/34.jpg)

/33.jpg)
/35.jpg)
/36.jpg)
/36_2.jpg)