Журнал «Здоровье ребенка» Том 18, №5, 2023
Вернуться к номеру
Сучасне лікування епілептичних енцефалопатій у дітей раннього віку: удосконалення прецизійного персоніфікованого напряму
Авторы: Кирилова Л.Г. (1), Мірошников О.О. (1), Абатуров О.Є. (2), Медведовська Н.В. (3), Антипкін Ю.Г. (1), Бондаренко Н.Ю. (1)
(1) — ДУ «Інститут педіатрії, акушерства і гінекології ім. акад. О.М. Лук’янової НАМН України», м. Київ, Україна
(2) — Дніпровський державний медичний університет, м. Дніпро, Україна
(3) — Науково-координаційне управління, Національна академія медичних наук України, м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
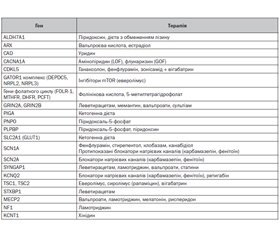
Актуальність. Лікування епілептичних нападів у дітей раннього віку, особливо з епілептичними енцефалопатіями (ЕЕ), є складним завданням, яке в сучасних умовах вимагає застосування персоніфікованого прецизійного, превентивного медичного супроводу. Сучасний діагностичний алгоритм при ЕЕ обов’язково має включати генетичне обстеження методом секвенування наступного покоління (NGS), що дає можливість призначити таргетну терапію залежно від генетичної етіології розладу. У статті подано результати наукових досліджень ефективності застосування сучасної таргентної терапії епілептичних енцефалопатій у дітей раннього віку з генетичною етіологією. Матеріали та методи. У дослідження було включено 58 дітей віком 0–3 роки з клінічними проявами епілептичних енцефалопатій, дебютом нападів на першому році життя зі встановленою генетичною етіологією. У всіх дітей були ідентифіковані патогенні варіанти в генах, пов’язаних з розвитком епілептичних нападів, за допомогою методу NGS. Дослідження включало оцінку неврологічного статусу, збір анамнезу, оцінку семіології та визначення типу нападів, оцінку розвитку і скринінг розладів аутистичного спектра у віці 18 і 24 міс., відеоелектроенцефалографію під час нічного сну, магнітно-резонансну томографію головного мозку, оцінку ефективності лікування, яке отримувала дитина. Результати. З 58 дітей з ЕЕ, яким були призначені протиепілептичні препарати, 10 дітей (17,2 %) отримували монотерапію, 40 дітей (69 %) отримували комбіновану терапію з двох протиепілептичних препаратів, а 8 дітей (13,8 %) — комбіновану терапію з трьох і більше протиепілептичних препаратів. Найчастіше застосовувалися леветирацетам (31 дитина), препарати солей вальпроєвої кислоти (20 дітей), топірамат (11 дітей) і вігабатрин (10 дітей). В усіх обстежених дітей з ЕЕ ми намагалися використовувати схеми таргетної (персоналізованої) протиепілептичної терапії, орієнтовані на генетичну етіологію розладу. У дітей з туберозним склерозом, викликаним мутаціями в генах TSC1 і TSC2, у схеми протиепілептичної терапії включався вігабатрин (50–150 мг/кг на день), який показав ефективність у 75,0 % дітей з інфантильними спазмами (9/12). При недостатній ефективності лікування додатково в схему лікування включалися кортикостероїди (адренокортикотропний гормон або преднізолон), які виявили ефективність у 66,7 % дітей (4/6). У дітей з мутаціями гена SCN1A застосовувалась комбінована терапія з включенням препаратів вальпроєвої кислоти, топірамату й клобазаму або вальпроатів з леветирацетамом і кортикостероїдами, яка показала ефективність у зниженні частоти нападів у 100 % дітей.
Background. Treatment of epileptic seizures in young children, especially with epileptic encephalopathies (EE), is a difficult task, which is impossible in modern conditions without the use of a personified (precision) therapy. The diagnostic algorithm for EE must include genetic examination by the next-generation sequencing, which makes it possible to prescribe targeted therapy depending on the genetic etiology of the disorder. The article presents the results of own research on the effectiveness and approaches to targeted therapy of genetic epileptic encephalopathies in young children. Materials and methods. Fifty-eight children aged 0–3 years with clinical manifestations of epileptic encephalopathies, onset of seizures in the first year of life and diagnosed genetic etiology were included in the study. Pathogenic variants in genes associated with the development of epileptic seizures were identified in all children using the next-generation sequencing. The study included assessment of neurological status, history collection, evaluation of semiology and seizure type, development and screening for autism spectrum disorders at the age of 18 and 24 months, video-electroencephalography during night sleep, magnetic resonance imaging of the brain, assessment of antiepileptic treatment received by the child. Results. Of 58 children with EE who were prescribed antiepileptic drugs, 10 (17.2 %) received monotherapy, 40 patients (69 %) received combined therapy with two anticonvulsants, and 8 children (13.8 %) — combined therapy with three or more anticonvulsants. Levetiracetam (31 patients), valproic acid salt preparations (20 cases), topiramate (11 children) and vigabatrin (10 cases) were most used antiepileptic drugs. In all examined patients with EE, we used schemes of targeted (personalized) antiepileptic therapy focused on the genetic etiology of the disorder. In children with tuberous sclerosis caused by mutations in the TSC1 and TSC2 genes, vigabatrin (50–150 mg/kg per day) was included in the antiepileptic therapy and showed efficacy in 75.0 % (9/12) of children with infantile spasms. Corticosteroids (adrenocorticotropic hormone or prednisone) were additionally included in the treatment regimen and showed effectiveness in 66.7 % of cases (4/6). In children with mutations in SCN1A gene, combined therapy including valproic acid, topiramate and clobazam, or valproic acid with levetiracetam and corticosteroids was used, which showed effectiveness in reducing the frequency of seizures in 100 % of cases. Conclusions. Epileptic encephalopathies are a heterogeneous group of genetic disorders in young children that are difficult to treat and often have a malignant course. Since standard antiepileptic drugs are often insufficiently effective in epileptic encephalopathies, the use of targeted therapy drugs and alternative treatments such as hormone therapy are extremely important. The goal of treatment for epileptic encephalopathies is not only to control seizures, but also to prevent the development of neurological and cognitive deficits and restore lost functions.
діти; персоналізована терапія; таргетна терапія; генетичні епілепсії; епілептичні енцефалопатії; секвенування наступної генерації; розлади нейророзвитку; туберозний склероз; синдром Драве
children; personalized therapy; targeted therapy; genetic epilepsies; epileptic encephalopathies; next generation sequencing; neurodevelopmental disorders; tuberous sclerosis; Dravet syndrome
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- König I.R., Fuchs O., Hansen G., von Mutius E., Kopp M.V. What is precision medicine? The European respiratory journal. 2017. 50(4). 1700391. https://doi.org/10.1183/13993003.00391-2017.
- Лукьянова Е.М., Тараховский М.Л., Андрущук А.А. и др. Фармакотерапия в педиатрии. Под ред. Е.М. Лукьяновой, М.Л. Тараховского. К.: Здоров’я, 1980. 344 с.
- Jameson J.L., Longo D.L. Precision medicine — personalized, problematic, and promising. N. Engl. J. Med. 2015. 372. 2229-2234.
- McGrath S., Ghersi D. Building towards precision medicine: empowering medical professionals for the next revolution. BMC Med. Geno–mics. 2016. 9. 23. Google Scholar.
- Naithani N., Sinha S., Misra P., Vasudevan B., Sahu R. Precision medicine: Concept and tools. Med. J. Armed. Forces India. 2021 Jul. 77(3). 249-257. doi: 10.1016/j.mjafi.2021.06.021. Epub 2021 Jul 3. PMID: 34305276; PMCID: PMC8282508.
- Hood L., Rowen L. The Human Genome Project: big science transforms biology and medicine. Genome Med. 2013 Sep 13. 5(9). 79. doi: 10.1186/gm483. PMID: 24040834; PMCID: PMC4066586.
- de Biase D., Fassan M., Malapelle U. Next-Generation Sequencing in Tumor Diagnosis and Treatment. Diagnostics (Basel, Switzerland). 2020. 10(11). 962. https://doi.org/10.3390/diagnostics10110962.
- Oates J.T., Lopez D. Pharmacogenetics: An Important Part of Drug Development with A Focus on Its Application. International Journal of Biomedical Investigation. 2018. 1(2). 111. https://doi.org/10.31531/2581-4745.1000111.
- Johnson K.B., Wei W.Q., Weeraratne D., Frisse M.E., Misulis K., Rhee K., Zhao J., Snowdon J.L. Precision Medicine, AI, and the Future of Personalized Health Care. Clinical and Translational Science. 2021. 14(1). 86-93. https://doi.org/10.1111/cts.12884.
- Koivisto A.P., Belvisi M.G., Gaudet R. et al. Advances in TRP channel drug discovery: from target validation to clinical studies. Nat. Rev. Drug Discov. 2022. 21. 41-59. https://doi.org/10.1038/s41573-021-00268-4.
- Specchio N., Curatolo P. Developmental and epileptic encephalopathies: what we do and do not know. Brain: a Journal of Neurology. 2021. 144(1). 32-43. https://doi.org/10.1093/brain/awaa371.
- Bartolini E. Inherited Developmental and Epileptic Encephalopathies. Neurology international. 2021. 13(4). 555-568. https://doi.org/10.3390/neurolint13040055.
- Vera-González A. Pathophysiological Mechanisms Underlying the Etiologies of Seizures and Epilepsy. In: Czuczwar S.J., editor. Epilepsy [Internet]. Brisbane (AU): Exon Publications. 2022 Apr 2. Chapter 1. https://www.ncbi.nlm.nih.gov/books/NBK580618/. doi: 10.36255/exon-publications-epilepsy-pathopysiology.
- Stafstrom C.E., Kossoff E.M. Epileptic Encephalopathy in Infants and Children. Epilepsy Currents. 2016. 16(4). 273-279. https://doi.org/10.5698/1535-7511-16.4.273.
- Blazekovic A., Gotovac Jercic K., Meglaj S., Duranovic V., Prpic I., Lozic B. et al. Genetics of Pediatric Epilepsy: Next-Generation Sequencing in Clinical Practice. Genes. 2022. 13(8). 1466. https://doi.org/10.3390/genes13081466.
- Nieh S.E., Sherr E.H. Epileptic encephalopathies: new genes and new pathways. Neurotherapeutics: the Journal of the American Society for Experimental NeuroTherapeutics. 2014. 11(4). 796-806. https://doi.org/10.1007/s13311-014-0301-2.
- Nashaba M., Al Qahtani X.S., Almakdob S., Altwaijri W., Ba-Armah D.M., Hundallah K. et al. The landscape of early infantile epileptic encephalopathy in a consanguineous population. Seizure. 2019. 69. 154-172. https://doi.org/10.1016/j.seizure.2019.04.018.
- Кирилова Л.Г., Мирошников А.А., Юзва А.А. Эпилептические энцефалопатии у детей с расстройствами аутистического спектра: от молекулярно-генетической диагностики до таргетной терапии. Психиатрия, психотерапия и клиническая психология. 2021. 12(2). 249-259.
- Johannessen Landmark C., Potschka H., Auvin S., Wilm–shurst J.M., Johannessen S.I., Kasteleijn-Nolst Trenité D., Wirrell E.C. The role of new medical treatments for the management of developmental and epileptic encephalopathies: Novel concepts and results. Epilepsia. 2021 Apr. 62(4). 857-873. doi: 10.1111/epi.16849. Epub 2021 Feb 27. PMID: 33638459.
- Knowles J.K., Helbig I., Metcalf C.S., Lubbers L.S., Isom L.L., Demarest S. et al. Precision medicine for genetic epilepsy on the horizon: Recent advances, present challenges, and suggestions for continued progress. Epilepsia. 2022. 63(10). 2461-2475. https://doi.org/10.1111/epi.17332.
- Singh A., Hadjinicolaou A., Peters J.M., Salussolia C.L. Treatment-Resistant Epilepsy and Tuberous Sclerosis Complex: Treatment, Maintenance, and Future Directions. Neuropsychiatric Disease and Treatment. 2023. 19. 733-748. https://doi.org/10.2147/NDT.S347327.
- Samanta D. Improving Management of Infantile Spasms by Adopting Implementation Science. Neuropediatrics. 2020. 51(6). 377-388. https://doi.org/10.1055/s-0040-1716901
- Cho M.J., Kwon S.S., Ko A., Lee S.T., Lee Y.M., Kim H.D. et al. Efficacy of Stiripentol in Dravet Syndrome with or without SCN1A Mutations. Journal of Clinical Neurology (Seoul, Korea). 2018. 14(1). 22-28. https://doi.org/10.3988/jcn.2018.14.1.22.
- Ding J., Li X., Tian H., Wang L., Guo B., Wang Y. et al. –SCN1A Mutation-Beyond Dravet Syndrome: A Systematic Review and Narrative Synthesis. Frontiers in Neurology. 2021. 12. 743726. https://doi.org/10.3389/fneur.2021.743726.
- Strzelczyk A., Schubert-Bast S. A Practical Guide to the Treatment of Dravet Syndrome with Anti-Seizure Medication. CNS Drugs. 2022. 36(3). 217-237. https://doi.org/10.1007/s40263-022-00898-1.
- Dreischmeier E., Zuloaga A., Kotloski R.J., Karasov A.O., Gidal B.E. Levetiracetam-associated irritability and potential role of vitamin B6 use in veterans with epilepsy. Epilepsy & Behavior Reports. 2021. 16. 100452. https://doi.org/10.1016/j.ebr.2021.100452.
- Daneshyar S., Ghiasian M., Moradi S., Khanlarzadeh E. Efficacy of levetiracetam, lamotrigine and sodium valproate on seizure attacks and EEG disorders in patients with juvenile myoclonic epilepsy: A double blind randomized clinical trial. Caspian Journal of Internal Medicine. 2022. 13(3). 617-622. https://doi.org/10.22088/cjim.13.3.617.
- Chaudhry N., Patidar Y., Puri V. Mitochondrial myopathy, encephalopathy, lactic acidosis, and stroke-like episodes unveiled by valproate. Journal of pediatric neurosciences. 2013. 8(2). 135-137. https://doi.org/10.4103/1817-1745.117847.
- Yasir M., Goyal A., Sonthalia S. Corticosteroid Adverse Effects. [Updated 2022 Jul 4]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-. https://www.ncbi.nlm.nih.gov/books/NBK531462; https://www.ncbi.nlm.nih.gov/books/NBK531462.