Журнал «Здоровье ребенка» Том 18, №5, 2023
Вернуться к номеру
Вплив саплементації вітаміну D на частоту і перебіг рекурентних респіраторних захворювань у дітей
Авторы: Марушко Ю.В., Єсипова С.І., Гищак Т.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
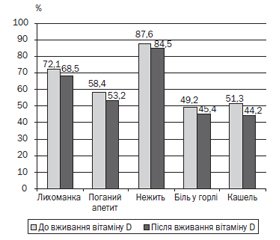
Актуальність. Рецидивний і тривалий перебіг респіраторних інфекцій призводить до формування хронічних вогнищ запалення, персистування вірусів, порушення фізичного і психомоторного розвитку, зниження імунітету дитини. З огляду на участь вітаміну D (ВD) у регуляції імунної відповіді організму вивчення його ролі в розвитку й перебігу рекурентних респіраторних захворювань у дітей залишається актуальним. Мета: дослідження впливу саплементації вітаміну D на частоту і перебіг рекурентних респіраторних захворювань у дітей. Матеріали та методи. Обстежено 52 дитини з рекурентними респіраторними захворюваннями віком від 4 до 10 років. Провели обстеження дітей до і після саплементації вітаміну D за критеріями дослідження — середня частота епізодів гострих респіраторних інфекцій (ГРІ) за рік, вираженість клінічних проявів епізоду ГРІ, середня тривалість, частота призначень антибіотиків та амбулаторних відвідувань лікаря. Результати. Встановлено, що на початку обстеження рівень 25(OH)D у сироватці крові коливався від 11,1 до 29,9 нг/мл, серед них у 22 (42,3 %) дітей спостерігали дефіцит ВD. Аналіз частоти епізодів ГРІ на рік показав, що саме діти з дефіцитом ВD хворіли частіше, ніж діти з достатнім рівнем ВD (p < 0,001). За результатами дослідження встановлено, що саплементація ВD сприяє зниженню частоти епізодів ГРІ з 8,7 ± 1,7 раза на рік до 6,8 ± 1,2 раза на рік (p < 0,001), зменшенню середньої кількості симптомів епізоду ГРІ за рік з 5,5 ± 0,5 до 4,5 ± 0,5 і їх проявів з 9,2 до 7,41 бала (p < 0,001), зменшенню тривалості епізоду ГРІ з 6,0 ± 1,7 дня до 5,7 ± 1,5 дня (р = 0,003), а також зменшенню кількості відвідувань амбулаторного лікаря з 5 до 4 (р = 0,004) і призначень антибіотиків з 61 до 38 (p < 0,001). Висновки. Саплементація ВD покращує перебіг респіраторних захворювань у дітей. Дослідження виконано відповідно до принципів Гельсінської декларації. Протокол дослідження ухвалено локальним етичним комітетом зазначеної в роботі установи. На проведення досліджень отримано інформовану згоду батьків дітей.
Background. Recurrent and prolonged course of respiratory infections leads to the formation of chronic foci of inflammation, the persistence of viruses, impaired physical and psychomotor development, and a decrease in the child’s immunity. Given the participation of vitamin D (VD) in the regulation of the body’s immune response, the study of its role in the development and course of recurrent respiratory diseases in children remains relevant. The purpose is to study the effect of vitamin D supplementation on the frequency and course of recurrent respiratory diseases in children. Materials and methods. We examined 52 children with recurrent respiratory infections aged 4 to 10 years. Children were examined before and after VD supplementation according to the study criteria: the average frequency of acute respiratory infection (ARI) episodes per year, the severity of the clinical manifestations of ARI episode, its average duration, the frequency of antibiotic prescriptions and outpatient visits to the doctor. Results. It was found that at the beginning of the examination, the level of 25(OH)D in the blood serum ranged from 11.1 to 29.9 ng/ml, 22 (42.3 %) children had VD deficiency. An analysis of the frequency of ARI episodes per year showed that children with VD deficiency were ill more often than children with a sufficient level of VD (p < 0.001). According to the results of the study, it was found that VD supplementation contributes to a decrease in the frequency of ARI episodes from 8.7 ± 1.7 to 6.8 ± 1.2 times a year (p < 0.001), a decrease in the average number of symptoms of an episode of acute respiratory infections per year from 5.5 ± 0.5 to 4.5 ± 0.5 and their manifestations from 9.2 to 7.41 points (p < 0.001), a decrease in the duration of ARI episode from 6.0 ± 1.7 to 5.7 ± 1.5 days (p = 0.003), as well as a decrease in the number of outpatient visits from 5 to 4 (p = 0.004) and antibiotic prescriptions from 61 to 38 (p < 0.001). Conclusions. VD supplementation improves the course of respiratory diseases in children. The study was carried out in accordance with the Declaration of Helsinki principles. The study protocol was adopted by the ethics committee of the institution indicated in the work. The informed consent of the children’s parents was obtained.
вітамін D; діти; дефіцит; рекурентні респіраторні захворювання
vitamin D; children; deficiency; recurrent respiratory diseases
Вступ
Матеріали та методи
Статистична обробка результатів
Результати
/27.jpg)
Обговорення
Висновки
- Abioye A., Bromage S., Fawzi W. Effect of micronutrient supplements on influenza and other respiratory tract infections among adults: a systematic review and meta-analysis. BMJ Global Health. 2021. 6(1). e003176. https://doi.org/10.1136/bmjgh-2020-003176.
- Антипкін Ю.Г., Чумаченко Н.Г., Лапшин В.Ф., Уманець Т.Р. Динаміка захворюваності та частоти бронхолегеневої патології у дітей. Сучасна педіатрія. 2016. 2(74). 73-77.
- Arihiro S., Nakashima A., Urashima M. Randomized Trial of Vitamin D Supplementation to Prevent Seasonal Influenza and Upper Respiratory Infection in Patients With Inflammatory Bowel Disease. Inflammatory bowel diseases. 2019. 25(6). 1088-1095. https://doi.org/10.1093/ibd/izy346.
- Asghari A., Bagheri Z., Jalessi M., Salem M.M., Amini E., Ghaleh–Baghi S., Bakhti S. Vitamin D Levels in Children with Adenotonsillar Hypertrophy and Otitis Media with Effusion. Iran J. Otorhinolaryngol. 2017. 29(90). 29-33.
- Atrushi A.M. The association of subclinical Vitamin D deficiency with severe acute lower respiratory infection in children under 5 years in Duhok. Med. J. Babylon. 2019. 16. 271-5.
- Berry D.J., Hesketh K., Power C. Vitamin D status has a linear association with seasonal infections and lung function in British adults. Br. J. Nutr. 2011. 106(9). 1433-1440. https://doi.org/10.1017/S0007114511001991.
- Brealey J.C., Sly P.D., Young P.R., Chappell K.J. Viral bacterial co-infection of the respiratory tract during early childhood. FEMS microbiology letters. 2015. 362(10). fnv062. https://doi.org/10.1093/femsle/fnv062.
- Bouillon R., Antonio L. Nutritional rickets: Historic overview and plan for worldwide eradication. The Journal of steroid biochemistry and molecular biology. 2020. 198. 105563. https://doi.org/10.1016/j.jsbmb.2019.105563.
- Cantorna M.T., Snyder L., Lin Y.D., Yang L. Vitamin D and 1,25(OH)2D regulation of T-cells. Nutrients. 2015. 7(4). 3011-3021. https://doi.org/10.3390/nu7043011.
- Charoenngam N., Holick M.F. Immunologic Effects of Vitamin D on Human Health and Disease. Nutrients. 2020. 12(7). 2097. https://doi.org/10.3390/nu120 72097.
- Chowdhury F., Shahid A., Chisti M.J. Vitamin D supplementation among Bangladeshi children under-five years of age hospitalised for severe pneumonia: A randomised placebo controlled trial. PloS one. 2021. 16(2). e0246460. https://doi.org/10.1371/journal.pone.0246460.
- Collak A., Bozaykut A., Demirel B., Sezer R.G., Seren L.P., Dogru M. Serum vitamin D levels in children with recurrent tonsillopharyngitis. North Clin. Istanb. 2014. 1(1). 13-18.
- Dehn Lunn A. Reducing inappropriate antibiotic prescribing in upper respiratory tract infection in a primary care setting in Kolkata, India. BMJ Open Quality. 2018. 7. e000217. DOI: 10.1136/bmjoq-2017-000217.
- Gupta P., Dewan P., Shah D., Sharma N., Bedi N., Kaur I.R., Bansal A.K., Madhu S.V. Vitamin D Supplementation for Treatment and Prevention of Pneumonia in Under-five Children: A Randomized Double-blind Placebo Controlled Trial. Indian pediatrics. 2016. 53(11). 967-976.
- Haugen J., Basnet S., Hardang I.M., Sharma A., Mathisen M., Shrestha P. et al. Vitamin D status is associated with treatment failure and duration of illness in Nepalese children with severe pneumonia. Pediatr. Res. 2017. 82(6). 986-993.
- Гур’янов В.Г., Лях Ю.Є., Парій В.Д., Короткий О.В., Чалий О.В., Чалий К.О., Цехмістер Я.В. Посібник з біостатистики. Аналіз результатів медичних досліджень у пакеті EZR (R-statistics): Навчальний посібник. Київ: Вістка, 2018. 208 с.
- Jacobs B., Young N.L., Dick P.T., Ipp M.M., Dutkowski R., Davies H.D. et al. Canadian Acute Respiratory Illness and Flu Scale –(CARIFS): development of a valid measure for childhood respiratory infections. Journal of Clinical Epidemiology. 2000. 53(8). 793-799.
- Jadhav S.A., Khanwelkar C.C., Jadhav A., Seshla S. Vitamin D supplementation in the prevention of recurrent acute respiratory tract infections in children aged < 5 years. Journal of Medical Sciences. 2021. 41. 129-133.
- Jesenak M., Ciljakova M., Rennerova Z., Babusikova E., Banovci P. Recurrent Respiratory Infections in Children — Definition, Diagnostic Approach, Treatment and Prevention. Bronchitis. 2011. doi: 10.5772/19422.
- Jolliffe D.A., Camargo C.A., Sluyter J.D., Aglipay M., Aloia J.F., Ganmaa D., Martineau A.R. Vitamin D supplementation to prevent acute respiratory infections: a systematic review and meta-analysis of aggregate data from randomised controlled trials. The lancet Diabetes & Endocrinology. 2021. 9(5). 276-292.
- Kanda Y. Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone marrow transplantation. 2013. 48(3). 452-458. https://doi.org/10.1038/bmt.2012.244.
- Karatekin G., Kaya A., Salihoğlu Ö., Balci H., Nuhoğlu A. Association of subclinical vitamin D deficiency in newborns with acute lower respiratory infection and their mothers. Eur. J. Clin. Nutr. 2009. 63(4). 473-477. https://doi.org/10.1038/sj.ejcn.1602960.
- Kongsbak M., von Essen, M.R., Levring T.B., Schjerling P., Woetmann A., Ødum N., Bonefeld C.M., Geisler C. Vitamin D-binding protein controls T cell responses to vitamin D. BMC immunology. 2014. 15. 35. https://doi.org/10.1186/s12865-014-0035-2.
- Квашніна Л. Рекурентні респіраторні інфекції у дітей: особливості медичного супроводу. Ваше здоров’я: Всеукраїнська медична газета. 2020. https://www.vz. kiev.ua/rekurentni-respiratorni-infektsiyi-u-ditej-osoblyvosti-medychnogo-suprovodu.
- Labib J.R., Ibrahem S.K., Ismail M.M., Fatah S.A.M.A.E., Sedrak A.S., Attia M.A.S., El-Hanafi H.M., Kamel M.H. Vitamin D supplementation and improvement of pneumonic children at a tertiary pediatric hospital in Egypt: A randomized controlled trial. Medicine. 2021. 100(13). e25011. https://doi.org/10.1097/MD.0000000000025011.
- Manaseki-Holland S., Maroof Z., Bruce J., Mughal M.Z., Masher М.І., Chandramohan D. et al. Effect on the incidence of pneumonia of vitamin D supplementation by quarterly bolus dose to infants in Kabul: a randomised controlled superiority trial. Lancet (London, England). 2012. 379(9824). 1419-1427.
- Mandal A., Sahi P.K. Serum Vitamin D Levels in Children with Recurrent Respiratory Infections and Chronic Cough: Correspondence. Indian J. Pediatr. 2017. 84(2). 172-173.
- Martineau A.R., Jolliffe D.A., Greenberg L. et al. Vitamin D supplementation to prevent acute respiratory infections: individual participant data meta-analysis. Health technology assessment (Winchester, England). 2019. 23(2). 1-44. https://doi.org/10.3310/hta23020.
- Марушко Ю.В., Єсипова С.І., Гищак Т.В., Бойко Н.С. Забезпеченість вітаміном D та вплив його дефіциту на перебіг алергічних захворювань у дітей. Сучасна педіатрія. Україна. 2022. 6(126). 101-108.
- Марушко Ю.В., Гищак Т.В. Профілактика дефіциту вітаміну D у дітей. Стан проблеми у світі та Україні. Сучасна педіатрія. Україна. 2021. 4(116). 36-45.
- Марушко Ю.В., Єсипова С.І., Гищак Т.В. Вплив забезпечення вітаміном D на перебіг гострих респіраторних інфекцій у дітей. Сучасна педіатрія. Україна. 2021. 7(119). 73-80.
- McAllister D.A., Liu L., Shi T., Chu Y., Reed C., Burrows J. et al. Global, regional, and national estimates of pneumonia morbidity and mortality in children younger than 5 years between 2000 and 2015: a systematic analysis. Lancet Glob. Health. 2019. 7. e47-57.
- O’Connor R., O’Doherty J., O’Regan A., Dunne C. Antibiotic use for acute respiratory tract infections (ARTI) in primary care; what factors affect prescribing and why is it important? A narrative review. Ir. J. Med. Sci. 2018. 187. 969-986. 10.1007/s11845-018-1774-5.
- Özdemir B., Köksal B.T., Karakaş N.M., Tekindal M.A., Özbek Ö.Y. Serum Vitamin D Levels in Children with Recurrent Respiratory Infections and Chronic Cough. Indian Journal of Pediatrics. 2016. 83(8). 777-782. https://doi.org/10.1007/s12098-015-2010-1.
- Pham H., Rahman A., Majidi A., Waterhouse M., Neale R.E. Acute Respiratory Tract Infection and 25-Hydroxyvitamin D Concentration: A Systematic Review and Meta-Analysis. Int. J. Environ. Res. Public Health. 2019. 16(17). 3020. Published 2019 Aug 21.
- Raniszewska A., Górska E., Kotuła I., Stelmaszczyk-Emmel A., Popko K., Ciepiela O. Recurrent respiratory tract infections in children — analysis of immunological examinations. Central-European Journal of Immunology. 2015. 40(2). 167-173. https://doi.org/10.5114/ceji.2015.52830.
- Roth D.E., Shah R., Black R.E., Baqui A.H. Vitamin D status and acute lower respiratory infection in early childhood in Sylhet, Bangladesh. Acta Paediatr. 2010. 99(3). 389-393. https://doi.org/10.1111/j.1651-2227.2009. 01594.
- Sabetta J.R., DePetrillo P., Cipriani R.J., Smardin J., Burns L.A., Landry M.L. Serum 25-hydroxyvitamin d and the incidence of acute viral respiratory tract infections in healthy adults. PLoS One. 2010. 5(6). e11088. https://doi.org/10.1371/journal.pone.0011088.
- Shahmiri M., Enciso M., Adda C.G., Smith B.J., Perugini M.A., Mechler A. Membrane Core-Specific Antimicrobial Action of Cathelicidin LL-37 Peptide Switches Between Pore and Nanofibre Formation. Scientific reports. 2016. 6. 38184. https://doi.org/10.1038/srep38184.
- Sousa F.H., Casanova V., Findlay F., Stevens C., Svoboda P., Pohl J., Proudfoot L., Barlow P.G. Cathelicidins display conserved direct antiviral activity towards rhinovirus. Peptides. 2017. 95. 76-83. https://doi.org/10.1016/j.peptides.2017.07.013.
- Troeger C., Blacker B., Khalil I.A., Rao P.C., Cao J., Zimsen S.R.M. et al. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect. Dis. 2018. 18. 1191-210.
- Vertegel A.A., Ovcharenko L.S. The vitamin D sufficiency in children with recurrent bronchitis. Georgian Med. News. 2014. (231). 55-9.
- Wagner C.L., Greer F.R., American Academy of Pediatrics Section on Breastfeeding, & American Academy of Pediatrics Committee on Nutrition. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents. Pediatrics. 2008. 122(5). 1142-1152. https://doi.org/10.1542/peds.2008-1862.
- Wayse V., Yousafzai A., Mogale K., Filteau S. Association of subclinical vitamin D deficiency with severe acute lower respiratory infection in Indian children under 5 y. Eur. J. Clin. Nutr. 2004. 58(4). 563-567. https://doi.org/10.1038/sj.ejcn.1601845.
- Williams M.R., Greene G., Naik G., Hughes K., Butler C.C., Hay A.D. Antibiotic prescribing quality for children in primary care: an observational study. British Journal of General Practice. 2018. 68. e90-e96. doi: 10.3399/bjgp18X694409.
- Xiao J., He W. The immunomodulatory effects of vitamin D drops in children with recurrent respiratory tract infections. American Journal of Translational Research. 2001. 13(3). 1750-1756.
- Xiao L., Xing C., Yang Z., Xu S., Wang M., Du H., Liu K., Huang Z. Vitamin D supplementation for the prevention of childhood acute respiratory infections: a systematic review of randomised controlled trials. The British journal of nutrition. 2015. 114(7). 1026-1034. https://doi.org/10.1017/S000711451500207X.
- Yakoob M.Y., Salam R.A., Khan F.R., Bhutta Z.A. Vitamin D supplementation for preventing infections in children under five years of age. The Cochrane database of systematic reviews. 2016. 11(11). CD008824. https://doi.org/10.1002/14651858.CD008824.pub2.

/27_2.jpg)
/28_2.jpg)
/28.jpg)
/29.jpg)