Международный эндокринологический журнал Том 19, №5, 2023
Вернуться к номеру
Вплив блокади тирозинових протеїнкіназ на стан мікроглії сітківки при діабетичній ретинопатії
Авторы: Водяник В.В., Зябліцев С.В., Андрущенко В.І.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
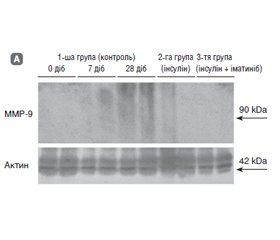
Актуальність. Порушення тканинного гомеостазу сітківки при цукровому діабеті (ЦД) у першу чергу залучає мікроглію, яка запускає каскад запальних реакцій, що є одним з основних механізмів розвитку діабетичної ретинопатії (ДР). Метою дослідження було встановлення стану мікроглії при експериментальній діабетичній ретинопатії та впливу блокатора тирозинових протеїнкіназ іматинібу. Матеріали та методи. У 45 тримісячних щурів-самців лінії Wistar моделювали ЦД шляхом одноразового введення стрептозотоцину (50 мг/кг; Sigma-Aldrich). Щурів було розподілено на 3 групи: контрольна, з уведенням інсуліну короткої дії та введенням інсуліну й іматинібу (Grindeks, Latvia). Імуногістохімічно в сітківці виявляли CD68-позитивні клітини, методом імуноблотингу — вміст іонізованої кальцій-зв’язуючої адапторної молекули-1 (Iba-1) і матричної металопротеїнази-9 (MMP-9). Результати. Вміст Iba-1 у тканині сітківки прогресивно збільшувався і перевищував початковий рівень через 7 діб у 2,0 раза, а через 28 діб — у 3,55 раза (p < 0,05). Введення інсуліну гальмувало збільшення вмісту Iba-1, який хоч і перевищував початковий рівень у 1,8 раза, але був значно нижчим від рівня протеїну через 28 діб у контрольній групі. Уведення поряд з інсуліном іматинібу запобігало накопиченню Iba-1 у тканині сітківки: вміст протеїну не відрізнявся від початкового (p > 0,05). CD68-позитивні клітини в сітківці відзначалися в судинах хоріоїдального сплетення протягом усього спостереження, з 14-го дня — у дилатованих венулах зовнішнього плексиформного шару (моноцитарний пул), а з 2-го дня — дифузно в паренхімі внутрішніх шарів (мікрогліальний пул). Останні мали або округлу, або відросткову форму, що відповідало морфології амебоїдної (фагоцитуючої) або активованої мікроглії. Блокада тирозинових протеїнкіназ запобігала активації мікроглії в сітківці. Прояви запалення у вигляді збільшення на 28-му добу вмісту в сітківці ММР-9 і фіброзні проліферати сітківки при використанні інсуліну та іматинібу були відсутні. Висновки. Встановлена блокада іматинібом ознак запалення сітківки і активації мікроглії вказує на перспективність гальмування тирозинових протеїнкіназ при ДР та обґрунтовує перспективу подальших досліджень із з’ясуванням такого впливу на інші механізми розвитку ДР.
Background. Impaired homeostasis of the retinal tissue in diabetes primarily involves microglia, which triggers a cascade of inflammatory reactions, one of the main mechanisms of diabetic retinopathy (DR). The purpose of the study was to determine the state of microglia in experimental DR and the effect of the tyrosine protein kinase blocker imatinib. Materials and methods. In 45 three-month-old male Wistar rats, diabetes was simulated by a single injection of streptozotocin (50 mg/kg; Sigma-Aldrich). The rats were divided into 3 groups: controls; short-acting insulin; insulin and imatinib (Grindex, Latvia). Immunohistochemically, CD68-positive cells were detected in the retina, and the levels of ionized calcium-binding adapter molecule 1 (Iba-1) and matrix metalloproteinase 9 (MMP-9) was evaluated by immunoblotting. Results. The retinal content of Iba-1 progressively increased and exceeded the initial level by 2.0 times after 7 days, and by 3.55 times after 28 days (p < 0.05). The insulin introduction inhibited the Iba-1 increase, which, although exceeding the initial level by 1.8 times, was significantly lower than the protein level in the control group after 28 days. The administration of imatinib together with insulin prevented the accumulation of Iba-1 in the retinal tissue: the protein content did not differ from the initial level (p > 0.05). CD68-positive cells in the retina were noted in the vessels of the choroid plexus throughout the observation, from the 14th day — in the dilated venules of the outer plexiform layer (monocytic pool), and from day 28 — diffusely in the parenchyma of the inner layers (microglial pool). The latter had either a rounded or a ramified shape, which corresponded to the morphology of amoeboid (phagocytic) or activated microglia. Tyrosine protein kinase blockade prevented the microglial activation in the retina. Signs of inflammation in the form of retinal MMP-9 increase and fibrotic retinal proliferations were absent on the 28th day when using insulin and imatinib. Conclusions. The blockade of retinal inflammation and microglial activation by imatinib indicated the prospects of tyrosine protein kinases inhibition in DR and substantiated the prospect of further research with the clarification of such an effect on other mechanisms of DR development.
гіперглікемія; стрептозотоцин; запалення; Iba-1; MMP-9; іматиніб
hyperglycemia; streptozotocin; inflammation; ionized calcium-binding adapter molecule 1; matrix metalloproteinase 9; imatinib
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Saeedi P., Petersohn I., Salpea P., Malanda B., Karuranga S., Unwin N., Colagiuri S. et al.; IDF Diabetes Atlas Committee. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res. Clin. Pract. 2019 Nov. 157. 107843. doi: 10.1016/j.diabres.2019.107843.
- Pankiv V.I. Type 2 diabetes mellitus: current international guidelines, personalized approach and real outpatient practice. International Journal of Endocrinology (Ukraine). 2020. 16(6). 463-470. doi: 10.22141/2224-0721.16.6.2020.215384. (in Ukrainian).
- Twigg J. Ukraine’s Health Sector — Sustaining momentum for reform. 2017: CSIS Global Health Policy Center. August 2017. https://www.csis.org/analysis/ukraines-health-sector.
- D’Souza D., Empringham J., Pechlivanoglou P., Uleryk E.M., Cohen E., Shulman R. Incidence of Diabetes in Children and Adolescents During the COVID-19 Pandemic: A Systematic Review and Meta-Analysis. JAMA Netw. Open. 2023 Jun 1. 6(6). e2321281. doi: 10.1001/jamanetworkopen.2023.21281.
- Solomon S.D., Chew E., Duh E.J., Sobrin L., Sun J.K., VanderBeek B.L., Wykoff C.C., Gardner T.W. Diabetic Retinopathy: A Position Statement by the American Diabetes Association. Diabetes Care. 2017 Mar. 40(3). 412-418. doi: 10.2337/dc16-2641.
- Himasa F.I., Singhal M., Ojha A., Kumar B. Prospective for Diagnosis and Treatment of Diabetic Retinopathy. Curr. Pharm. Des. 2022. 28(7). 560-569. doi: 10.2174/1381612827666211115154907.
- Kang Q., Yang C. Oxidative stress and diabetic retinopathy: Molecular mechanisms, pathogenetic role and therapeutic implications. Redox Biol. 2020 Oct. 37. 101799. doi: 10.1016/j.redox.2020.101799.
- Mrugacz M., Bryl A., Zorena K. Retinal Vascular Endothelial Cell Dysfunction and Neuroretinal Degeneration in Diabetic Patients. J. Clin. Med. 2021 Jan 25. 10(3). 458. doi: 10.3390/jcm10030458.
- Chang K.C., Shieh B., Petrash J.M. Role of aldose reductase in diabetes-induced retinal microglia activation. Chem. Biol. Interact. 2019 Apr 1. 302. 46-52. doi: 10.1016/j.cbi.2019.01.020.
- Hendrickx D.A.E., van Eden C.G., Schuurman K.G., Hamann J., Huitinga I. Staining of HLA-DR, Iba1 and CD68 in human microglia reveals partially overlapping expression depending on cellular morphology and pathology. J. Neuroimmunol. 2017 Aug 15. 309. 12-22. doi: 10.1016/j.jneuroim.2017.04.007. Epub 2017 Apr 20. PMID: 28601280.
- Tian Y., Jain S., Kelemen S.E., Autieri M.V. AIF-1 expression regulates endothelial cell activation, signal transduction, and vasculogenesis. American Journal of Physiology. Cell. Physiology. 2009. 296(2). С256-66. doi:10.1152/ajpcell.00325.2008.
- Michalski D., Pitsch R., Pillai D.R., Mages B., Aleithe S., Grosche J. et al. Delayed histochemical alterations within the neurovascular unit due to transient focal cerebral ischemia and experimental treatment with neurotrophic factors. PLoS One. 2017 Apr 26. 12(4). e0174996. doi: 10.1371/journal.pone.0174996.
- Murata Y., Sugimoto K., Yang C., Harada K., Gono R., Harada T. et al. Activated microglia-derived macrophage-like cells exa–cerbate brain edema after ischemic stroke correlate with astrocytic expression of aquaporin-4 and interleukin-1 alpha release. Neurochem. Int. 2020 Nov. 140. 104848. doi: 10.1016/j.neuint.2020.104848.
- Ayata P., Badimon A., Strasburger H.J., Duff M.K., Montgomery S.E., Loh Y.E. et al. Epigenetic regulation of brain region-specific microglia clearance activity. Nat. Neurosci. 2018 Aug. 21(8). 1049-1060. doi: 10.1038/s41593-018-0192-3.
- Chiu I.M., Morimoto E.T., Goodarzi H., Liao J.T., O’Keeffe S., Phatnani H.P. et al. A neurodegeneration-specific gene-expression signature of acutely isolated microglia from an amyotrophic lateral sclerosis mouse model. Cell. Rep. 2013 Jul 25. 4(2). 385-401. doi: 10.1016/j.celrep.2013.06.018.
- Gottfried E., Kunz-Schughart L.A., Weber A., Rehli M., Peuker A., Müller A. et al. Expression of CD68 in non-myeloid cell types. Scand. J. Immunol. 2008 May. 67(5). 453-63. doi: 10.1111/j.1365-3083.2008.02091.x.
- Shi F.J., Xie H., Zhang C.Y., Qin H.F., Zeng X.W., Lou H. et al. Is Iba-1 protein expression a sensitive marker for microglia activation in experimental diabetic retinopathy? Int. J. Ophthalmol. 2021 Feb 18. 14(2). 200-208. doi: 10.18240/ijo.2021.02.04.
- Zhu S.H., Liu B.Q., Hao M.J., Fan Y.X., Qian C., Teng P. et al. Paeoniflorin Suppressed High Glucose-Induced Retinal Micro–glia MMP-9 Expression and Inflammatory Response via Inhibition of TLR4/NF-κB Pathway Through Upregulation of SOCS3 in Diabetic Retinopathy. Inflammation. 2017 Oct. 40(5). 1475-1486. doi: 10.1007/s10753-017-0571-z.
- Liu Y., Chen J., Liang H., Cai Y., Li X., Yan L. et al. Human umbilical cord-derived mesenchymal stem cells not only ameliorate blood glucose but also protect vascular endothelium from diabetic damage through a paracrine mechanism mediated by MAPK/ERK signaling. Stem. Cell. Res. Ther. 2022 Jun 17. 13(1). 258. doi: 10.1186/s13287-022-02927-8.
- Guo Y., Guo C., Ha W., Ding Z. Carnosine improves diabetic retinopathy via the MAPK/ERK pathway. Exp. Ther. Med. 2019 Apr. 17(4). 2641-2647. doi: 10.3892/etm.2019.7223. Epub 2019 Jan 30.
- Hymowitz S.G., Malek S. Targeting the MAPK Pathway in RAS Mutant Cancers. Cold Spring Harb. Perspect. Med. 2018 Nov 1. 8(11). a031492. doi: 10.1101/cshperspect.a031492.
- Waller C.F. Imatinib Mesylate. Recent Results Cancer Res. 2018. 212. 1-27. doi: 10.1007/978-3-319-91439-8_1.
- Pitale P.M., Gorbatyuk M.S. Diabetic Retinopathy: From Animal Models to Cellular Signaling. Int. J. Mol. Sci. 2022 Jan 27. 23(3). 1487. doi: 10.3390/ijms23031487.
- Grigsby J.G., Cardona S.M., Pouw C.E., Muniz A., Mendiola A.S., Tsin A.T., Allen D.M., Cardona A.E. The role of microglia in diabetic retinopathy. J. Ophthalmol. 2014. 2014. 705783. doi: 10.1155/2014/705783.
- Sundstrom J.M., Hernández C., Weber S.R., Zhao Y., Dunklebarger M., Tiberti N. et al. Proteomic Analysis of Early Diabetic Retinopathy Reveals Mediators of Neurodegenerative Brain Diseases. Invest. Ophthalmol. Vis. Sci. 2018 May 1. 59(6). 2264-2274. doi: 10.1167/iovs.17-23678.
- Xu J., Chen L.J., Yu J., Wang H.J., Zhang F., Liu Q., Wu J. Involvement of Advanced Glycation End Products in the Pathogenesis of Diabetic Retinopathy. Cell. Physiol. Biochem. 2018. 48(2). 705-717. doi: 10.1159/000491897.
- Duh E.J., Sun J.K., Stitt A.W. Diabetic retinopathy: current understanding, mechanisms, and treatment strategies. JCI Insight. 2017 Jul 20. 2(14). e93751. doi: 10.1172/jci.insight.93751.
- Xia Y., Luo Q., Chen J., Huang C., Jahangir A., Pan T. et al. Retinal Astrocytes and Microglia Activation in Diabetic Retinopathy Rhesus Monkey Models. Curr. Eye Res. 2022 Feb. 047(2). 297-303. doi: 10.1080/02713683.2021.1984535. Epub 2021 Oct 4. PMID: 34547966.
- He M., Long P., Guo L., Zhang M., Wang S., He H. Fushi–ming Capsule Attenuates Diabetic Rat Retina Damage via Antioxidation and Anti-Inflammation. Evid. Based Complement Alternat. Med. 2019 Jul 18. 2019. 5376439. doi: 10.1155/2019/5376439.
- Zeng H.Y., Green W.R., Tso M.O. Microglial activation in human diabetic retinopathy. Arch. Ophthalmol. 2008 Feb. 126(2). 227-32. doi: 10.1001/archophthalmol.2007.65.
- Mohammad G., Kowluru R.A. Diabetic retinopathy and signaling mechanism for activation of matrix metalloproteinase-9. J. Cell. Physiol. 2012 Mar. 227(3). 1052-61. doi: 10.1002/jcp.22822.
- Wu C., Xu K., Liu W., Liu A., Liang H., Li Q. et al. Protective Effect of Raf-1 Kinase Inhibitory Protein on Diabetic Retinal Neurodegeneration through P38-MAPK Pathway. Curr. Eye Res. 2022 Jan. 47(1). 135-142. doi: 10.1080/02713683.2021.1944644.
- Striglia E., Caccioppo A., Castellino N., Reibaldi M., Porta M. Emerging drugs for the treatment of diabetic retinopa–thy. Expert Opin. Emerg. Drugs. 2020 Sep. 25(3). 261-271. doi: 10.1080/–14728214.2020.1801631.
- Boneva S.K., Wolf J., Hajdú R.I., Prinz G., Salié H., Schlecht A. et al. In-Depth Molecular Characterization of Neovascular Membranes Suggests a Role for Hyalocyte-to-Myofibroblast Transdifferentiation in Proliferative Diabetic Retinopathy. Front. Immunol. 2021 Nov 2. 12. 757607. doi: 10.3389/fimmu.2021.757607.