Международный эндокринологический журнал Том 19, №5, 2023
Вернуться к номеру
Застосування екстракту леспедези головчастої в комплексному лікуванні хронічної хвороби нирок
Авторы: Соколова Л.К., Бельчіна Ю.Б., Цимбал Т.С., Черв’якова С.А., Соколова А.М.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
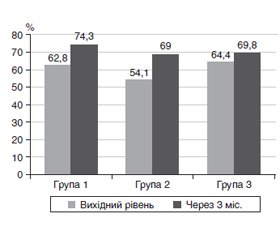
Актуальність. Хронічна хвороба нирок (ХХН) — це багатофакторна прогресуюча хвороба, поширеність якої серед пацієнтів із цукровим діабетом (ЦД) перевищує 25 %. Можливості лікування ХХН обмежені, а більшість з них ґрунтується на модуляції функціонування ренін-ангіотензин-альдостеронової системи (РААС). Протягом останніх декад у нефрології посилюється зацікавленість рослинними лікарськими засобами, що обумовлено їхнім потенціалом щодо запобігання розвитку і сповільнення прогресування ХХН за рахунок пригнічення РААС, зниження інтенсивності запалення та протидії окисному стресу. Леспедеза головчаста (Lespedeza capitata) є природним інгібітором ангіотензинперетворювального ферменту. Екстракту леспедези притаманна виражена діуретична дія, здатність підсилювати ниркову екскрецію азотистих компонентів і низка інших сприятливих ефектів (антиоксидантний, мембраностабілізуючий, антиапоптотичний, гіпохолестеринемічний і протизапальний). Екстракт леспедези протидіє глюкотоксичності та дисфункції ендотелію, що особливо актуально для пацієнтів із ЦД. Метою даного дослідження стало вивчення ефективності дієтичної добавки Лібера («Біхелс», Україна) у пацієнтів із ХХН 3-ї стадії та ЦД 1-го і 2-го типу. Матеріали та методи. До дослідження було включено 60 пацієнтів (15 осіб із ЦД 1-го типу і 45 осіб із ЦД 2-го типу), яким на додаток до стандартної терапії призначали дієтичну добавку Лібера. Аналіз результатів проводився через 1 і 3 місяці. Статистична обробка результатів дослідження проводилась за допомогою програми Statistica 6.1. Результати. Зіставлення вихідних показників швидкості клубочкової фільтрації (ШКФ) і показників ШКФ через 1 і 3 місяці виявило, що в усіх проаналізованих групах пацієнтів через 3 місяці стандартної терапії, доповненої дієтичною добавкою Лібера, ШКФ вірогідно зросла (у пацієнтів із ХХН і ЦД 1-го типу — з 62,8 ± 1,0 мл/хв/1,73 м2 до 74,3 ± 1,7 мл/хв/1,73 м2, p < 0,001; у пацієнтів із ХХН і ЦД 2-го типу, які отримували інгібітори натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ-2), — з 54,1 ± 1,2 мл/хв/1,73 м2 до 69,0 ± 1,4 мл/хв/1,73 м2, p < 0,001; у пацієнтів із ХХН і ЦД 2-го типу, які не отримували іНЗКТГ-2, — з 64,4 ± 1,0 мл/хв/1,73 м2 до 69,8 ± 1,2 мл/хв/1,73 м2, p < 0,05). Отримані дані відповідають результатам інших авторів. Висновки. Включення дієтичної добавки Лібера (ТОВ «Біхелс», Україна) до комплексної терапії ХХН 3-ї стадії привело до вірогідного підвищення ШКФ, що свідчить про виражене поліпшення функції нирок.
Background. Chronic kidney disease (CKD) is a multifactorial progressive disease whose prevalence among patients with diabetes mellitus exceeds 25 %. Treatment options for CKD are limited, and most of them are based on modulating the functioning of the renin-angiotensin-aldosterone system. During the last decades, nephrology has become increasingly interested in herbal medicines, which is due to their potential to prevent the development and slow down the progression of CKD by inhibiting the renin-angiotensin-aldosterone system, reducing the intensity of inflammation, and reducing oxidative stress. Lespedeza capitata is a natural inhibitor of angiotensin-converting enzyme. Lespedeza extract has a pronounced diuretic effect, the ability to enhance the renal excretion of nitrogenous compounds and a number of other beneficial effects (antioxidant, membrane stabilizing, antiapoptotic, hypocholesterolemic and anti-inflammatory). Lespedeza extract counteracts glucotoxicity and endothelial dysfunction, which is especially relevant for patients with diabetes. The purpose was to study the effectiveness of the dietary supplement Libera (Behealth, Ukraine) in patients with stage 3 CKD and type 1 and type 2 diabetes. Materials and methods. The study included 60 patients (15 people with type 1 diabetes and 45 people with type 2 diabetes), who were prescribed the dietary supplement Libera in addition to standard therapy. The results were analyzed 1 and 3 months after. Statistical processing of the research data was carried out using the Statistica 6.1 program. Results. A comparison of glomerular filtration rate (GFR) at baseline and in 1 and 3 months revealed that in all analyzed groups of patients after 3 months of standard therapy with addition of the dietary supplement Libera, GFR significantly increased: in patients with CKD and type 1 diabetes from 62.8 ± 1.0 to 74.3 ± 1.7 ml/min/1.73 m2 (p < 0.001), in those with CKD and type 2 diabetes treated with inhibitors of sodium-dependent glucose cotransporter type 2, from 54.1 ± 1.2 to 69.0 ± 1.4 ml/min/1.73 m2 (p < 0.001); in patients with CKD and type 2 diabetes who didn’t receive sodium-dependent glucose cotransporter type 2 inhibitors, from 64.4 ± 1.0 to 69.8 ± 1.2 ml/min/1.73 m2 (p < 0.05). The obtained data correspond to the results of other authors. Conclusions. The inclusion of the dietary supplement Libera (Behealth, Ukraine) in the comprehensive therapy of patients with stage 3 CKD led to a significant increase in GFR, which indicates a marked improvement in kidney function.
хронічна хвороба нирок; цукровий діабет; фітотерапія; леспедеза головчаста
chronic kidney disease; diabetes; phytotherapy; Lespedeza capitata
Вступ
/27.jpg)
Матеріали та методи
Результати
/29.jpg)
Обговорення
Висновки
- Kalantar-Zadeh K., Jafar T.H., Nitsch D., Neuen B.L., Perkovic V. Chronic kidney disease. Lancet. 2021 Aug 28. 398(10302). 786-802. doi: 10.1016/S0140-6736(21)00519-5. Epub 2021 Jun 24. PMID: 34175022.
- Chen T.K., Knicely D.H., Grams M.E. Chronic Kidney Disease Diagnosis and Management: A Review. JAMA. 2019 Oct 1. 322(13). 1294-1304. doi: 10.1001/jama.2019.14745. PMID: 31573641; PMCID: PMC7015670.
- Іванов Д.Д. Хронічна хвороба нирок: диференційна тактика ренопротекції. Укр. мед. часопис. 2018. 2(124). 1-5.
- Levey A.S., Eckardt K.U., Dorman N.M. et al. Nomenclature for kidney function and disease: report of a kidney disease: improving global outcomes (KDIGO) consensus conference. Kidney Int. 2020. 97(6). 1117-1129.
- Xie Y., Bowe B., Mokdad A.H. et al. Analysis of the Global Burden of Disease study highlights the global, regional, and national trends of chronic kidney disease epidemiology from 1990 to 2016. Kidney Int. 2018. 94(3). 567-581.
- Jha V., Garcia G.G., Iseki K., Li Z., Naicker S., Plattner B. et al. Chronic kidney disease: global dimension and perspectives. The Lancet. 2013. 382(9888). 260-272.
- Glassock R.J., Warnock D.G., Delanaye P. The global burden of chronic kidney disease: estimates, variability and pitfalls. Nature Reviews Nephrology. 2017. 13(2). 104.
- Webster A.C., Nagler E.V., Morton R.L., Masson P. Chronic kidney disease. Lancet. 2017. 389(10075). 1238-1252.
- Schnaper H.W. The tubulointerstitial pathophysiology of progressive kidney disease. Adv. Chronic. Kidney. Dis. 2017. 24(2). 107-116.
- International Diabetes Federation. Diabetes facts & figures. https://idf.org/aboutdiabetes/what-is-diabetes/facts-figures.html.
- Afkarian M., Zelnick L.R., Hall Y.N. et al. Clinical manifestations of kidney disease among US adults with diabetes, 1988–2014. JAMA. 2016. 316. 602-610.
- Levin A., Tonelli M., Bonventre J. et al.; ISN Global Kidney Health Summit participants. Global kidney health 2017 and beyond: a roadmap for closing gaps in care, research, and policy. Lancet. 2017. 390. 1888-1917.
- de Boer I.H., Khunti K., Sadusky T., Tuttle K.R., Neumil–ler J.J., Rhee C.M. et al. Diabetes Management in Chronic Kidney Disease: A Consensus Report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO). Diabetes Care. 2022 Dec 1. 45(12). 3075-3090. doi: 10.2337/dci22-0027. PMID: 36189689.
- Wennmann D.O., Hsu H.-H., Hsu H.H., Pavenstädt H. The renin-angiotensin-aldosterone system in podocytes. In: Seminars in Nephrology. Elsevier. 2012. 32(4). 377-384.
- Bhandari S., Ives N., Brettell E.A. et al. Multicentre randomized controlled trial of angiotensin-converting enzyme inhibitor/angiotensin receptor blocker withdrawal in advanced renal disease: the STOP-ACEi trial. Nephrol. Dial. Transplant. 2016. 31(2). 255-261.
- Gobe G.C., Wojcikowski K. Nontraditional (non-Western pharmaceutical) treatments for chronic kidney disease. Clin. Nephrol. 2019. 93(1). 49-54.
- Yarnell E. Botanical medicines for the urinary tract. World J. Urol. 2002. 20. 285-93.
- Gwaltney-Brant S.M. Nutraceuticals in Renal Diseases. In: Nutraceuticals. Ed. Ramesh C. Gupta. Academic Press, 2016. Р. 101-108. https://doi.org/10.1016/B978-0-12-802147-7.00008-5.
- Khan M.A., Kassianos A.J., Hoy W.E., Alam A.K., Healy H.G., Gobe G.C. Promoting Plant-Based Therapies for Chronic Kidney Disease. Journal of Evidence-Based Integrative Medicine. 2022. 27. doi: 10.1177/2515690X221079688.
- Wagner H., Elbl G. ACE-inhibitory procyanidins from Lespedeza capitata. Planta Med. 1992. 58. 297.
- Gau H.P. Experience with Lespenephryl and Lespenephryl-–forte in the treatment of chronic kidney insufficiency. Med. Welt. 1969. 44. 2426-8 (in German).
- Yarnell E. Botanical medicines for the urinary tract. World J. Urol. 2002. 20. 285-93.
- Mertz D.P., Keine D.H. Anderungen der Nierenpartikelfunktionen unter dem EinfluB eines. Extraktes aus Lespedeza capitata. Arzneimittelforsch. 1964. 14. 155-160.
- Yarnell E. Botanical Medicines Used for Kidney Disease in the United States. Iranian Journal of Kidney Diseases. 2012. 6(6). 407-18.

/27_2.jpg)
/28.jpg)