Международный эндокринологический журнал Том 19, №5, 2023
Вернуться к номеру
Неочікуване визначення зворотного гортанного нерва за допомогою флуоресцентно-керованої хірургії з використанням індоціаніну зеленого для ангіографії в ближній інфрачервоній ділянці
Авторы: M. Gorobeiko, A. Dinets
Institute of Biology and Medicine, Taras Shevchenko National University of Kyiv, Kyiv, Ukraine
Verum Expert Clinic, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
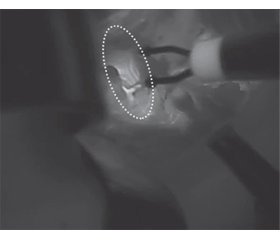
Актуальність. Пошкодження зворотного гортанного нерва (ЗГН) і прищитоподібної залози є тяжким ускладненням операцій на щитоподібній залозі. Можливість підтвердження ЗГН у ближньому інфрачервоному спектрі після введення індоціаніну зеленого (IЦЗ) не вивчалaсь. Мета: оцінити ангіографію з IЦЗ для ідентифікації ЗГН під час хірургічного втручання на щитоподібній та прищитоподібній залозах. Матеріали та методи. Ангіографія із застосуванням IЦЗ для ідентифікації ЗГН виконана 7 хворим. Як метод контролю ЗГН застосовували інтраопераційний нейромоніторинг. Під час операції при візуальному огляді (неозброєним оком) виявлено прищитоподібні залози та ЗГН. Для подальшого підтвердження розташування прищитоподібних залоз шляхом їх автофлуоресценції було проведено внутрішньовенну ін’єкцію IЦЗ у концентрації 0,25 мг/кг із подальшим застосуванням апаратної системи флуоресцентно-керованої хірургії. Результати. Сильний сигнал від ЗГН був ідентифікований в усіх випадках після ін’єкції IЦЗ. Достатнє кровопостачання ЗГН можна розглядати як причину доброго сигналу в ближній інфрачервоній ділянці. Висновки. IЦЗ є додатковим інструментом підтвердження ЗГН на додаток до звичайної візуальної ідентифікації. Такий підхід може бути застосований під час флуоресцентно-керованої хірургії для оцінки автофлуоресценції прищитоподібних залоз. Візуалізація ЗГН за допомогою ангіографії з IЦЗ розглядається як додатковий корисний інструмент для запобігання такому інтраопераційному ускладненню, як пошкодження ЗГН.
Background. The recurrent laryngeal nerve (RLN) damage and parathyroid gland injury are the most severe complications of thyroid surgery. The possibility of RLN confirmation in the near-infrared spectrum after the injection of indocyanine green (ICG) was not yet been studied. Aim: to evaluate the ICG angiography for the identification of RLN during thyroid and parathyroid surgery. Materials and methods. ICG angiography of RLN was performed in 7 patients. An intraoperative neuromonitoring was applied as a method of controlling RLN. During the operation, parathyroid glands and RLN were identified by visual inspection (naked eye). To further confirm the location of the parathyroid glands by autofluorescence, an intravenous injection of ICG was performed with a concentration of 0.25 mg/kg followed by the application of the image-based system. Results. A good signal was achieved in the near-infrared spectrum from the RLN in all cases after the ICG injection. Sufficient blood perfusion of the RLN could be considered as a reasonable explanation for the exhibition of a good ICG near-infrared signal. Conclusions. ICG use might be a helpful approach for the confirmation of the RLN in addition to routine visual identification. Such function could be applied during fluorescence-guided surgery to evaluate the parathyroid gland autofluorescence. Visualization of RLN by ICG angiography is considered as an additional useful feature to prevent RLN injury.
зворотний гортанний нерв; автофлуоресценція прищитоподібних залоз; флуоресцентно-керована хірургія; індоціанін зелений; хірургія щитоподібної залози; хірургія прищитоподібних залоз; профілактика післяопераційних ускладнень
recurrent laryngeal nerve; autofluorescence of parathyroid glands; fluorescence-guided surgery; indocyanine green; thyroid surgery; parathyroid surgery; prevention of postoperative complications
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Gunn A., Oyekunle T., Stang M., Kazaure H., Scheri R. Recurrent Laryngeal Nerve Injury After Thyroid Surgery: An Analysis of 11,370 Patients. J. Surg. Res. 2020 Nov. 255. 42-49. doi: 10.1016/j.jss.2020.05.017.
- Mansor W.N.W., Azman M., Remli R., Yunus M.R.M., Baki M.M. Primary Nonselective Laryngeal Reinnervation in Iatrogenic Acute Recurrent Laryngeal Nerve Injury: Case Series and Literature Review. Ear Nose Throat J. 2023 Mar. 102(3). 164-169. doi: 10.1177/0145561321993605.
- Stewart L.A., Kuo J.H. Advancements in the treatment of differentiated thyroid cancer. Ther. Adv. Endocrinol. Metab. 2021 Mar 17. 12. 20420188211000251. doi: 10.1177/20420188211000251.
- Higgins T.S., Gupta R., Ketcham A.S., Sataloff R.T., Wadsworth J.T., Sinacori J.T. Recurrent laryngeal nerve monitoring versus identification alone on post-thyroidectomy true vocal fold palsy: a meta-analysis. Laryngoscope. 2011 May. 121(5). 1009-17. doi: 10.1002/lary.21578.
- Nabhan F., Dedhia P.H., Ringel M.D. Thyroid cancer, recent advances in diagnosis and therapy. Int. J. Cancer. 2021 Sep 1. 149(5). 984-992. doi: 10.1002/ijc.33690.
- Lukinović J., Bilić M. Overview of Thyroid Surgery Complications. Acta Clin. Croat. 2020 Jun. 59 (Suppl. 1). 81-86. doi: 10.20471/acc.2020.59.s1.10.
- Stefanou C.K., Papathanakos G., Stefanou S.K., Tepelenis K., Kitsouli A. et al. Surgical tips and techniques to avoid complications of thyroid surgery. Innov. Surg. Sci. 2022 Oct 11. 7(3–4). 115-123. doi: 10.1515/iss-2021-0038.
- Iglesias P., Díez J.J. Endocrine Complications of Surgical Treatment of Thyroid Cancer: An Update. Exp. Clin. Endocrinol. Dia–betes. 2017 Sep. 125(8). 497-505. doi: 10.1055/s-0043-106441.
- Weng Y.J., Jiang J., Min L., Ai Q., Chen D.B. et al. Intraope–rative near-infrared autofluorescence imaging for hypocalcemia risk reduction after total thyroidectomy: evidence from a meta-analysis. Head Neck. 2021 Aug. 43(8). 2523-2533. doi: 10.1002/hed.26733.
- Gorobeiko M., Dinets A. Intraoperative detection of parathyroid glands by autofluorescence identification using image-based system: report of 15 cases. J. Med. Case Rep. 2021 Aug 9. 15(1). 414. doi: 10.1186/s13256-021-03009-8.
- Van Slycke S., Van Den Heede K., Brusselaers N., Vermeersch H. Feasibility of Autofluorescence for Parathyroid Glands During Thyroid Surgery and the Risk of Hypocalcemia: First Results in Belgium and Review of the Literature. Surg. Innov. 2021 Aug. 28(4). 409-418. doi: 10.1177/1553350620980263.
- Kamada T., Yoshida M., Suzuki N., Takeuchi H., Takahashi J. et al. Introduction of VISIONSENSE® for indocyanine green fluorescence-guided parathyroidectomy: report of a case. Int. J. Surg. Case Rep. 2020. 75. 418-421. doi: 10.1016/j.ijscr.2020.09.139.
- Alesina P.F., Meier B., Hinrichs J., Mohmand W., Walz M.K. Enhanced visualization of parathyroid glands during video-assisted neck surgery. Langenbecks Arch. Surg. 2018 May. 403(3). 395-401. doi: 10.1007/s00423-018-1665-2.
- Cherenko S.M., Dinets A., Bandura G.V., Sheptuha S.A., La–rin O.S. Multiglandular parathyroid gland disease: an incidental disco–very in normocalcemic patients during thyroid surgery. Acta Endocrinol. (Bucharest). 2017 Jul-Sep. 13(3). 349-355. doi: 10.4183/aeb.2017.349.
- Rutledge S., Harrison M., O’Connell M., O’Dwyer T., Byrne M.M. Acute presentation of a giant intrathyroidal parathyroid adenoma: a case report. J. Med. Case Rep. 2016 Oct 19. 10(1). 286. doi: 10.1186/s13256-016-1078-1.
- Orloff L.A., Wiseman S.M., Bernet V.J., Fahey T.J. 3rd, Shaha A.R. et al. American Thyroid Association Statement on Postoperative Hypoparathyroidism: Diagnosis, Prevention, and Management in Adults. Thyroid. 2018 Jul. 28(7). 830-841. doi: 10.1089/thy.2017.0309.
- Tzikos G., Polyzonis M., Milias K., Milias S., Passos I. et al. Double ipsilateral parathyroid adenomas, with one supernumerary and ectopic at the same time: a case report. J. Med. Case Rep. 2021. 15(1). 198. doi: 10.1186/s13256-021-02711-x.
- Persky M., Fang Y., Myssiorek D. Relationship of the recurrent laryngeal nerve to the superior parathyroid gland during thyroidectomy. J. Laryngol. Otol. 2014 Mar 25. 1-4. doi: 10.1017/S0022215114000358.
- Wu Y., Zhang F. Exploiting molecular probes to perform near-infrared fluorescence-guided surgery. View. 2020. 1(4). 20200068. doi: 10.1002/VIW.20200068.
- He K., Zhou J., Yang F., Chi C., Li H. et al. Near-infrared Intraoperative Imaging of Thoracic Sympathetic Nerves: From Precli–nical Study to Clinical Trial. Theranostics. 2018 Jan 1. 8(2). 304-313. doi: 10.7150/thno.22369.
- Tanaka K., Okazaki M., Yano T., Miyashita H., Homma T., Tomita M. Quantitative evaluation of blood perfusion to nerves inclu–ded in the anterolateral thigh flap using indocyanine green fluorescence angiography: a different contrast pattern between the vastus lateralis motor nerve and femoral cutaneous nerve. J. Reconstr. Microsurg. 2015 Mar. 31(3). 163-70. doi: 10.1055/s-0034-1390382.
- Cherenko S.M., Larin O.S., Gorobeyko M.B., Sichynava R.M. Clinical analysis of thyroid cancer in adult patients exposed to ionizing radiation due to the Chernobyl nuclear accident: 5-year comparative investigations based on the results of surgical treatment. World J. Surg. 2004 Nov. 28(11). 1071-4. doi: 10.1007/s00268-004-7561-7.
- Gorobeiko M., Dinets A., Pominchuk D., Abdalla K., Prylutskyy Y., Hoperia V. Challenges of Differential Diagnosis Between Primary Hyperparathyroidism and Bone Metastases of Breast Cancer. Clin. Med. Insights Case Rep. 2022 Sep 20. 15. 11795476221125136. doi: 10.1177/11795476221125136.
- Gorobeiko M., Dinets A., Hoperia V., Abdalla K. Improved intraoperative verification of parathyroid glands by determining their auto–fluorescence in the infrared spectrum. Meždunarodnyj nevrologičeskij žurnal (Ukraine). 2021. 17(6). 465-471. doi: 10.22141/ 2224-0721. 17.6.2021.243207.