Международный эндокринологический журнал Том 19, №5, 2023
Вернуться к номеру
Зв’язок між масою тіла, рівнем серотоніну, станом психічного здоров’я, порушенням сну та обміном речовин у пацієнтів з ожирінням
Авторы: V.I. Tkachenko, T.O. Bagro
Shupyk National Healthcare University of Ukraine, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
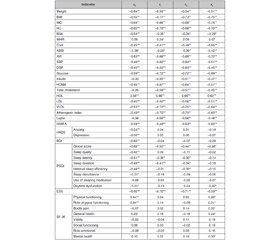
Актуальність. Значне поширення ожиріння спонукає дослідників до пошуку етіопатогенетичного лікування шляхом вивчення зв’язків і залежностей гормонального, нейрохімічного та психосоматичного компонентів. Мета: визначити кореляцію між масою тіла, рівнем серотоніну, станом психічного здоров’я, розладами сну та обміном речовин у пацієнтів з ожирінням. Матеріали та методи. У когортному проспективному дослідженні протягом шести місяців спостерігали 75 осіб з ожирінням. Пацієнти були розподілені на дві групи залежно від виявлених психосоціальних особливостей та розладів сну з відповідним лікуванням із застосуванням пацієнт-орієнтованого підходу. Обстеження включало визначення індексу маси тіла (ІМТ), окружності талії та стегон, індексів абдомінального ожиріння (BSA, WHR, ConI, ABSI, AVI), артеріального тиску, ліпідного профілю, рівнів глюкози натще, інсуліну, лептину, серотоніну, оцінку психосоціального статусу та якості сну за допомогою шкал HADS, Бека, Гамільтона, сонливості Епворта (ESS), Піттсбурзького індексу якості сну (PSQI), якості життя за опитувальником SF-36. Статистичний аналіз проводили з використанням програм IBM SPSS Statistics, Statistica 12, Excel 2010. Результати. У пацієнтів визначено ожиріння І та ІІ ступенів. Розрахункові показники абдомінального ожиріння, параметри ліпідного та вуглеводного обміну, бали за опитувальниками харчової поведінки, тривоги та депресії, якості сну, сонливості та рівень лептину перевищували рекомендовані значення, при цьому вміст серотоніну, показник шкали SF-36 мали низькі значення, що значно покращувалось у динаміці лікування. На початку дослідження виявлено сильні прямі кореляційні зв’язки між ІМТ, окружністю талії і стегон, індексами абдомінального ожиріння, артеріальним тиском, показниками ліпідного та вуглеводного обміну, рівнем лептину, оцінкою за шкалами HADS, Бека, Гамільтона, ESS, PSQI; відмічено сильну зворотну (негативну) залежність ІМТ від рівнів ліпопротеїнів високої щільності і серотоніну. Спостерігалася сильна негативна кореляція серотоніну з ІМТ, масою тіла, індексами BSA, ABSI, AVI, ConI, артеріальним тиском, показниками ліпідного та вуглеводного обміну, оцінкою за шкалами HADS, Гамільтона, Бека, PSQI (сонливість, якість, тривалість, ефективність сну) та ESS. Висновки. Високий ІМТ корелює з низьким рівнем серотоніну, підвищеним рівнем тривоги та депресії, сонливістю, погіршенням якості сну та життя, порушеннями ліпідного та вуглеводного обміну, які є взаємно обтяжливими факторами щодо розвитку ожиріння та інших неінфекційних захворювань; це необхідно враховувати при визначенні підходів до комплексного пацієнт-орієнтованого лікування ожиріння.
Background. The significant spread of obesity stimulates researchers to search for etiopathogenic treatment by studying the relationships and dependencies of the hormonal, neurochemical and psychosomatic components. The purpose of the study is to determine the correlation between body weight, serotonin level, mental health status, sleep disorders and metabolism in obese patients. Materials and methods. In a cohort, prospective study, 75 patients with obesity were observed for 6 months. They were divided into 2 groups depending on the detected psychosocial characteristics and sleep disorders with the appropriate treatment using a patient-oriented approach. The examination included studying body mass index (BMI), abdominal obesity indices (body surface area, waist/hip ratio, conicity index, a body shape index, abdominal volume index), blood pressure, lipid profile, fasting glucose, insulin, leptin, serotonin, assessment of psychosocial status and sleep quality with Hospital Anxiety and Depression Scale (HADS), Beck’s Depression Inventory (BDI), Hamilton Anxiety Rating Scale (HAM-A), Epworth Sleepiness Scale (ESS), Pittsburgh Sleep Quality Index (PSQI), quality of life using the SF-36 questionnaire. Statistical analysis was performed using IBM SPSS Statistics, Statistica 12, Excel 2010. Results. At baseline, the patients had obesity class I and II. Тhe calculated indices of abdominal obesity, indicators of lipid and carbohydrate metabolism, scores of questionnaires of eating behavior, anxiety and depression, quality of sleep, sleepiness and leptin level exceeded the recommended values, while the level of serotonin, the scores of the SF-36 had low values that significantly improved in dynamics. Strong direct correlations at baseline were found between BMI, abdominal obesity indices, blood pressure, indicators of lipid and carbohydrate metabolism, leptin, HADS, BDI, HAM-A, ESS, PSQI global score; a strong inverse (negative) relationship was noted between BMI and the levels of high-density lipoprotein and serotonin. A high negative correlation was found between serotonin and BMI, abdominal obesity indices (body surface area, a body shape index, abdominal volume index, conicity index), blood pressure, indicators of lipid and carbohydrate metabolism, HADS, HAM-A, BDI, PSQI global score, sleep quality, latency, duration, efficiency and the ESS. Conclusions. The high BMI correlates with a low level of serotonin, increased level of anxiety and depression, drowsiness, deterioration of the quality of sleep and life, disorders of lipid and carbohydrate metabolism, which are mutually aggravating factors for the development of obesity and other non-infectious diseases; it must be taken into account when determining approaches to comprehensive patient-oriented treatment of obesity.
ожиріння; серотонін; порушення сну; тривога; депресія; кореляція
obesity; serotonin; sleep disorder; anxiety; depression, correlation
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Bischoff S.C., Schweinlin A. Obesity therapy. Clin. Nutr. ESPEN. 2020 Aug. 38. 9-18. doi: 10.1016/j.clnesp.2020.04.013.
- Bouchard C. Genetics of Obesity: What We Have Learned Over Decades of Research. Obesity (Silver Spring). 2021 May. 29(5). 802-820. doi: 10.1002/oby.23116.
- Alamuddin N., Wadden T.A. Behavioral Treatment of the Patient with Obesity. Endocrinol. Metab. Clin. North Am. 2016 Sep. 45(3). 565-80. doi: 10.1016/j.ecl.2016.04.008.
- Kukkonen J.P., Leonard C.S. Orexin/hypocretin receptor signalling cascades. Br. J. Pharmacol. 2014. 171(2). 314-331. doi: 10.1111/bph.12324.
- Grafe L.A., Eacret D., Dobkin J., Bhatnagar S. Reduced Ore–xin System Function Contributes to Resilience to Repeated Social Stress. eNeuro. 2018. 5(2). ENEURO.0273-17.2018. doi: 10.1523/ENEURO.0273-17.2018.
- Lundgren J.R., Janus C., Jensen S.B.K., Juhl C.R., Olsen L.M. et al. Healthy Weight Loss Maintenance with Exercise, Liraglutide, or Both Combined. N. Engl. J. Med. 2021 May 6. 384(18). 1719-1730. doi: 10.1056/NEJMoa2028198.
- Tsuneki H., Maeda T., Takata S., Sugiyama M., Otsuka K. et al. Hypothalamic orexin prevents non-alcoholic steatohepatitis and hepatocellular carcinoma in obesity. Cell. Rep. 2022 Oct 18. 41(3). 111497. doi: 10.1016/j.celrep.2022.111497.
- Forte N., Boccella S., Tunisi L., Fernández-Rilo A.C., Imperatore R. et al. Orexin-A and endocannabinoids are involved in obesity-associated alteration of hippocampal neurogenesis, plasticity, and episodic memory in mice. Nat. Commun. 2021 Oct 21. 12(1). 6137. doi: 10.1038/s41467-021-26388-4.
- Xiao X., Yeghiazaryan G., Hess S., Klemm P., Sieben A. et al. Orexin receptors 1 and 2 in serotonergic neurons differentially regulate peripheral glucose metabolism in obesity. Nat. Commun. 2021 Sep 2. 12(1). 5249. doi: 10.1038/s41467-021-25380-2.
- Mavanji V., Pomonis B., Kotz C.M. Orexin, serotonin, and energy balance. WIREs Mech. Dis. 2022. 14(1). e1536. doi: 10.1002/wsbm.1536.
- García-Cárceles J., Decara J.M., Vázquez-Villa H., Rodríguez R., Codesido E. et al. A Positive Allosteric Modulator of the Serotonin 5-HT2C Receptor for Obesity. J. Med. Chem. 2017 Dec 14. 60(23). 9575-9584. doi: 10.1021/acs.jmedchem.7b00994.
- Marazziti D., Betti L., Baroni S., Palego L., Mucci F. et al. The complex interactions among serotonin, insulin, leptin, and glycolipid metabolic parameters in human obesity. CNS Spectr. 2022 Feb. 27(1). 99-108. doi: 10.1017/S1092852920001820.
- Pak K., Kim K., Seo S., Lee M.J., Kim I.J. Serotonin transporter is negatively associated with body mass index after glucose loa–ding in humans. Brain Imaging Behav. 2022. 16(3). 1246-1251. doi: 10.1007/s11682-021-00600-x.
- Wei Q.S., Chen Z.Q., Tan X., Kang L.C., Jiang X.B. et al. Serum serotonin concentration associated with bone mineral density in Chinese postmenopausal women. Scand. J. Clin. Lab. Invest. 2017 Feb. 77(1). 40-44. doi: 10.1080/00365513.2016.1247983.
- American Psychiatric Association. Diagnostic and statistical manual of mental disorders: DSM-5. Washington, DC: American Psychiatric Association; 2013 May 22. 391 p. doi: org/10.1176/appi.books.9780890425787.
- American Academy of Sleep Medicine. International classification of sleep disorders — third edition (ICSD-3). AASM Resour Libr. 2014. 215-220.
- Maski K., Trotti L.M., Kotagal S., Robert Auger R., Rowley J.A. et al. Treatment of central disorders of hypersomnolence: an American Academy of Sleep Medicine clinical practice guideline. J. Clin. Sleep Med. 2021 Sep 1. 17(9). 1881-1893. doi: 10.5664/jcsm.9328.
- Website of FDA. Available from: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2010/022341s000TOC.cfm.
- Tkachenko V., Bagro T. Mental health and sleep disorders in obese patients, their relationship with clinical-pathogenetic chan–ges in the body and impact on quality of life. Family Medicine. Euro–pean Practices. 2020. 4(102). 5-10. doi: 10.30841/2786-720X.4. 2022.274617.
- Pankiv V. Treatment Strategies for Obesity. Meždunarod–nyj nevrologičeskij žurnal (Ukraine). 2013. 52. 85-90. doi: 10.22141/ 2224-0721.4.52.2013.84445.
- Gažarová M., Galšneiderová M., Mečiarová L. Obesity diag–nosis and mortality risk based on a body shape index (ABSI) and other indices and anthropometric parameters in university students. Rocz. Panstw. Zakl. Hig. 2019. 70(3). 267-275. doi: 10.32394/rpzh.2019.0077.
- Ou Y.L., Lee M.Y., Lin I.T., Wen W.L., Hsu W.H., Chen S.C. Obesity-related indices are associated with albuminuria and advanced kidney disease in type 2 diabetes mellitus. Ren. Fail. 2021. 43(1). 1250-1258. doi: 10.1080/0886022X.2021.1969247.
- Adam T.C., Drummen M., Macdonald I., Jalo E., Siig-–Vestentoft P. et al. Association of Psychobehavioral Variables With HOMA-IR and BMI Differs for Men and Women With Prediabetes in the PREVIEW Lifestyle Intervention. Diabetes Care. 2021 Jul. 44(7). 1491-1498. doi: 10.2337/dc21-0059.
- Bahadur A., Verma N., Mundhra R., Chawla L., Ajmani M. et al. Correlation of Homeostatic Model Assessment-Insulin Resistance, Anti-Mullerian Hormone, and BMI in the Characterization of Polycystic Ovary Syndrome. Cureus. 2021 Jun 30. 13(6). e16047. doi: 10.7759/cureus.16047.
- Boyer W.R., Johnson T.M., Fitzhugh E.C., Richardson M.R., Churilla J.R. The Associations Between Increasing Degrees of HOMA-IR and Measurements of Adiposity Among Euglycemic U.S. Adults. Metab. Syndr. Relat. Disord. 2016. 14(2). 108-113. doi: 10.1089/met.2015.0077.
- Foti K., Hardy S.T., Chang A.R., Selvin E., Coresh J., Muntner P. BMI and blood pressure control among United States adults with hypertension. J. Hypertens. 2022. 40(4). 741-748. doi: 10.1097/HJH.0000000000003072.
- Zhang W., He K., Zhao H. et al. Association of body mass index and waist circumference with high blood pressure in older adults. BMC Geriatr. 2021. 21(1). 260. doi: 10.1186/s12877-021-02154-5.
- Arias A., Rodríguez-Álvarez C., González-Dávila E., Acosta-Torrecilla A., Novo-Muñoz M.M., Rodríguez-Novo N. Arterial Hypertension in Morbid Obesity after Bariatric Surgery: Five Years of Follow-Up, a Before-And-After Study. Int. J. Environ. Res. Public Health. 2022. 19(3). 1575. doi: 10.3390/ijerph19031575.
- Højland Ipsen D., Tveden-Nyborg P., Lykkesfeldt J. Normal weight dyslipidemia: is it all about the liver? Obesity (Silver Spring). 2016. 24(3). 556-567. doi: 10.1002/oby.21443.
- Yumuk V., Tsigos C., Fried M., Schindler K., Busetto L., Micic D., Toplak H. Obesity Management Task Force of the European Association for the Study of Obesity. European Guidelines for Obesity Management in Adults. Obes. Facts. 2015. 8(6). 402-24. doi: 10.1159/000442721.
- Walker N.A., Sunderram J., Zhang P., Lu S.E., Scharf M.T. Clinical utility of the Epworth sleepiness scale. Sleep Breath. 2020. 24(4). 1759-1765. doi: 10.1007/s11325-020-02015-2.
- Liu D., Kahathuduwa C., Vazsonyi A.T. The Pittsburgh Sleep Quality Index (PSQI): psychometric and clinical risk score applications among college students. Psychol. Assess. 2021. 33(9). 816-826. doi: 10.1037/pas0001027.
- Ogilvie R.P., Patel S.R. The epidemiology of sleep and obesity. Sleep Health. 2017. 3(5). 383-388. doi: 10.1016/j.sleh.2017.07.013.
- Antza C., Kostopoulos G., Mostafa S., Nirantharakumar K., Tahrani A. The links between sleep duration, obesity and type 2 diabetes mellitus. J. Endocrinol. 2021. 252(2). 125-141. doi: 10.1530/JOE-21-0155.
- Jehan S., Myers A.K., Zizi F., Pandi-Perumal S.R., Jean-Louis G. et al. Sleep health disparity: the putative role of race, ethnicity and socioeconomic status. Sleep Med. Disord. 2018. 2(5). 127-133.
- Jung J.H., Park J.W., Kim D.H., Kim S.T. The effects of obstructive sleep apnea on risk factors for cardiovascular diseases. Ear Nose Throat J. 2021. 100 (5 suppl.). 477S-482S.
- Primack C. Obesity and Sleep. Nurs. Clin. North Am. 2021. 56(4). 565-572. doi: 10.1016/j.cnur.2021.07.012.
- Auger R.R., Burgess H.J., Emens J.S., Deriy L.V., Tho–mas S.M., Sharkey K.M. Clinical Practice Guideline for the Treatment of Intrinsic Circadian Rhythm Sleep-Wake Disorders: Advanced Sleep-Wake Phase Disorder (ASWPD), Delayed Sleep-Wake Phase Disorder (DSWPD), Non-24-Hour Sleep-Wake Rhythm Disorder (N24SWD), and Irregular Sleep-Wake Rhythm Disorder (ISWRD). An Update for 2015: An American Academy of Sleep Medicine Clinical Practice Guideline. J. Clin. Sleep Med. 2015. 11(10). 1199-1236. doi: 10.5664/jcsm.5100.
- Scott A.J., Webb T.L., Martyn-St James M., Rowse G., –Weich S. Improving sleep quality leads to better mental health: a meta-–analysis of randomised controlled trials. Sleep Med. Rev. 2021. 60. 101556. doi: 10.1016/j.smrv.2021.101556.
- Van Galen K.A., Ter Horst K.W., Serlie M.J. Serotonin, food intake, and obesity. Obes. Rev. 2021. 22(7). e13210. doi: 10.1111/obr.13210.
- Yurci A., Dokuzeylül Güngör N., Güngör K., Hatırnaz Ş. Correlation of serum leptin and ghrelin levels with endocrine and reproductive parameters in women with clomiphene citrate resistant polycystic ovary syndrome. Turk. J. Obstet. Gynecol. 2022. 19(2). 124-129. doi: 10.4274/tjod.galenos.2022.84883.
- Bayanova E. Interconnection between metabolic syndrome components in obese patients. Meždunarodnyj nevrologičeskij žurnal (Ukraine). 2017. 13(2). 209-212. doi: 10.22141/2224-0721.13.2. 2017.100615.
- Eik-Nes T.T., Tokatlian A., Raman J., Spirou D., Kvaløy K. Depression, anxiety, and psychosocial stressors across BMI classes: a Norwegian population study — The HUNT Study. Front. Endocrinol.(Lausanne). 2022. 13. 886148. doi: 10.3389/fendo.2022.886148.