Журнал "Гастроэнтерология" Том 57, №3, 2023
Вернуться к номеру
Вплив вісцерального ожиріння на стан цитокінової та гормональної регуляції в пацієнтів із гастроезофагеальною рефлюксною хворобою
Авторы: Yu.M. Stepanov, L.M. Mosiychuk, O.M. Tatarchuk, O.M. Shevtsova, O.P. Petishko
State Institution “Institute of Gastroenterology of the National Academy of Medical Sciences of Ukraine”, Dnipro, Ukraine
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
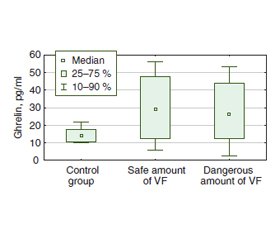
Актуальність. Останніми роками значну увагу дослідників привертають патогенетичні механізми, що лежать в основі асоціативного зв’язку гастроезофагеальної рефлюксної хвороби (ГЕРХ) і метаболічного синдрому. Мета: визначити особливості цитокінового балансу, вуглеводного обміну, рівня лептину і греліну залежно від кількості вісцерального жиру в пацієнтів із ГЕРХ. Матеріали та методи. Обстежено 56 осіб із ГЕРХ. За результатами біоімпедансного аналізу були сформовані вибірки: 23 пацієнти з небезпечною та 33 — з безпечною кількістю вісцерального жиру. У сироватці крові всіх хворих імуноферментним методом визначали рівні фактора некрозу пухлин α, інтерлейкіну-6, інтерлейкіну-10, греліну та лептину. Також у пацієнтів із ГЕРХ оцінювали рівень глюкози, інсуліну та розраховували індекс інсулінорезистентності (HOMA-IR). Результати. У групі пацієнтів із ГЕРХ та небезпечною кількістю вісцерального жиру встановлено збільшення концентрації прозапального цитокіну інтерлейкіну-6 на 12 % з одночасним зниженням рівня протизапального цитокіну інтерлейкіну-10 на 22 % (p < 0,05), підвищення медіани індексу HOMA-IR в 1,3 раза (p < 0,05) порівняно з групою осіб із безпечною кількістю вісцерального жиру. При оцінці рівня греліну в пацієнтів із небезпечною кількістю вісцерального жиру виявлено вірогідне зростання медіани вмісту цього адипоцитокіну в 2,0 раза (p < 0,05) порівняно з групою контролю. За результатами кореляційного аналізу встановлені взаємозв’язки між кількістю вісцерального жира та рівнем лептину (r = 0,37; р = 0,0008), інтерлейкіну-10 (r = –0,28; р = 0,0116), інсуліну (r = 0,41; р = 0,001), індексом HOMA-IR (r = 0,48; р = 0,00001). Висновки. В осіб із ГЕРХ збільшення кількості вісцерального жиру асоціюється з порушенням цитокінового балансу та вуглеводного обміну, підвищенням рівня греліну. Визначена статистично значуща кореляція між кількістю вісцерального жиру та рівнем лептину свідчить про функціональний зв’язок показників зміни складу тіла за даними біоімпедансометрії з гормональною активністю жирової тканини в пацієнтів із ГЕРХ.
Background. In recent years, pathogenetic mechanisms underlying the association of gastroesophageal reflux disease (GERD) and metabolic syndrome have caused considerable interest among researchers. The purpose is to determine the features of cytokine balance, carbohydrate metabolism, leptin and ghrelin levels depending on the amount of visceral fat in patients with GERD. Materials and methods. Fifty-six patients with GERD were examined. According to the results of bioimpedance analysis, they were divided into the groups: 23 patients with a dangerous and 33 with a safe amount of visceral fat. The levels of tumor necrosis factor α, interleukin-6, interleukin-10, ghrelin and leptin were determined in the blood serum of all patients by the enzyme immunoassay method. Also, the levels of glucose, insulin were determined and the insulin resistance index (HOMA-IR) was calculated in patients with GERD. Results. In the group of GERD patients with a dangerous amount of visceral fat, an increase in the concentration of the pro-inflammatory cytokine interleukin-6 by 12 % was found with a simultaneous decrease in the level of the anti-inflammatory cytokine interleukin-10 by 22 % (p < 0.05), an increase in the HOMA-IR median by 1.3 times (p < 0.05) compared to the patients with a safe amount of visceral fat. The median level of ghrelin in patients with a dangerous visceral fat amount increased significantly, by 2.0 times (p < 0.05) compared to the control group. Correlation analysis showed an association between visceral fat and leptin (r = 0.37; p = 0.0008), interleukin-10 (r = –0.28; p = 0.0116), insulin (r = 0.41; p = 0.001), HOMA-IR (r = 0.48; p = 0.00001). Conclusions. In GERD patients, an increase in the amount of visceral fat was associated with a violation of the cytokine balance, carbohydrate metabolism, increased level of ghrelin. The determined statistically significant correlation between the amount of visceral fat and the level of leptin indicates a functional relationship between the body composition according to bioimpedance analysis and the hormonal activity of adipose tissue in patients with GERD.
гастроезофагеальна рефлюксна хвороба; вісцеральне ожиріння; цитокіни; інсулінорезистентність; лептин; грелін
gastroesophageal reflux disease; visceral obesity; cytokines; insulin resistance; leptin; ghrelin
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Степанов Ю.М., Скирда І.Ю., Петішко О.П. Хвороби органів травлення — актуальна проблема клінічної медицини. Гастроентерологія. 2019. Т. 53, № 1. С. 1-6. doi: 10.22141/2308-2097.53.1.2019.163450.
- Saklayen M.G. The Global Epidemic of the Metabolic Syndrome. Curr Hypertens Rep. 2018. Vol. 20(2). P. 12. doi: 10.1007/s11906-018-0812-z.
- A new perspective on special effective interventions for metabolic syndrome risk factors: a systematic review and meta-analysis / H. Wang et al. Front Public Health. 2023. Vol. 11. P. 1133614. doi: 10.3389/fpubh.2023.1133614.
- Obesity in IBD: epidemiology, pathogenesis, disease course and treatment outcomes / S. Singh et al. Nat Rev Gastroenterol Hepatol. 2017. Vol. 14(2). P. 110-121. doi: 10.1038/nrgastro.2016.181.
- Metabolic (dysfunction)-associated fatty liver disease in individuals of normal weight / M. Eslam et al. Nat Rev Gastroenterol Hepatol. 2022. Vol. 19(10). P. 638-651. doi: 10.1038/s41575-022-00635-5.
- Міронова А.О., Тимошенко Г.Ю. Метаболічний синдром при захворюваннях органів травлення. Медицина третього тисячоліття: тези доповідей міжвузівської конференції молодих вчених та студентів (Харків, 18–20 січня 2021 р.). С. 89-90. URL: https://repo.knmu.edu.ua/handle/123456789/29127.
- Tilg H., Adolph T.E., Dudek M., Knolle P. Non-alcoholic fatty liver disease: the interplay between metabolism, microbes and immunity. Nat Metab. 2021. Vol. 3(12). P. 1596-1607. doi: 10.1038/s42255-021-00501-9.
- Shin H.S., Jun B.G., Yi S.W. Impact of diabetes, obesity, and dyslipidemia on the risk of hepatocellular carcinoma in patients with chronic liver diseases. Clin Mol Hepatol. 2022. Vol. 28(4). P. 773-789. doi: 10.3350/cmh.2021.0383.
- Diabetes, Metabolic Comorbidities and Risk of Hepatocellular Carcinoma: Results from Two Prospective Cohort Studies / T.G. Simon et al. Hepatology. 2018. Vol. 67(5). P. 1797-1806. doi: 10.1002/hep.29660.
- Voutsadakis I.A. Obesity and diabetes as prognostic factors in patients with colorectal cancer. Diabetes Metab Syndr. 2017. Vol. 11, Suppl. 1. P. S109-S114. doi: 10.1016/j.dsx.2016.12.018.
- Ward L.C. Bioelectrical impedance analysis for body composition assessment: reflections on accuracy, clinical utility, and standardisation. Eur J Clin Nutr. 2019. Vol. 73(2). P. 194-199. doi: 10.1038/s41430-018-0335-3.
- Morozov S., Sentsova T. Local inflammatory response to gastroesophageal reflux: Association of gene expression of inflammatory cytokines with esophageal multichannel intraluminal impedance-pH data. World J Clin Cases. 2022. Vol. 10(26). P. 9254-9263. doi: 10.12998/wjcc.v10.i26.9254.
- Obesity and response to anti-tumor necrosis factor-α agents in patients with select immune-mediated inflammatory diseases: a systematic review and meta-analysis / S. Singh et al. PLoS ONE. 2018. Vol. 13(5). P. e0195123. doi: 10.1371/journal.pone.0195123.
- Impact of obesity on disease activity and patient-reported outcomes measurement information system (PROMIS) in inflammatory bowel diseases / A. Jain et al. Am J Gastroenterol. 2019. Vol. 114(4). P. 630-639. doi: 10.14309/ajg.0000000000000197.
- Leptin and Obesity: Role and Clinical Implication / M. Obradovic et al. Front Endocrinol (Lausanne). 2021. Vol. 12. P. 585887. doi: 10.3389/fendo.2021.585887.
- Cariou B., Byrne C.D., Loomba R., Sanyal A.J. Nonalcoholic fatty liver disease as a metabolic disease in humans: A literature review. Diabetes Obes Metab. 2021. Vol. 23(5). P. 1069-1083. doi: 10.1111/dom.14322.
- NAFLD and cardiovascular diseases: a clinical review / P. Kasper et al. Clinical Research in Cardiology. 2021. Vol. 110(7). P. 921-937. doi: 10.1007/s00392-020-01709-7
- Abdelkader N.A., Montasser I.F., Bioumy E.E., Saad W.E. Impact of anthropometric measures and serum leptin on severity of gastroesophageal reflux disease. Dis Esophagus. 2015. Vol. 28(7). P. 691-698. doi: 10.1111/dote.12271.
- Alimi Y., Azagury D.E. Gastroesophageal Reflux Disease and the Patient with Obesity. Gastroenterol Clin North Am. 2021. Vol. 50(4). P. 859-870. doi: 10.1016/j.gtc.2021.08.010.
- Gastroesophageal reflux disease and morbid obesity: evaluation and treatment / V. Gorodner et al. Updates Surg. 2018. Vol. 70(3). P. 331-337. doi: 10.1007/s13304-018-0579-4.
- Проблема ожиріння в сучасному світі. Сайт Національної академії медичних наук України, 2021. URL: http://amnu.gov.ua/problema-ozhyrinnya-v-suchasnomu-sviti.
- Horesh A., Tsur A.M., Bardugo A., Twig G. Adolescent and Childhood Obesity and Excess Morbidity and Mortality in Young Adulthood — a Systematic Review. Curr Obes Rep. 2021. Vol. 10(3). P. 301-310. doi: 10.1007/s13679-021-00439-9.
- Wiebe N., Stenvinkel P., Tonelli M. Associations of Chronic Inflammation, Insulin Resistance, and Severe Obesity With Morta–lity, Myocardial Infarction, Cancer, and Chronic Pulmonary Disease. JAMA Netw Open. 2019. Vol. 2(8). P. e1910456. doi: 10.1001/jamanetworkopen.2019.10456.
- Visceral adiposity indices and cardiometabolic risk markers in patients with hypertension / B. Dos Santos Sena et al. Arch Endocrinol Metab. 2023. Vol. 67(2). P. 224-232. doi: 10.20945/2359-3997000000536.
- Agrawal M., Kern P.A., Nikolajczyk B.S. The Immune System in Obesity: Developing Paradigms Amidst Inconvenient Truths. Curr Diab Rep. 2017. Vol. 17(10). P. 87. doi: 10.1007/s11892-017-0917-9.
- Цитокіни, інсулінорезистентність і жорсткість артеріальної стінки в оцінюванні перебігу неалкогольної жирової хвороби печінки / Ю.М. Степанов та ін. Патологія. 2022. Т. 19, № 1(54). С. 5-11. doi: 10.14739/2310-1237.2022.1.245985.
- Мосійчук Л.М., Татарчук О.М., Сімонова О.В., Петішко О.П. Особливості цитокінового балансу при прогресуванні структурних змін слизової оболонки шлунка у хворих на атрофічний гастрит. Гастроентерологія. 2021. Т. 55, № 2. С. 67-73. doi: 10.22141/2308-2097.55.2.2021.233625.
- Chronic Adipose Tissue Inflammation Linking Obesity to Insulin Resistance and Type 2 Diabetes / F. Zatterale et al. Front Physiol. 2020. Vol. 10. P. 1607. doi: 10.3389/fphys.2019.01607.
- Ghadge A.A., Khaire A.A. Leptin as a predictive marker for metabolic syndrome. Cytokine. 2019. Vol. 121. P. 154735. doi: 10.1016/j.cyto.2019.154735.
- Tissue-Specific Effects of Leptin on Glucose and Lipid Metabolism / S. Pereira et al. Endocr Rev. 2021. Vol. 42(1). P. 1-28. doi: 10.1210/endrev/bnaa027.