Журнал «Медицина неотложных состояний» Том 19, №7, 2023
Вернуться к номеру
Клінічні дослідження анафілактичного шоку, спричиненого фурагіном: оцінка механізмів і профілактичних стратегій
Авторы: M.Z. Lisiecka
National Medical Institute of the Ministry of the Interior and Administration, Warsaw, Poland
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
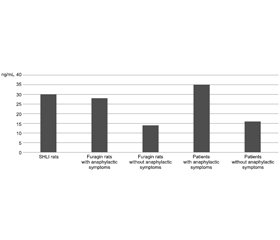
Актуальність. Анафілактичний шок, спричинений фурагіном, поширеним антимікробним препаратом, викликає серйозне занепокоєння. У роботі зроблено акцент на нагальній потребі зрозуміти його механізми та створити стратегію профілактики. Мета: з’ясувати основні механізми та фактори ризику анафілактичного шоку, спричиненого фурагіном. Матеріали та методи. У контрольованому сліпому поздовжньому дослідженні брали участь як люди, так і щури з індукованою анафілаксією. Результати. У роботі вивчали алергічні реакції в людей та індуковану анафілаксію у щурів. Безпеку, переносимість і фармакокінетику фурагіну оцінювали протягом п’яти днів у дорослих пацієнтів. Крім того, враховували ефективність попереднього лікування антигістамінними препаратами. У результаті виявлено дозозалежність алергічних реакцій у щурів, що демонструє ефективність попереднього лікування антигістамінними препаратами у зменшенні тяжкості алергічних симптомів. У пацієнтів із попередньою алергією, особливо на ліки, частіше реєстрували анафілактичні симптоми, спричинені фурагіном. Дослідження підкреслює потенціал попереднього лікування антигістамінними препаратами як профілактичної стратегії та сприяє розумінню алергічних реакцій. Ця робота надає інформацію про фактори ризику та заходи профілактики гіперчутливості, спричиненої фурагіном, що в підсумку підвищує безпеку пацієнтів. Висновки. Результати дослідження є перспективними щодо персоналізованого втручання та покращують наше розуміння реакцій гіперчутливості, спричинених ліками.
Background. The study investigates the pressing issue of furagin-induced anaphylactic shock, addres-sing the immediate need to understand its mechanisms and create preventive strategies. Anaphylactic shock due to furagin, a widely used antimicrobial drug, has raised serious concerns. The goal is to elucidate the underlying mechanisms and risk factors of furagin-induced anaphylactic shock. Materials and methods. This research delves into this critical subject through a controlled longitudinal study on both humans and induced anaphylaxis in rats. Results. Using an advanced blind controlled longitudinal design, the study evaluates allergic reactions in humans and induced anaphylaxis in rats. It also explores the safety, tolerability, and pharmacokinetics of furagin over five days in adult patients. Moreover, the study assesses the efficacy of antihistamine pre-treatment in reducing allergic reactions. Results reveal a dose-dependent trend in allergic reactions in rats, demonstrating the effectiveness of antihistamine pre-treatment in reducing the severity of allergic symptoms. Patients with previous allergies, especially to medications, exhibited increased susceptibility to furagin-induced anaphylactic symptoms. The study underscores the potential for antihistamine pre-treatment as a preventive strategy and contributes to the understanding of allergic responses. This research informs clinical practice by providing insights into risk factors and preventive measures for furagin-induced hypersensitivity, ultimately enhancing patient safety. Conclusions. The study findings hold promise for personalized interventions and advance our understanding of drug-induced hypersensitivity reactions.
антигістамінні препарати; безпека ліків; імунна відповідь; антитіла IgE; тваринна модель
antihistamine medications; drug safety; immune response; IgE antibodies; animal model
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Poziomkowska-Gęsicka I., Kostrzewska M., Kurek M. Comorbidities and cofactors of anaphylaxis in patients with moderate to severe anaphylaxis. Analysis of data from the anaphylaxis registry for West Pomerania Province, Poland. Int. J. Environ. Res. Public Health. 2021. 18(1). 333. doi: 10.3390/ijerph18010333.
- Poziomkowska-Gęsicka I., Kurek M. Clinical manifestations and causes of anaphylaxis. Analysis of 382 cases from the anaphylaxis registry in West Pomerania Province in Poland. Int. J. Environ. Res. Public Health. 2020. 17(8). 2787. doi: 10.3390/ijerph17082787.
- Hanschmann T., Francuzik W., Dolle-Bierke S., Hofmeier K.S., Grabenhenrich L. et al. Different phenotypes of drug-induced anaphylaxis — Data from the European Anaphylaxis Registry. Allergy. 2023. 78(6). 1615-1627. doi: 10.1111/all.15612.
- Dodd A., Hughes A., Sargant N., Whyte A.F., Soar J., Tur-ner P.J. Evidence update for the treatment of anaphylaxis. Resuscitation. 2021. 163. 86-96. doi: 10.1016/j.resuscitation.2021.04.010.
- Kuliniec I., Mitura P., Plaza P., Widz D., Sudol D. et al. Urinary incontinence in adulthood in a course of ectopic ureter — Description of two clinical cases with review of literature. Int. J. Environ. Res. Public Health. 2021. 18(13). 7084. doi: 10.3390/ijerph18137084.
- McGarry M.R., Wagner M.W., Wall B.M. Systemic inflammatory response syndrome secondary to nitrofurantoin. J. Investig. Med. High Impact Case Rep. 2021. 9. doi: 10.1177/2324709620984610.
- Li Z., Gao Y., Wang H., Liu Z. A rat model of Shuang Huang Lian injection-induced anaphylaxis. Asian Pac. J. Allergy Immunol. 2010. 28(2–3). 185-191.
- Sikes R.S., Bryan J.A. Institutional animal care and use committee considerations for the use of wildlife in research and education. ILAR J. 2016. 56(3). 335-341. doi: 10.1093/ilar/ilv071.
- Li X.M., Srivastava K., Grishin A., Huang C.K., Schofield B., Burks W., Sampson H.A. Persistent protective effect of heat-killed Escherichia coli producing “engineered,” recombinant peanut proteins in a murine model of peanut allergy. J. Allergy Clin. Immunol. 2003. 112(1). 159-167. doi: 10.1067/mai.2003.1622.
- Tabatabaei M.S., Ahmed M. Enzyme-linked immunosorbent assay (ELISA). Methods Mol. Biol. 2022. 2508. 115-134. doi: 10.1007/978-1-0716-2376-3_10.
- Lee J.H., Lim J.Y., Jeon Y.D., Yun D.H., Lee Y.M., Kim D.K. Wheatgrass-and-aronia-mixed extract suppresses immunoglobulin E-mediated allergic reactions in vitro and in vivo. Int. J. Mol. Sci. 2023. 24. 11979. doi: 10.3390/ijms241511979.
- Xu C., Li L., Wang C., Jiang J., Li L. et al. Effects of G-Rh2 on mast cell-mediated anaphylaxis via AKT-Nrf2/NF-κB and
- MAPK-Nrf2/NF-κB pathways. J. Ginseng Res. 2022. 46(4). 550-560. doi: 10.1016/j.jgr.2021.10.001.
- Ganeshanandan L., Lucas M. Drug reaction with eosinophilia and systemic symptoms: A complex interplay between drug, T cells, and herpesviridae. Int. J. Mol. Sci. 2021. 22(3). 1127. doi: 10.3390/ijms22031127.
- Joulia R., Guerrero-Fonseca I.M., Girbl T., Coates J.A., Stein M. et al. Neutrophil breaching of the blood vessel pericyte layer during diapedesis requires mast cell-derived IL-17A. Nat. Commun. 2022. 13. 7029. doi: 10.1038/s41467-022-34695-7.
- Kozma G.T., Shimizu T., Ishida T., Szebeni J. Anti-PEG antibodies: Properties, formation, testing and role in adverse immune reactions to PEGylated nano-biopharmaceuticals. Adv. Drug Deliv. Rev. 2020. 154–155. 163-175. doi: 10.1016/j.addr.2020.07.024.
- Shiohara T., Inaoka M., Kano Y. Drug-induced hypersensitivity syndrome (DIHS): A reaction induced by a complex interplay among herpesviruses and antiviral and antidrug immune responses. Allergol. Int. 2006. 55(1). 1-8. doi: 10.2332/allergolint.55.1.
- Mackay G.A., Fernandopulle N.A., Ding J., McComish J., Soeding P.F. Antibody or anybody? Considering the role of MRGPRX2 in acute drug-induced anaphylaxis and as a therapeutic target. Front. Immunol. 2021. 12. 688930. doi: 10.3389/fimmu.2021.688930.
- De Silva D., Singh C., Muraro A., Worm M., Alviani C. et al. Diagnosing, managing and preventing anaphylaxis: Systematic review. Allergy. 2021. 76(5). 1493-1506. doi: 10.1111/all.14580.
- Krishnaswamy G. Critical care management of the patient with anaphylaxis: A concise definitive review. Crit. Care Med. 2021. 49(5). 838-857.
- Nazarchuk O., Dmyrtriiev D., Babina Y., Faustova M., Burkot V. Research of the activity of local anesthetics and antiseptics regarding clinical isolates of Acinetobacter baumannii as pathogens of postoperative infectious complications. Acta Biomed. 2022. 93(1). e2022003.
- Skak K., Tabriz N.S., Nurtazina Z.B., Mutaikhan Z. Drug-resistant tuberculosis and modern approaches towards its diagnosis. Res. J. Pharmaceut. Biol. Chem. Sci. 2016. 7(5). 3098-3104.
- Messina A., Concerto C., Rodolico A., Petralia A., Caraci F., Signorelli M.S. Is it time for a paradigm shift in the treatment of schizophrenia? The use of inflammation-reducing and neuroprotective drugs — A review. Brain Sci. 2023. 13(6). 957. doi: 10.3390/brainsci13060957
- Cianferoni A. Non-IgE-mediated anaphylaxis. J. Allergy Clin. Immunol. 2021. 147(4). 1123-1131. doi: 10.1016/j.jaci.2021.02.012.
- Malochtan L.N., Shatalova O.M., Kononenko A.G., Shcherbak E.A. Comparative study of toxicological properties of aquaous extract from feijoa leaves by in vitro and in vivo methods. Azerb. Pharmaceut. Pharmacother. J. 2020. 20(2). 34-40.
- Regateiro F.S., Marques M.L., Gomes E.R. Drug-induced anaphylaxis: An update on epidemiology and risk factors. Int. Arch. Allergy Immunol. 2020. 181(7). 481-487. doi: 10.1159/000507445.
- Kitamura K., Ito T., Ito K. Comprehensive hospital-based regional survey of anaphylaxis in Japanese children: Time trends of triggers and adrenaline use. Allergol. Int. 2021. 70(4). 452-457. doi: 10.1016/j.alit.2021.04.009.
- Belenichev I., Burlaka B., Bukhtiyarova N., Aliyeva O., Makyeyeva L., Bak P. The effect of intranasal administration of an IL-1b antagonist (rail) on the state of the nitroxydergic system of the brain during modeling of acute cerebrovascular accident. Azerb. Pharmaceut. Pharmacother. J. 2023. 22(1). 78-85.